NJO抑制肿瘤细胞增殖的效力及其作用机制
任 宏,龙启才
(1.广东食品药品职业学院,广东 广州 510520;2.中山大学药学院,广东 广州 510006)
自从流行病学研究发现长期小剂量服用阿司匹林可以预防家族性多发性结肠息肉的癌变,就开始了非甾体类抗炎药的抗肿瘤研究[1-4]。非甾体类抗炎药主要是通过抑制前列腺素合成的限速酶环氧化酶的活性发挥作用。20世纪80年代末发现环氧化酶存在Ⅰ型和Ⅱ型2种同工酶[5]。选择性环氧化酶Ⅱ型抑制剂既可以发挥非甾体类抗炎药的抗肿瘤药理作用[6],又可以避免这类药物的胃肠道相关毒副反应,成为抗肿瘤药物的研究热点。邻吡啶醌二取代衍生物(m-pyridine-quinone two replace derivatives,NJO)是由中山大学药学院和香港科技大学联合开发的新型选择性环氧化酶Ⅱ型抑制剂(专利号:CN02130161.1),本课题主要研究了NJO体内外的抗肿瘤作用,现报道如下。
1 材料与方法
1.1 药品 NJO由中山大学药学院提供,4℃保存。NJO用DMSO溶解,现用现配,加药后溶液中DMSO的终浓度<0.25%。
1.2 细胞株 人结肠肿瘤细胞株HT-29,购自中山大学药学院动物中心;人肺肿瘤细胞株Glc-82、人肝肿瘤细胞株Bel-7402,由中山大学肿瘤研究所惠赠;人肝肿瘤细胞株HepG2,由中山大学第二附属医院中心实验室惠赠。所有细胞于37℃、体积分数5%CO2的细胞培养箱中,DMEM培养基加体积分数5%小牛血清常规细胞培养。
1.3 NJO对4种肿瘤细胞株的体外抑制实验[7]取处于指数生长期的 Bel-7402、Glc-82、HT-29、HepG2细胞,质量分数0.25%胰酶消化,吹散成均匀的单细胞悬液,200 μL接种于 96 孔板,贴壁后分别加 0.5 μL终浓度分别为 0.725、1.250、2.500、5.000、10.000、20.000、40.000 g·L-1的 NJO,DMSO 作为阴性对照,5.000、10.000、20.000、40.000、80.000、160.000 μmol·L-1终浓度的塞来昔布作为阳性对照。采用噻唑蓝(MTT)法测定各组培养后OD值,取各组平均数计算存活率,公式如下:存活率=(试验孔OD值/空白对照组OD值)×100%
1.4 透射电镜下细胞形态观察[8]取对数生长期的4种细胞4 mL,分别培养在50 mL的培养瓶中待细胞完全长满。加入药物40 g·L-1的 NJO 10 μL。放入到培养箱中孵育48 h后,移走培养基,用胰酶消化细胞并收集到离心管中,离心10 min,吸掉上清液,制成5 mL重悬细胞。将细胞团投入到含有戊二醛的透射电镜固定液中4℃保存。用PBS洗1次后加入质量分数1%锇酸固定30 min,常规电镜样品制备程序脱水、渗透、包埋细胞制成腊块,用超薄切片机切片,铀铅染色。在透射电镜下观测加药后细胞内的变化。
1.5 DNA片段电泳图分析 取对数生长期的4种细胞4 mL,分别培养在50 mL的培养瓶中待细胞完全长满。加入40 g·L-1药物10 μL。放入到培养箱中孵育48 h后移走培养基,收集到离心管中,以1000 r·min-1的速率收集上清液中细胞,离心后将离心管中上清液弃掉。细胞移入EP管(1 mL)中,加入细胞裂解液(细胞裂解液含 10 mmol·L-1Tris-Hcl、1 mmol·L-1EDTA 和 2 g·L-1TritonX-100,pH 7.5)0.3 mL。细胞培养瓶中的细胞用冷PBS洗2次,直接加入细胞裂解液0.3 mL放入到4℃的冰箱中20 min。之后以12000 r·min-1的速率离心10 min。吸取上清液加入等体积的酚和氯仿的混合液(体积比为1∶1),抽提1次,以12000 r·min-1的速率离心10 min取上清液。将上清液中加入300 mmol·L-1的乙酸钠和等体积异丙醇沉淀过夜。2000 r·min-1的速率离心后收集沉淀,体积分数70%乙醇洗2次,干燥后加入Tris-Hcl 10 mmol· L-1、EDTA 1 mmol· L-1和0.6 g·L-1的 Rnase,在37 ℃的水浴箱中孵育30 min。样品放到-20℃的冰箱中保存。将样品在质量分数1.0%琼脂糖凝胶上电泳1 h,电泳采用40 mV的低电压。溴化乙锭染色后用GDS自动照相仪器拍照,进行电泳图像分析。
1.6 流式细胞仪分析[9]取对数生长期的HepG2细胞株用胰酶消化后,调整细胞浓度为5×105mL-1,取4 mL装于50 mL的细胞培养瓶中。贴壁12 h后加入药物 NJO 10 μL(20 g·mL-1),阴性对照组加入等体积的DMSO溶液,阳性对照组加入20 μL的塞来昔布。每孔设有1个平行孔。分别收集加入药物0、12、24、48 h各时间点的细胞。离心后加入0.3 mL PBS混匀,加入4℃的无水乙醇,-20℃条件下固定过夜。用PBS在常温下洗2次,最后与1 mL的含有PI的PBS染色混匀后在4℃条件下避光放置30 min(15 mg·L-1,0.5%Tween-20,2.5 μg Rnase),上流式细胞仪检测,记录激发波长488 nm处的红色荧光。
2 结果
2.1 MTT法实验结果 结果显示NJO可以显著抑制 Bel-7402、Glc-82、HT-29、HepG24 种肿瘤细胞的增殖。对于 4种肿瘤细胞株的 IC50分别为 101 μmol·L-1(13.90 g·L-1)、104 μmol·L-1(14.20 g·L-1)、201 μmol· L-1(27.00 g · L-1)、140 μmol·L-1(19.00 g·L-1)。而阳性对照塞来昔布对Bel-7402、Glc-82、HT-29、HepG2 的 IC50分别为 76 μmol·L-1、73 μmol·L-1、89 μmol·L-1、98 μmol·L-1。提示NJO可能对多种肿瘤细胞株均有抑制作用。见表1。
2.2 NJO抑制肿瘤生长的机制
2.2.1 透射电镜下观察结果 NJO作用后诱导细胞凋亡早期的染色质的变化,染色质固缩,核皱缩,细胞整体体积变小(图1A)。接着细胞核进一步固缩(图1B),聚集于核膜边界上形成境界分明的块状,围绕整个核膜环状排列,形成凋亡所特有的环状分布。核膜破裂,细胞核分成3~4个小核,细胞浆浓缩或裂解成质膜包绕碎片,细胞质中可见较完整的细胞器(如高尔基体、内质网等),细胞膜内陷。细胞体积进一步缩小(图1C),最终可见凋亡小体形成(图1D)。透射电镜观察结果还显示NJO作用细胞48 h后呈现出凋亡不同时期的不同形态特征。提示NJO可以明显诱导细胞凋亡的数量增加。
2.2.2 DNA电泳结果 NJO作用48 h后,对 Bel-7402、Glc-82、HT-29、HepG24 种细胞的 DNA 片段进行提取,DNA琼脂糖凝胶电泳法的结果显示电泳带上呈现有等倍距离的梯状条带,DNA片段长度为180~200 bp之间。梯状条带是凋亡细胞所特有的生化特征,与坏死时的呈模糊片状条带差异明显。提示NJO主要是通过诱导4种肿瘤细胞凋亡的途径来达到抑制肿瘤细胞增殖的目的。见图2。
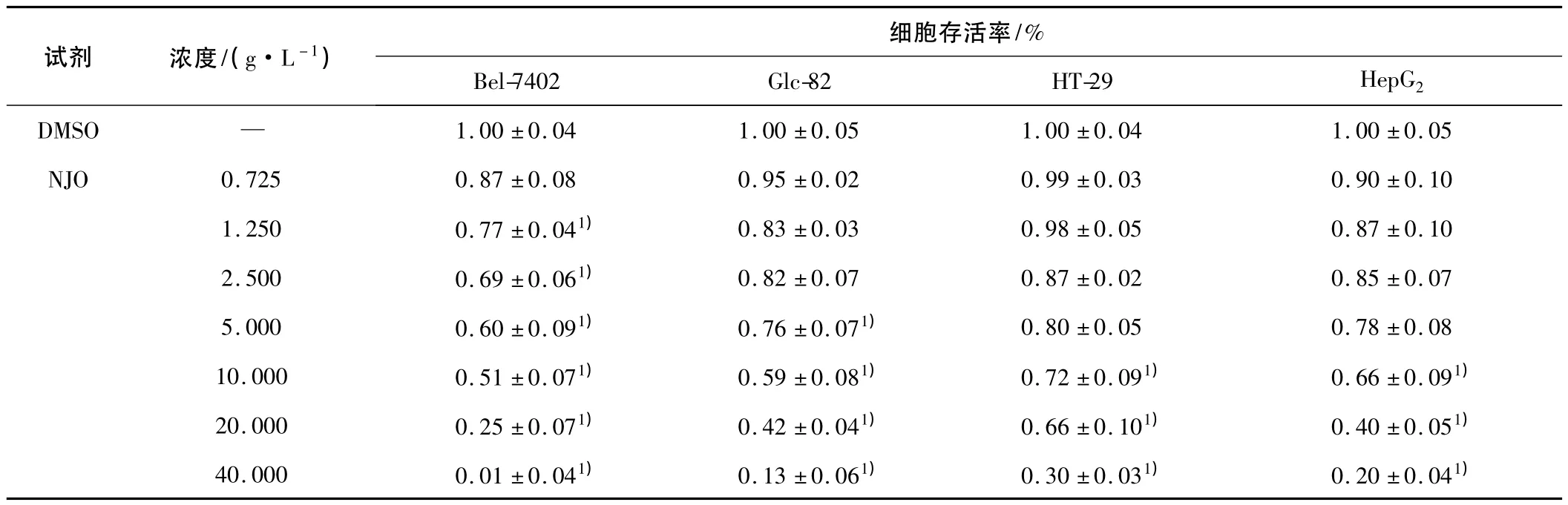
表1 NJO作用48 h时4种肿瘤细胞的存活率及其IC50

图1 40 g·L-1NJO作用于HepG2细胞24 h后细胞形态变化
2.2.3 流式细胞仪测定结果 结果显示给药20 g·L-1后6 h G1峰的左侧出现亚二倍体细胞群的峰形,12 h后细胞凋亡率为27.9%。随着时间的推移亚二倍体峰形增大,在给药后24 h达到最大,此时的细胞凋亡率为49.7%,同时G0期峰形逐渐增大,多数细胞阻滞在G0期,细胞周期分配改变。48 h后多数细胞死亡,出现细胞死亡的峰形。在细胞周期中不同时期,细胞数量均有不同程度的减少,亚二倍体的细胞数量的多少不等。见图3。


3 讨论
肿瘤组织环氧化酶Ⅱ型蛋白的高表达促使人们在环氧化酶Ⅱ型抑制剂中寻找抗肿瘤药物。NJO是新开发的选择性环氧化酶Ⅱ型抑制剂。对环氧化酶Ⅱ型的选择性与塞来昔布接近,选择倍数超过300倍,而对于环氧化酶Ⅰ型的选择性只有100倍[6]。其抗肿瘤作用值得研究。本研究采用MTT法发现NJO可明显抑制4种肿瘤细胞的增殖,药物浓度与抑制率存在一定范围的浓度依赖性,是一种有前途的抗肿瘤药物。同时NJO对多种肿瘤细胞增殖有抑制作用,抗瘤谱较广,具有潜在的开发价值。在进一步探讨抗肿瘤作用机制时,通过加药后观察肿瘤细胞形态学的变化、DNA片段琼脂糖凝胶电泳和流式细胞仪的数据结果发现NJO主要是通过阻滞肿瘤细胞周期,诱导肿瘤细胞凋亡的途径来达到抑制肿瘤细胞增殖的目的。提示NJO可以作为各种肿瘤的辅助治疗,临床意义重大。
[1]Jacoby RF,Marshall DJ,Newton MA,et al.Chemoprevention of spontaneous intestinal adenomas in the Apc Min mouse model by the nonsteroidal anti-inflammatory drug piroxicam[J].Cancer Res,1996,56(4):710 -714.
[2]Thun MJ,Namboodiri MM,Heath CW Jr.Aspirin use and reduced risk of fatal colon cancer[J].N Engl J Med,1991,325(23):1593-1596.
[3]Xin B,Yokoyama Y,Shigeto T,et al.Anti-tumor effect of non-steroidal anti-inflammatory drugs on human ovarian cancers[J].Pathol Oncol Res,2007,13(4):365 -369.
[4]Mann JR,DuBois RN.Cyclooxygenase-2 and gastrointestinal cancer[J].Cancer J,2004,10(3):145 - 152.
[5]DuBois RN,Tsujii M,Bishop P,et al.Cloning and characterization of a growth factor-inducible cyclooxygenase gene from rat intestinal epithelial cells[J].Am J Physiol,1994,266(5 Pt 1):G822-G827.
[6]Menter DG,Schilsky RL,DuBois RN.Cyclooxygenase-2 and cancer treatment:understanding the risk should be worth the reward[J].Clin Cancer Res,2010,16(5):1384 -1390.
[7]Wang ZL.Properties of nanobelts and nanotubes measured by in situ TEM[J].Microsc Microanal,2004,10(1):158 -166.
[8]Zhong L,Li P,Han J,et al.Structure-activity relationships of saponins from Gleditsia sinensis in cytotoxicity and induction of apoptosis[J].Planta Med,2004,70(9):797 -802.
[9]王玉堂,文允镒,庞焕,等.人和猪源性红细胞降压因子作用的比较[J].中国医学科学院学报,2002,24(4):343 -347.

