云南五种蕨类植物的抗寒性生理指标测定*
高丽会
(姚安县第一中学,云南 姚安 675300)
植物的生长发育受到温度、降水和日照等气候要素的综合影响,温度是植物生长的三大环境条件之一,也是植物自然地理分布的一个主要限制因素[1]。低温促使植物细胞间隙的水形成冰晶,并继续夺取细胞中的水分,冰晶逐渐扩大,不仅消耗了细胞水分,还引起原生质脱水使原生质胶体变质,从而使细胞脱水引起危害;同时,低温还破坏细胞膜和原生质的结构,影响细胞代谢过程。把植物组织放在外界溶液中,植物组织中的水分和外界溶液中的水分进行交流,从而使外界溶液的浓度发生变化。溶液浓度不同,比重不同,当两个不同浓度的溶液相遇时,稀的由于比重小而上浮,浓的由于比重大而下沉,通过观察液滴的升降情况而判断溶液浓度的变化,从而测定植物组织的水势[2]。植物细胞中的水分,可分为自由水和束缚水。自由水是可以移动的,生理上活跃的组织中,大部分水 (包括液泡水)是自由水。随着温度下降,细胞内亲水性胶体加强,使束缚水含量相对提高,而自由水含量则相对减小。由于束缚水不易结冰和蒸腾,所以总含水量减小和束缚水量相对增加有利于植物抗寒性的加强[3]。电解质渗透率是反映植物受伤害程度的重要指标,电解质渗透率越高,则植物受到的伤害就越重[4]。本文通过叶片水势、束缚水/自由水比例和电解质渗透率三个生理指标对哀牢山5种蕨类植物进行抗寒性测定,并比较它们的抗寒性大小,为蕨类植物抗寒性生理研究提供一定的理论参考价值。
1 材料与方法
1.1 试验材料
试验材料采自云南省姚安县前场镇,共5种蕨类植物,经楚雄师范学院徐成东教授鉴定,分别为:裸果耳蕨Polystichum nudisorum、重齿鳞毛蕨Dryopteris juxtaposita、干旱毛蕨Pellaea trichophylla、刺叶耳蕨Polystichum acanthophyllum、鸡足山耳蕨Polystichum jizhushanense。
1.2 试验器材及试剂
器材:DDS307型数字电导仪、冰箱、电炉、天平、剪刀、解剖针、镊子、三角瓶、试管、试管架、细滴管、移液管、滤纸。
试剂:甲烯蓝粉末;蔗糖溶液 (1mol·L-1)、蒸馏水。
1.3 细胞水势测定——小液流法[5]
试验方法及步骤:(1)配制一系列浓度递增的蔗糖 (0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8mol·L-1)各10ml,注入试管中,各管都加上塞子并编号。按编号顺序排成一列,放在试管架上,作为对照组。(2)另取8支试管并编号,按顺序放在试管架上,作为试验组。然后由对照组中之各试管中分别取溶液4ml移入相同编号的试验组试管中,再将各试管都加上塞子。(3)用剪刀将分别将5种蕨类植物的叶剪成大小相等的小块,各约40—50片。向试验组的每一试管中各加相等数目的叶片小块,塞好塞子,放置30分钟,在这段时间内摇动数次,到时间后,向每一试管中各加次甲基蓝粉末少许,并振荡,使溶液着色均匀。(4)用毛细吸管从试验组的各试管中依次吸取着色的液体少许,然后伸入对照组的相同编号试管的液体的中部,缓慢放出一滴蓝色试验溶液,并观察小液流移动的方向,并记录。
水势值计算公式,记录小液流不动的试管中蔗糖溶液的浓度,按ψπ=-RTiC计算水势值。式中 ψπ为细胞水势,R为气体常数0.083×105L·Pa/mol·k,T为绝对温度即273℃ +t(t为实验温度),i为解离系数 (蔗糖为1),C为等渗溶液的浓度。
1.4 水分含量测定——称重法[6]
试验方法及步骤:(1)取称量瓶6只编号,取完整叶片,剪成几片面积相当的叶片,立即称重后装入称量瓶中。(2)把其中三只称量瓶放入烘箱中,于105℃下杀青15min,然后转入75℃下烘干至恒重,计算其总含水量。另外3只称量瓶加入蕨类植物组织质量6倍的60%—65%糖液。置于暗处6 h后将叶片取出 (其间不时轻轻摇动),用湿纱布和滤纸吸去表面糖液,立即称重,计算其自由水含量。
计算公式:
①植物组织中自由水含量 (%)= 〔(浸泡前叶片质量-浸泡后叶片质量)/浸泡前叶片质量〕×100%;
②植物组织中束缚水含量 (%)=总含水量-自由水含量。
1.5 抗寒性测定——电导法[7]
试验方法及步骤:
(1)将采集的每种试验材料的叶片平均分成6份,分别置于12,4,0,-4,-8,-12℃的冰箱内冷冻处理5h,其中12℃处理作为对照 (此时自然环境温度约为12℃左右)。(2)低温冷冻处理后的叶片,置于滤纸上晾干。然后将枝条剪成2~3mm长的小段,每种试材等量称取3份,每份质量1g,投入3个三角瓶中 (即重复3次),每瓶加入100ml蒸馏水,浸泡48h后用DDS2307W型数字电导仪测定浸出液电导率 (测时摇匀),每瓶重复测定3次。(3)将测定后各试材样品恒温 (95~96℃)煮30min后,加蒸馏水补充至煮前刻度,再次测定其电导率,计算各供试样品的电解质外渗率,以代表样品抗寒力的强弱。
计算公式:
电解质渗透率 (%)=(样品低温处理后电导率-对照电导率)÷ (样品煮沸后电导率-对照电导率)×100
2.结果与分析
2.1 水势差异分析
从表1可以看出,不同种蕨类植物的水势存在差异,裸果耳蕨的水势值最高,刺叶耳蕨的水势最低。水势值从高到低依次为:裸果耳蕨、鸡足山耳蕨、重齿鳞毛蕨、干旱毛蕨、刺叶耳蕨,其中重齿鳞毛蕨和干旱毛蕨差异不明显,其余的差异明显。

表1 5种蕨类植物的水势测定结果
2.2 束缚水和自由水比例差异分析
从图2可以看出来,不同种蕨类植物的束缚水/自由水比例存在差异,裸果耳蕨的束缚水/自由比例最高,鸡足山耳蕨最低。束缚水/自由水比例从高到低依次为:裸果耳蕨、重齿鳞毛蕨、干旱毛蕨、刺叶耳蕨、鸡足山耳蕨。所有蕨类植物差异明显。
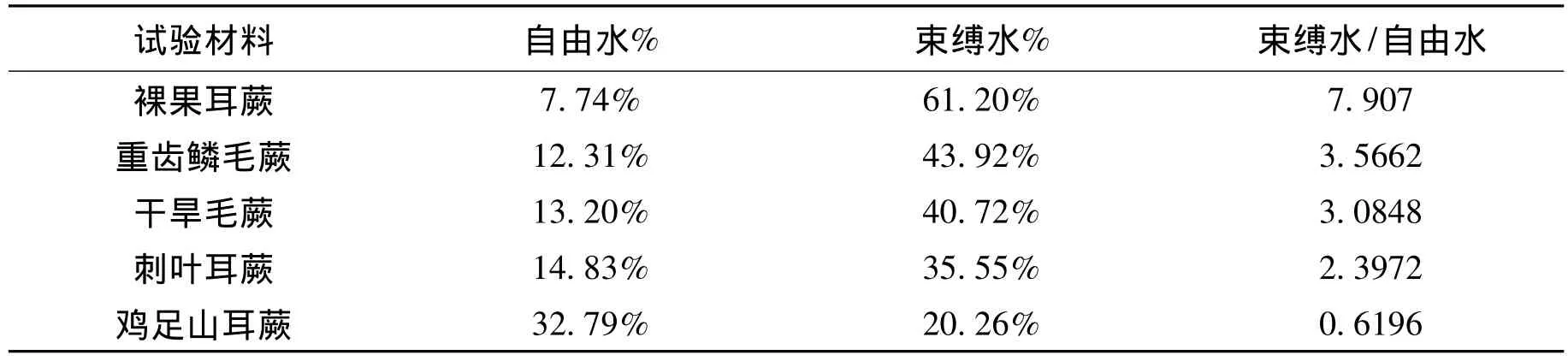
表2 5种蕨类植物的束缚水/自由水测定结果
2.3 电解质外渗率差异分析
植物细胞的质膜,是一种对低温极为敏感的半透性生物膜。当温度降低到一定程度后,再降低则引起膜相破坏、细胞内电解质外渗[8]。不同种蕨类植物的细胞原生质透性不同,电解质渗透量不同,因此抗寒力也不同。电解质外渗量越大,抗寒力越弱。
从表3中可以看出来,(1)4℃条件下裸果耳蕨的电解质渗透率最低,鸡足山耳蕨的电解质渗透率最高。电解质渗透率从高到低排列顺序为:鸡足山耳蕨、刺叶耳蕨、干旱毛蕨、重齿鳞毛蕨、裸果耳蕨,5种蕨类植物电解质渗透率差异明显。
(2)0℃条件下裸果耳蕨的电解质渗透率最低,刺叶耳蕨的电解质渗透率最高。电解质渗透率从高到低排列顺序为:刺叶耳蕨、鸡足山耳蕨、干旱毛蕨、重齿鳞毛蕨、裸果耳蕨。从差异角度分析:裸果耳蕨和重齿鳞毛蕨、干旱毛蕨、刺叶耳蕨、鸡足山耳蕨差异明显;重齿鳞毛蕨和干旱毛蕨、刺叶耳蕨、鸡足山耳蕨差异明显;干旱毛蕨和刺叶耳蕨差异明显,和鸡足山耳蕨差异不明显;刺叶耳蕨和鸡足山耳蕨差异明显
(3)-4℃条件下裸果耳蕨的电解质渗透率最低,刺叶耳蕨的电解质渗透率最高。电解质渗透率从高到低排列顺序为:刺叶耳蕨、鸡足山耳蕨、重齿鳞毛蕨、干旱毛蕨、裸果耳蕨。从差异角度分析:裸果耳蕨和重齿鳞毛蕨、干旱毛蕨、刺叶耳蕨、鸡足山耳蕨差异明显;重齿鳞毛蕨和干旱毛蕨、刺叶耳蕨差异明显,和鸡足山耳蕨差异不明显;干旱毛蕨和刺叶耳蕨、鸡足山耳蕨差异明显;刺叶耳蕨和鸡足山耳蕨的差异明显。
(4)-8℃条件下裸果耳蕨的电解质渗透率最低,鸡足山耳蕨的电解质渗透率最高。电解质渗透率从高到低排列顺序为:鸡足山耳蕨、刺叶耳蕨、干旱毛蕨、重齿鳞毛蕨、裸果耳蕨。从差异角度分析:裸果耳蕨和重齿鳞毛蕨、干旱毛蕨、刺叶耳蕨、鸡足山耳蕨差异明显;重齿鳞毛蕨和干旱毛蕨、刺叶耳蕨、鸡足山耳蕨差异明显;干旱毛蕨和刺叶耳蕨差异不明显,和鸡足山耳蕨差异明显;刺叶耳蕨鸡足山耳蕨差异明显。
(5)-12℃条件下裸果耳蕨的电解质渗透率最低,刺叶耳蕨的电解质渗透率最高。电解质渗透率从高到低排列顺序为:刺叶耳蕨、鸡足山耳蕨、干旱毛蕨、重齿鳞毛蕨、裸果耳蕨。从差异角度分析:裸果耳蕨和重齿鳞毛蕨、干旱毛蕨、刺叶耳蕨、鸡足山耳蕨差异明显;重齿鳞毛蕨和干旱毛蕨、刺叶耳蕨、鸡足山耳蕨差异明显;干旱毛蕨和刺叶耳蕨差异不明显,和鸡足山耳蕨差异明显;刺叶耳蕨鸡足山耳蕨差异明显。
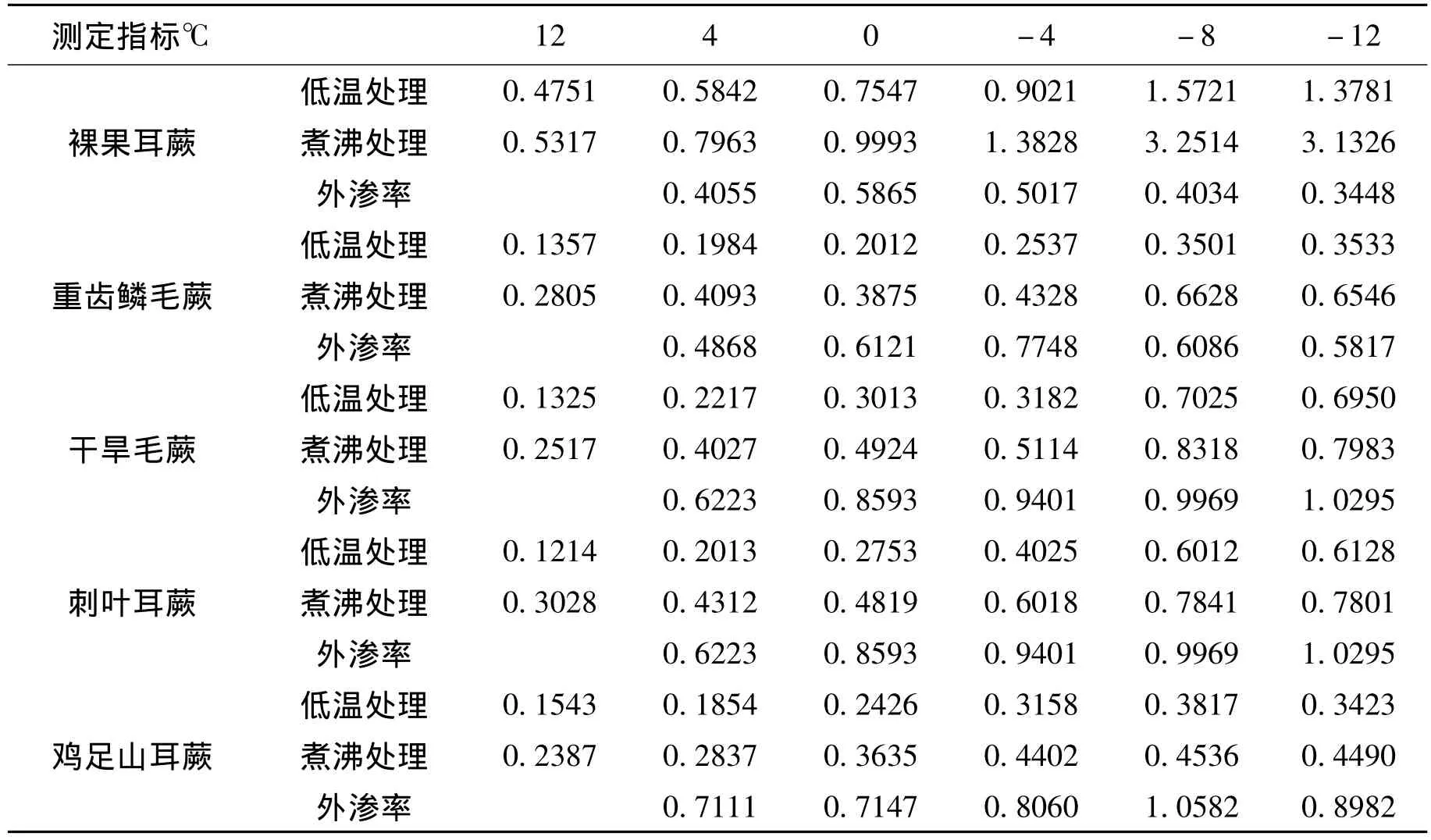
表3 5种蕨类植物电解质外渗率测定结果
上述结果表明,各种蕨类植物抗寒性由强到弱大致顺序为裸果耳蕨、重齿鳞毛蕨、干旱毛蕨、刺叶耳蕨、鸡足山耳蕨。从图3中可以看出,温度降低,电解质渗透率总体增加,但温度与电解质渗透率并不成线形关系,如鸡足山耳蕨在0℃、-4℃、-12℃的条件下电解质渗透率降低,由于长时间处在低温条件下其叶片生物膜遭到破坏且不能恢复导致死亡,电解质不能再继续大量渗透,所以渗透率突然降低。
3 结论与讨论
(1)蕨类植物的抗寒性与水势、束缚水/自由水比例、电解质渗透率有密切的关系。当温度降低时,由于各种逆境作用于植物,同时也直接或间接地对植物产生水分胁迫,使细胞脱水,膜系统受害,透性加大,渗透势降低,水势也降低。自由水与束缚水是水分在植物体内的两种不同的存在状态。自由水与束缚水比值高时,植物组织或器官的代谢活动旺盛,生长也较快,抗逆性较弱;反之,则生长较缓慢,但抗性较强。在低温锻炼过程中叶片含水率下降,自由水与束缚水值变小,有利于提高植物体的抗寒能力,这已被研究证实[9]。植物组织细胞受冻后,首先损伤的是细胞膜系统,造成细胞内大量物质外渗,植物抗寒力越差,细胞受冻程度愈重,其外渗物质也就越多。因此,测定组织细胞受冻后外渗物质的多少,就可以评价抗寒性强弱[10]。
(2)从水势、束缚水/自由水比例、电解质渗透率三个生理指标上来比较五种蕨类植物的抗寒性,裸果耳蕨的抗寒性最强,重齿鳞毛蕨、干旱毛蕨、刺叶耳蕨的抗寒性相对较弱,鸡足山耳蕨的抗寒性最弱。五种蕨类植物的抗寒性顺序依次为:裸果耳蕨﹥重齿鳞毛蕨﹥干旱毛蕨﹥刺叶耳蕨﹥鸡足山耳蕨。
(3)用叶片束缚水/自由水比例和电解质渗透率作指标来衡量蕨类植物的抗寒性,操作较简单、方便,测定结果能较准确反映样品抗寒性。虽然植物的抗寒性能由遗传性状和环境因素综合作用决定,但是受环境的影响和塑造较大,生长在不同地域的同种蕨类植物可能具有不同的抗寒能力。
[1]潘瑞炽,董愚得.植物生理学 (第三版)[M].北京:高等教育出版社,1995,10—12.
[2]李合生.植物生理生化实验原理和技术 [M].北京:等教育出版社,2000,134—138.
[3]纪忠雄.柑桔抗寒性的生理生化指标 [J].园艺学报,1983,10(4):239.
[4]简令成.植物抗寒生理的研究进展 [J].植物学通报,1992,(3):17—25.
[5]曹宗巽,吴相钰.植物生理学 (上册)[M].北京:人民教育出版社,1979,129—130.
[6]山东农学院,西北农学院.植物生理学实验指导 [M].山东科学技术出版社,1980.
[7]陈建白.电导法在植物抗寒研究中的应用 [J].云南热作科技,1999,22(1):26—28.
[8]王洪春.植物抗性生理.植物生理学通讯 [J].1981,(6):72—81.
[9]曹慧,兰彦平.果树水分胁迫研究进展 [J].果树学报,2001,18(2):110—114.
[10]罗正荣,舒晓东,李春初,等.柑桔抗冻性鉴定技术规范研究 [J].果树学报,1992,9(4):13—17.

