不同刺槐种源根瘤菌16S rDNA的PCR-RFLP分析1)
张泽坤 韩 骞 杨敏生 王进茂
(河北农业大学,保定,071000)
根瘤菌是一类存在于土壤中的能侵染豆科植物的根部共生形成根瘤,并将空气中的氮还原成氨供植物营养的一类革兰氏阴性菌。根瘤菌遗传多样性一直是国内外学者研究的重点。然而,多年来豆科植物根瘤菌资源多样性的研究多偏重于与农牧业关系密切的豆科作物和牧草方面,对豆科树种根瘤菌的研究较少。在研究豆科植物和根瘤菌共生固氮关系的文献中,刺槐根瘤菌共生体被作为研究对象的的报道不常见。特别是关于不同地理环境下不同种源刺槐根瘤菌的遗传多样性研究还未见报道。根瘤菌与豆科植物的共生固氮作用受宿主的基因型、根瘤菌的竞争结瘤能力及环境因素的影响[1-2]。区域地理环境对根瘤菌与宿主共生关系的影响很大,有的豆科植物在不同的地理区域中会与不同种的根瘤菌结瘤固氮[3]。本研究采用16S rDNA PCR-RFLP分子标记技术,对分离自2种地理环境中的19个不同刺槐种源的38株根瘤菌和6株参比菌株进行了遗传多样性分析,并通过代表菌株测序确定其系统发育地位,讨论不同地理环境下不同种源刺槐与共生根瘤菌遗传多样性差异,为合理开发利用根瘤菌资源提供理论依据。
1 材料与方法
1.1 材料
以河北农业大学保定教学基地(土壤类型为壤土,BD)和石家庄高邑林场(土壤类型为黏土,GY)栽植的2片刺槐(Robinia pseudoacacia)种源试验林为对象,19个种源种子的产地见表1。2005年3月份将19个种源的1年生苗木在河北农业大学保定教学基地和河北高邑林场建立种源试验林。采用随机完全区组设计,4次重复,10株小区,试验林采用穴植,株行距1 m×2 m,试验地周围设保护行。2008年从每一片试验林中分别采集19个刺槐种源样本的根瘤。采用Vincent经典方法[4]进行分离、纯化,并镜检验证,待测菌株编号按顺序从BD-1至BD-19、GY-1至GY-19。6株参比菌株购自中国农业大学菌种保藏中心,分别为USDA6T(慢生大豆根瘤菌(Bradyrhizobium japonicum))、USDA1002T(苜蓿中华根瘤菌(Sinorhizobium meliloti))、USDA205T(费氏中华根瘤菌(Sinorhizobium fredii))、USDA2370T(豌豆根瘤菌(Rhizobium leguminosarum))、ACCC19665T(紫穗槐根瘤菌(Mesorhizobiumamorphae))、NZP2213T(百脉根根瘤菌(Mesorhizobium loti))。
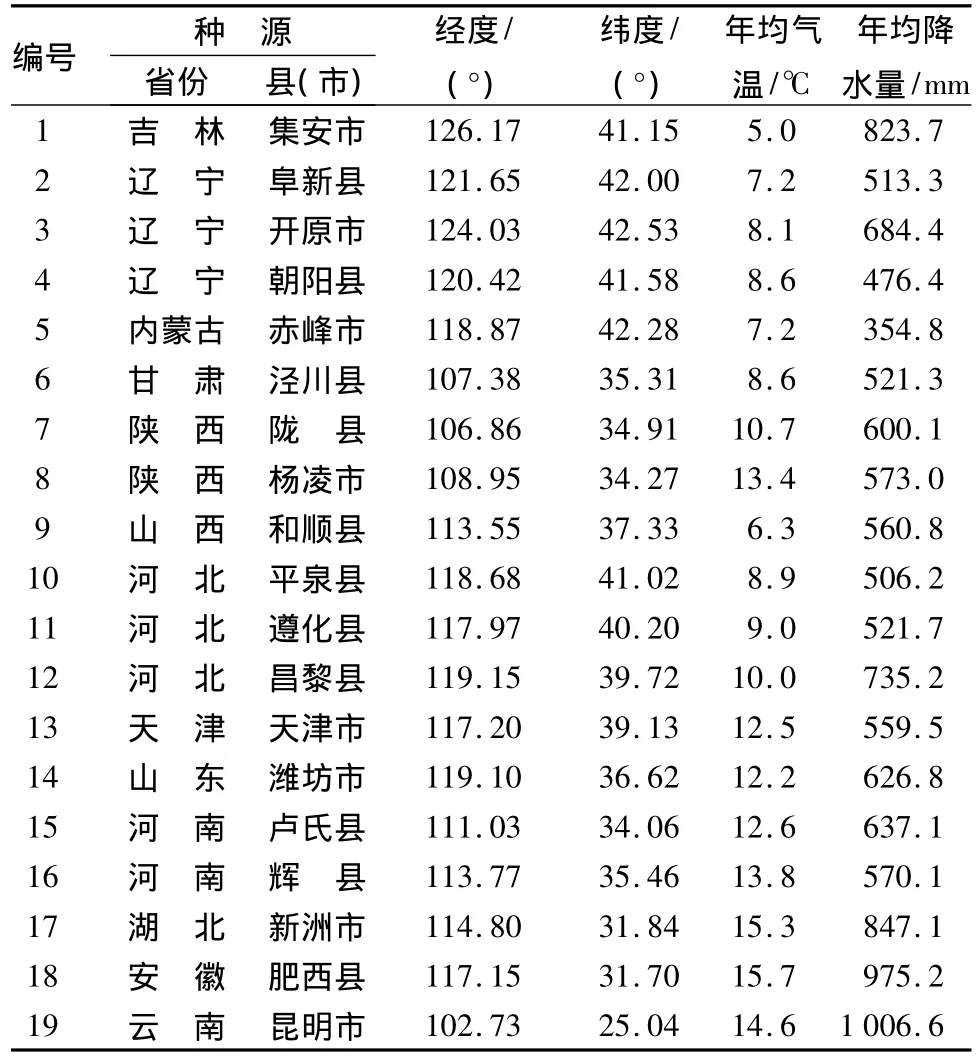
表1 19个刺槐种源产地气象因子
1.2 菌体培养及总DNA提取
菌株经YMA斜面活化后,接种于TY培养液(胰蛋白胨 5.0 g/L,酵母粉 3.0 g/L,CaCl21.3 g/L,pH6.8~7.0)中振荡培养,28℃培养至对数中后期,收集菌体。DNA提取方法参照文献[5]。YMA培养基的配方为甘露醇 10.0 g/L,酵母粉 1.0 g/L,K2HPO40.5 g/L,MgSO4·7H2O 0.2 g/L,NaCl 0.1 g/L,CaSO40.2 g/L。Rh微量元素液主要成分为H3BO35 g/L,Na2MnO45 g/L,pH6.8 ~7.0。
1.3 16S rDNA的PCR扩增
PCR扩增所用引物来源于E.coli 16S rDNA基因序列保守区域,正向引物P1(5'-AgA gTT TgA TCM Tgg CTC Ag-3'),反向引物 P6(5'-AAg gAg gTg WTC CAR CC-3')。
PCR 扩增反应体系:10×PCR Buffer 5 μL,10 mmol/L dNTP 1 μL,10 μmol/L P1 和 P6 各 1 μL,DNA 模板 1 μL,5 U/μL DNA 聚合酶 0.5 μL,补足ddH2O 至 50 μL。
PCR扩增条件:95℃预变性3 min;94℃变性30 s,53 ℃ 退火 40 s,72 ℃ 延伸 40 s,30 个循环后于72℃保温7 min。扩增产物用1%琼脂糖凝胶电泳检测PCR产物大小(约1.5 kb)。
1.4 16S rDNA PCR-RFLP 分析
根据文献[6]选取4种限制性内切酶(Hae III、Hinf I、Msp I、Rsa I),酶切反应体系均为20 μL,37 ℃酶切过夜。全部酶切产物与2 μL上样缓冲液混匀后点样,2%琼脂糖凝胶电泳。电泳图谱用凝胶成像系统拍照。
1.5 16S rDNA全序列测定分析
根据16S rDNA PCR-RFLP聚类分析结果,选取代表菌株GY-2的16S rDNA PCR扩增产物送上海生工生物工程技术服务有限公司进行测序。将所测序列在GenBank中进行比对,确定与其他根瘤菌的序列相似性,并与部分根瘤菌已知种的全序列进行比较,利用MEGA4软件,采用邻接法,构建以16S rDNA全序列为基础的系统发育树。并用DNAMAN计算代表菌株与各参比菌株16S rDNA序列相似性。
2 结果与分析
2.1 16S rDNA PCR-RFLP 酶切结果
用引物P1和P6对供试菌株的16S rDNA进行PCR扩增后,结果检测均得到一条1 500 bp左右的扩增条带,扩增产物分别用4种限制性内切酶(Hae III、Hinf I、Msp I、Rsa I)酶切后,河北农业大学保定教学基地的19个供试菌株分别得到6、7、5、5种酶切图谱类型,获得12种遗传图谱类型;石家庄高邑林场的19个供试菌株分别得到7、9、8、8种酶切图谱类型,获得14种遗传图谱类型,38个供试菌株共获得26种遗传图谱类型(表2)。从表2可看出,保定地区不同种源间刺槐根瘤菌的酶切图谱类型有的是完全一致的,例如BD-2和BD-4的酶切图谱类型属于类型2(baba),BD-3、BD-7和BD-8属于类型3(bbcb);高邑地区有的也是一致的,例如GY-3、GY-5、GY-6和GY-9属于类型15(ckhh),而地区间的根瘤菌酶切图谱类型没有完全一致的,说明地区间根瘤菌遗传多样性丰富。部分菌株酶切图谱见图1。
2.2 16S rDNA PCR-RFLP 聚类结果
将菌株的16S rDNA酶切图谱类型转化为计算机可以识别的数值“0”和“1”,通过PopGen32软件计算各菌株间的遗传距离和遗传相似性,利用DPS软件的UPGMA法进行聚类分析,得出以遗传距离为依据的菌株16S rDNA PCR-RFLP聚类分析树状图(图2)。供试菌株16S rDNA的遗传距离呈现出丰富的遗传多样性。在遗传距离为0.4上,菌株分为4大类:第1类跟已知参比菌株聚在一起;第2类BD-3、BD-7、BD-8、BD-17 聚在一起;第3 类最大,由28株根瘤菌组成;第4类跟其他3类遗传聚类较远,属于未知的系统发育分支。第3类在遗传距离为0.25处,又可以分为3个亚类,可以看出大部分同一地区的根瘤菌聚在了一起,地区间根瘤菌的遗传多样性要比不同种源间根瘤菌遗传多样性丰富。

表2 供试菌株的16S rDNA PCR-RFLP电泳图谱分析

图1 部分菌株16S rDNA PCR扩增产物酶切图谱
2.3 16S rDNA PCR-RFLP 相关分析
用SPSS17.0软件检测同一地区不同种源间刺槐根瘤菌的遗传距离与地理距离和气象因子的相关性。结果(表3)显示,保定地区的菌株遗传距离与种源间的经纬度和年均降水量都有相关性,相关系数分别为 0.171、0.243、0.226,且都达到极显著相关关系。相反,高邑地区的菌株遗传距离与种源间的经纬度、年均温和年均降水量相关性都不明显。从表3中可以看出,保定地区菌株遗传距离和高邑地区菌株遗传距离有显著负相关关系。
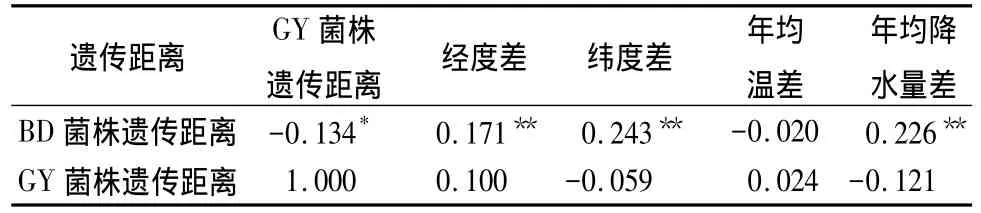
表3 菌株遗传距离与种源地理因子相关性分析
2.4 16S rDNA全序列分析
根据菌株16S rDNA的PCR-RFLP聚类分析结果,测定了代表菌株GY-2的16S rDNA全序列,全长1 424 bp,其GenBank序列登录号为CL6539,利用MEGA4软件对GY-2和参比菌株的16S rDNA基因序列进行Neighbor-joining分析,构建了反应供试菌株与参比菌株系统发育关系的发育树(图3)。在系统发育树中根瘤菌及土壤杆菌按属分成Sinorhizobium、Rhizobium、Agrobacterium、Mesorhizobium、Azorhizobium和Bradyrhizobium 6个分支。代表菌株GY-2在系统发育分类地位上属于中华根瘤菌属(Sinorhizobium),与中华根瘤菌属内各已知参比菌株16S rDNA序列相似性最小,为96.7%,均大于划分属的标准[7]。且与 S.morelense LMG20571的亲缘关系最近,序列相似性达到99.6%。
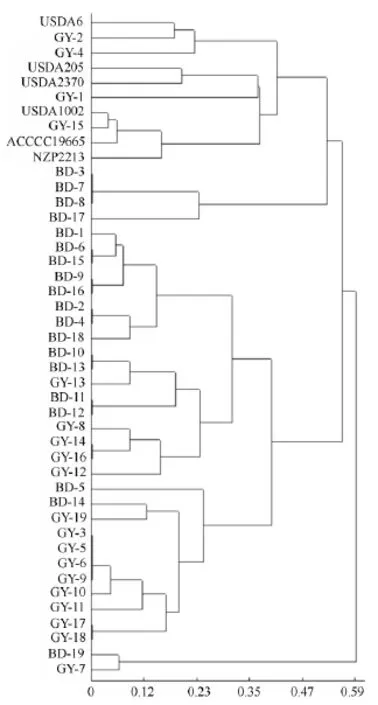
图2 16S rDNA PCR-RFLP聚类分析树状图
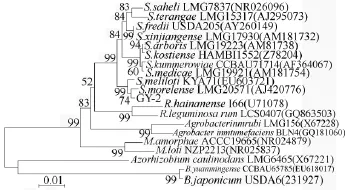
图3 16S rDNA全序列系统发育树
3 结论与讨论
采用16S rDNA PCR-RFLP分析方法对不同地理环境下不同刺槐种源根瘤菌进行了研究,为揭示刺槐根瘤菌的遗传多样性以确定其分类地位奠定了基础,同时也印证了16S rDNA PCR-RFLP是对大量根瘤菌菌株进行初步分类的有效方法。1992年,Batzli等[8]对分离自刺槐的根瘤菌进行了生理生化测定,在60%的相似性水平上分成4个群,笼统的归属于Rhizobium。Andreas Ulrich等[9]对生长在德国的刺槐根瘤菌进行表型和16S rDNA分析后,认为76%的菌株在16S rDNA基因型上归属于Mesorhizobium,24%的菌株归属于 Rhizobium。韦革宏等[10]对杨凌地区刺槐根瘤菌进行表型多样性分析后,发现菌株多样性丰富,有些菌株属于 Mesorhizobium。本试验对38株分离自不同种源刺槐的根瘤菌进行了16S rDNA PCR-RFLP分析,共获得26种遗传图谱类型;UPGMA法聚类分析显示,菌株在60%相似水平上,分为4大类,各分支内菌株间相似性各不相同;而且大部分菌株按地点聚开,地点间菌株遗传差异大于种源间菌株遗传差异。其中代表菌株GY-2属于中华根瘤菌属(Sinorhizobium),与S.morelense LMG20571的亲缘关系最近,序列相似性达到99.6%。以上结果表明,刺槐根瘤菌存在丰富的遗传多样性,且受地理环境影响较大。
遗传关系聚类图还显示,本试验结果并没有以刺槐种源地理分布聚类的倾向,只有第3类第2亚类只包括河北和天津种源的菌株,与寄主种源地有直接关系,而其他分类种源较混杂,表明根瘤菌遗传差异跟寄主种源的地理分布没有明显相关关系,菌株多样性受寄主种源地影响较小。
表3相关分析的结果表明,保定地区菌株跟种源地的地理因子呈正相关关系,且有极显著差异;而高邑地区菌株跟种源地的地理因子则不相关,2个地区间菌株遗传距离有显著的负相关关系。表明了根瘤菌与寄主植物及地理环境三者之间的复杂关系。
宿主植物和地理环境是影响根瘤菌分布和多态性的2个重要因素,生活在特定的生态环境中的菌株具有特定的表型和遗传学特性。例如新疆中华根瘤菌(Sinorhizobium xinjiangense)[11]和辽宁慢生根瘤菌 (Bradyrhizobium liaoningense)[12]。 本 研 究 中,RFLP分析显示菌株的地理来源影响其多样性,呈现出明显的地理特性。菌株多样性受不同种源刺槐影响较小。这也证实了环境条件对根瘤菌多样性的影响大于寄主专一性的影响。地理环境对根瘤菌影响主要来自土壤的理化性质和温度,其中最重要的因素是pH值。土壤pH值对根瘤菌的影响早在2001年就有过报道[13]。保定和高邑的土壤类型不一样,pH值也不同,土壤含水量不同,使得它们的根瘤菌菌群也呈现出显著差异。
王卫卫等[14]在研究西北干旱地区豆科植物根瘤菌时发现,豆科植物在水分充足地带如河滩、田埂、树林等处容易结瘤且长势较好,而荒滩、沙地等缺水处结瘤较少而且形状小。在采集根瘤时发现保定壤土上的刺槐根瘤比高邑黏土上的刺槐根瘤长势好。壤土相对于黏土土壤质地较疏松,透气性好,保水性差,这跟王卫卫等[14]的报道相反。分析原因为刺槐适宜在土壤疏松的壤土、沙土上生长,在黏土上生长不良,寄主的生长环境影响与其共生的根瘤菌的生长环境。刺槐与根瘤菌相互依赖、相互促进生长,体现了寄主与共生体系的复杂性。
[1]缪礼鸿,周俊初.根瘤菌竞争结瘤的研究进展[J].华中农业大学学报,2003,22(1):84-89.
[2]Murray U,David H,Mark P,et al.Measuring plant-associated nitrogen fixation in agricultural systerms[M].Canberra:Australian Centre for International Agricultural Research,2008:11-20.
[3]张美玲,朱博,李旭,等.不同地理环境下野豌豆根瘤菌的遗传多样性与共生进化研究[J].西北农林科技大学学报:自然科学版,2008,36(12):192-198.
[4]Vincent J M.A Manual for the practical study of root-nodule bacteria[M].Oxford:Blackwell Scientific Publications,1970.
[5]郑维,权春善,朴永哲,等.一种快速提取细菌总DNA的方法研究[J].中国生物工程杂志,2006,26(4):75-80.
[6]Gisèle L,Marie-Reine A,Françoise R,et al.Rapid identification of rhizobia by restriction fragment length polymorphism analysis of PCR amplified 16S rRNA genes[J].Appl Environ Microbiol,1994,60(1):56-63.
[7]谭志远,陈文新.根瘤菌新类群代表菌株的16S rDNA全序列测定及其系统发育地位[J].微生物学报,1997,37(6):411-416.
[8]McCray B J,Graves W R,van Berkum P.Diversity among rhizobia effective with Robinia pseudoacacia L.[J].Appl Environ Microbiol,1992,58(7):2137-2143.
[9]Andreas U,Irmtraut Z.Phylogenetic diversity of rhizobial strains nodulating Robinia pseudoacacia L.[J].Microbiology,2000,146:2997-3005.
[10]韦革宏,陈春,龚明福,等.刺槐根瘤菌的表型多样性研究[J].西北植物学报,2003,23(12):2094-2098.
[11]Peng Guixiang,Tan Zhiyuan,Wang Entao,et al.Identification of isolates from soybean nodules in Xinjiang Region as Sinorhizobium xinjiangense and genetic differentiation of S.xinjiangense from Sinorhizobium fredii[J].Int J Syst Evol Microbiol,2002,52(2):457-462.
[12]Xu L M,Ge C,Cui Z,et al.Bradyrhizobium liaoningense sp.nov.,isolated from the root nodules of soybeans[J].Int J Syst Bacteriol,1995,45(4):706-711.
[13]Yang S S,Bellogín R A,Buendía A,et al.Effect of pH and soybean cultivars on the quantitative analyses of soybean rhizobia populations[J].J Biotechnol,2001,91(2/3):243-255.
[14]王卫卫,胡正海.几种生态因素对西北干旱地区豆科植物结瘤固氮的影响[J].西北植物学报,2003,23(7):1163-1168.

