大葱伴生栽培对黄瓜根际土壤微生物的影响
夏秀波,王全华,曹守军,姚建刚,周扬
(山东烟台市农业科学研究院,265500)
目前,在国外蔬菜间作套作和伴生栽培已有大量研究[1~6]。在同一块土地上,这种栽培模式保持了生物的相对多样性,达到了防病虫、驱虫、诱虫和增产的目的,保持了生态的相对稳定性,有利于促进蔬菜的可持续生产。大葱伴生栽培能够有效防控辣椒、黄瓜和番茄的根结线虫病,降低其为害,在番茄和黄瓜上,其对根结线虫病防治效果能达到80%以上;而在辣椒上,防治效果则能达到90%以上。同时大葱伴生栽培还能减少辣椒根部的根腐病和白绢病,黄瓜和番茄枯萎病的发生[7,8]。在前期防病试验的基础上,研究了大葱伴生栽培对黄瓜根际土壤微生物的影响,以期为伴生栽培提供科学的理论依据。
1 材料与方法
1.1 试验材料
供试材料为嫁接黄瓜 (Cucumis sativusL.),接穗品种为翠绿黄瓜(青岛市农科院选育),砧木为白籽南瓜。大葱(AlliumcepaL.)品种为章丘大葱。
试验于2010年10月至2011年4月在山东省烟台市农业科学研究院玻璃温室内进行。该温室内连续20 a种植蔬菜作物,病害严重,已经出现了严重的连作障碍。土壤养分含量:碱解氮405.8 mg/kg,速效磷292.2 mg/kg,速效钾417.6 mg/kg,有机质20.80 g/kg,pH 值 4.90,按鲍士旦[9]的方法测定。
1.2 试验设计
试验设2个处理 (C+CO表示大葱伴生栽培黄瓜,CK表示只栽培黄瓜),3个重复,黄瓜株距30 cm,行距60 cm。处理为在黄瓜植株两侧5 cm处各栽1株大葱,以不种植大葱的为对照。于2010年11月30日定植,分别为2010年11月30日和2011年2月22日取样,在黄瓜植株周边5~10 cm位置取土。
1.3 土壤微生物分析
采用土壤浸提法培养细菌,稀释平板计数法计数;采用马丁孟加拉红-链霉素选择性培养基培养真菌,稀释平板计数法计数;采用高氏1号培养基培养放线菌,稀释平板计数法计数;采用PCNB培养基培养镰刀菌,稀释平板计数法计数[10,11]。每个处理4次重复,取平均值。
1.4 数据分析
数据分析采用Excel 2003和DPS 7.05。
2 结果与分析
2.1 大葱伴生栽培对黄瓜土壤中真菌的影响
由表1可知,大葱和黄瓜定植后,大葱伴生栽培处理和对照的土壤中真菌数量分别为115.67×105个/g和93.33×105个/g,并且对照真菌数量明显低于处理,但是差异不显著。由表2可知,黄瓜进入结果期时,在土壤真菌种类上,与对照相比大葱伴生栽培处理的真菌种类没有明显变化,只是在重复中部分真菌类数量为0,如交链孢、小卵孢菌、黄曲霉和木霉等;在土壤真菌数量上,对照土壤真菌总数量为230×105个/g,而大葱伴生处理的数量为103×105个/g,比对照低74.11%,差异极显著。可见,大葱伴生栽培处理对黄瓜根际土壤真菌有抑制作用。
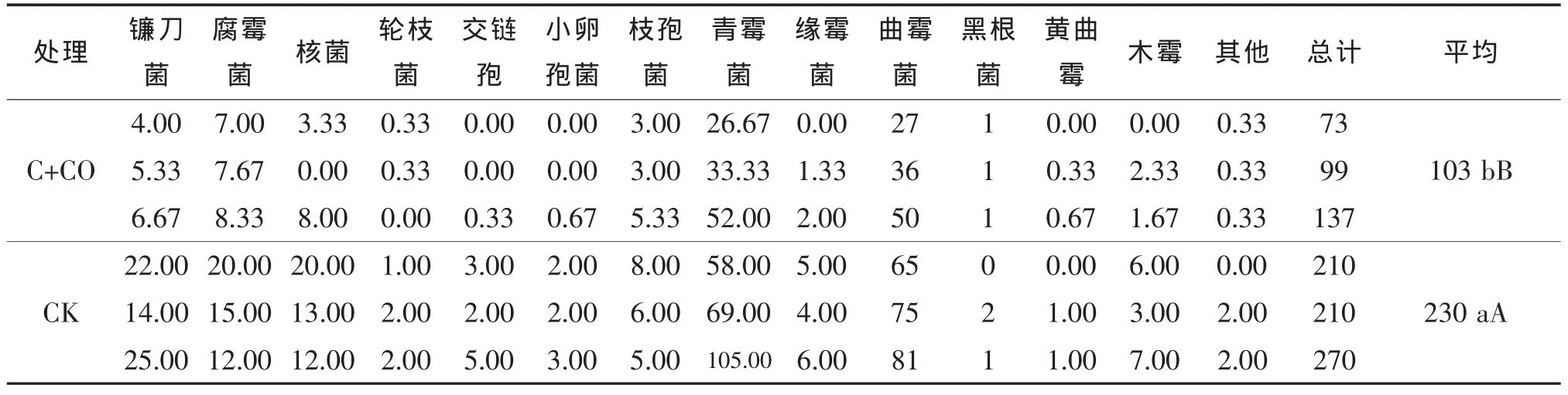
表2 结瓜期黄瓜根际土壤真菌种类、数量 ×105个/g
2.2 大葱伴生栽培对土壤中放线菌的影响
由表3可知,大葱和黄瓜定植后,大葱伴生栽培处理和对照的土壤中放线菌数量分别为192.33×104个/g和52.00×104个/g,对照放线菌数量低于大葱伴生栽培处理,但差异不显著;并且对照土壤放线菌种类少于大葱伴生栽培处理。
由表4可知,黄瓜进入结果盛期时,大葱伴生栽培处理放线菌种类与对照的基本相同;在土壤放线菌数量上,对照土壤放线菌总量为602.33×104个/g,而大葱伴生栽培处理的为155.89×104个/g,比对照低74.12%,差异极显著。可见,大葱伴生栽培处理对黄瓜根际土壤放线菌有抑制作用。
2.3 大葱伴生栽培对土壤中细菌的影响
由表5可知,大葱和黄瓜定植后,大葱伴生栽培处理和对照的土壤中细菌数量分别为1 161.33×103个/g和 878.33×103个/g,差异显著,且对照处理含量明显低于处理。由表6可知,黄瓜进入结果盛期时,大葱伴生栽培处理与对照相比,其植株根际土壤细菌数量显著减少,对照土壤细菌数量为1 472.67×103个/g,而大葱伴生栽培的数量为506.89×103个/g,比对照低 65.58%,差异极显著。 可见,大葱伴生栽培处理对土壤细菌也有抑制作用。
3 结论与讨论
土壤病原菌增加、微生物生态平衡失调是制约设施蔬菜可持续生产的主要障碍之一。国外学者研究表明,科学合理的伴生栽培(Companion)是降低土壤病虫害的有效手段之一。在伴生栽培过程中,作物根系分泌物可以抑制土壤病原菌增殖,恢复原有微生物群落结构多样性,同时有益的伴生作物通过根系分泌物和残体腐解物等途径释放化感物质,产生有益的化感作用,促进主茬作物生长[12~14]。本试验采用大葱伴生栽培黄瓜的模式研究了大葱根系分泌物对黄瓜植株根际土壤微生物的影响。结果表明,大葱伴生栽培处理能有效抑制土壤中的真菌、放线菌和细菌数量的增加,包括各种土传病原菌,如镰刀菌和腐霉菌等,从而降低猝倒病、立枯病和枯萎病等土传病害发生率。大葱伴生栽培处理能有效抑制土壤中真菌、放线菌和细菌的繁殖,据推测可能是由于大葱根系的某种分泌物对这些土壤微生物产生了抑制作用。
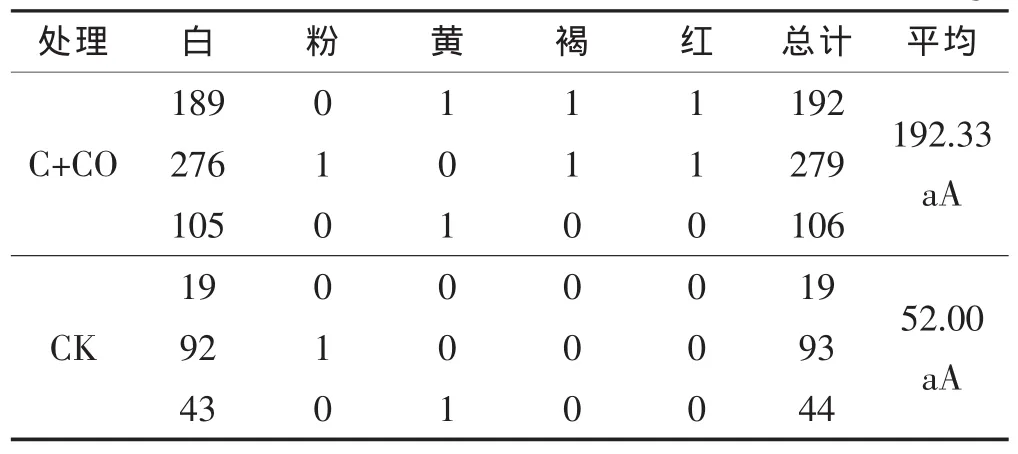
表3 定植后黄瓜根际土壤皿内放线菌种类、数量 ×104个/g
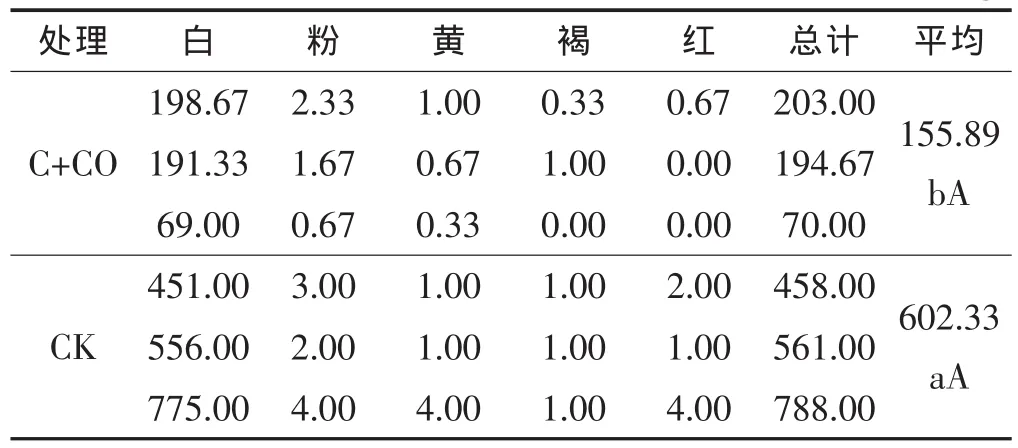
表4 结瓜期黄瓜根际土壤皿内放线菌种类、数量 ×104个/g
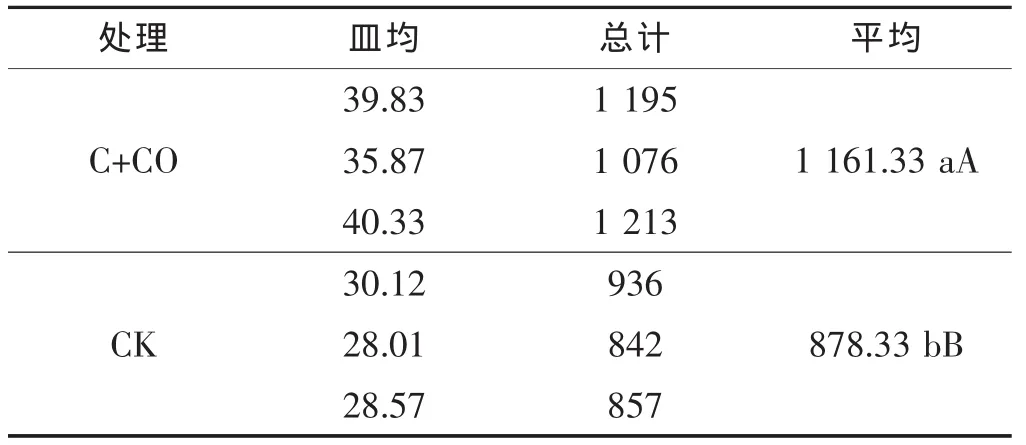
表5 定植后黄瓜根际土壤皿内细菌数量 ×103个/g
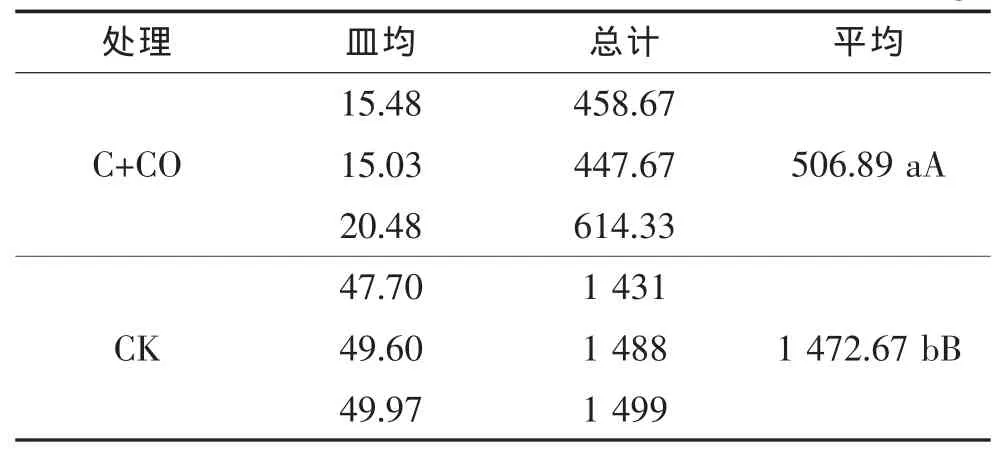
表6 结瓜期黄瓜根际土壤皿内细菌数量 ×103个/g
[1]Johnson M W,Mau R F L.Effects of intercropping beans and onions on populations ofLiriomyzaspp.and associated parasitic hymenoptera[J].Hawaiian Entomological Society,1986,27(15):95-103.
[2]Agu C M.Effects of Intercropping on root-gall nematode disease of soybean (Glycine max (L)Merrill)[J].Plant Sciences Research,2008,1(1):20-23.
[3]Inal A,Gunes A,Zhang F,et al.Peanut/maize intercropping induced changes in rhizosphere and nutrient concentrations in shoots[J].Plant Physiology and Biochemistry,2007,45(5):350-356.
[4]Sujatha S,Bhat R,Kannan C,et al.Impact of intercropping of medicinal and aromatic plants with organic farming approach on resource use efficiency in areca nut(Areca catechuL.)plantation in India[J].Industrial Crops and Products,2011,33:78-83.
[5]Zhang F,LiL.Using competitive and facilitative interactions in intercropping systems enhances crop productivity and nutrient-use efficiency[J].Plant and Soil,2003,248:305-312.
[6]Zhou X,Yu G,Wu F.Effects of intercropping cucumber with onion or garlic on soil enzyme activities,microbial communities and cucumber yield[J].2011,47:279-287.
[7]王全华,曹守军,李素梅,等.一种防治蔬菜根结线虫病的新技术[J].中国蔬菜,2009(17):23-24.
[8]李涛,王全华,李素梅.葱对辣椒根结线虫病的防治效果[J].山东农业科学,2008(7):61-63.
[9]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2005.
[10]李阜棣,喻子牛,何绍江.农业微生物学实验技术[M].北京:中国农业出版社,1996:305-306.
[11]中国科学院南京土壤研究所微生物研究室.土壤微生物研究法[M].北京:科学技术出版社,1985:353.
[12]Nishio M,Kusano S.Fungi associated with roots of continuously cropped upland rice[J].Soil Science and Plant Nutrition,1993,19:205-217.
[13]Willamson G B.Bioassays for allelopathy:measuring treatment responseswith independent controls [J].J Chem Ecol,1988,14(1):181-187.
[14]Yu J Q,Matsui Y.Effects of root exudates of cucumber(Cucumis sativus)and allelochemicals on ion uptake by cucumber seedlings[J].Chem Exp ress,1997,23:817-827.

