微量样品中喜树碱含量的高效液相色谱测定1)
王 轶 吴 莹 王 洋 阎秀峰
(东北林业大学盐碱地生物资源环境研究中心/东北油田盐碱植被恢复与重建教育部重点实验室(东北林业大学),哈尔滨,150040)
喜树(Camptotheca acuminataDecne)是我国特有的多年生亚热带落叶阔叶树种,属于珙桐科(Nyssaceae)喜树属,主要分布于长江流域及西南各省,因其次生代谢产物喜树碱具有良好的抗肿瘤活性而受到人们的广泛关注[1]。
一些丛枝菌根真菌能够侵染喜树的细根并与之共生形成丛枝菌根,有研究表明:喜树幼苗中喜树碱含量的变化与菌根真菌侵染及菌根形成过程具有相关性[2]。为了深入探讨喜树碱与共生关系及过程的相关机理,需要对喜树幼苗不同级别细根中的喜树碱进行精细分析,测定微小根段中的喜树碱含量。然而,目前常用的基于紫外检测器的高效液相色谱方法测定喜树碱含量[3-5],实验操作中样品质量通常为1~2 g喜树干样,所需样品量大且灵敏度不高,无法满足上述研究工作需求。
借助于喜树碱具有自发荧光的特性,作者建立了基于荧光检测器的喜树碱含量高效液相色谱测定方法,样品量可以降低至2 mg(干质量),可以满足微量植物材料中喜树碱含量的精确测定。
1 材料与方法
仪器:高效液相色谱系统,包括515型单泵、717型自动进样器、2475型荧光检测器(美国Waters公司);Sorvall Legend Micro17型离心机(美国Thermo公司);H—H—2数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司);Sartorius BT25S电子分析天平(精度0.01 mg);Bransonic—321超声波清洗机。
实验材料:选取成熟饱满的喜树种子(来源于四川省金堂县),用0.5%的 KMnO4浸泡消毒0.5 h,无菌水洗净后,播入经过121℃灭菌2 h的细沙中催芽。待有侧根生成后栽植于已灭菌的花盆中,每盆1株,盆中基质为土壤与河沙混合物(体积比3∶1,过2 mm筛,混合后121℃灭菌2 h)。移苗后于自动控制温室中培养,温室为自然采光,昼夜温度自然过渡(18~28℃)。40 d后对喜树幼苗根、茎、叶、子叶及全株分别采样,样品烘干后用于喜树碱含量测定。
试剂与药品:喜树碱对照品(批号:080510)由哈尔滨峰源高科技开发有限公司提供,经HPLC测定纯度大于99%。乙腈为色谱纯(Fisher公司),娃哈哈纯净水(杭州娃哈哈集团有限公司)。其他试剂均为分析纯。
对照品储备液的制备:精密称取喜树碱标准品1 mg置于50 mL容量瓶中,加乙腈超声使其溶解,待冷却后再用乙腈稀释至刻度,摇匀,制成对照品储备液(20 mg·L-1)。将对照品储备液分装后,于冰箱中-80℃保存备用。
样品溶液的制备:取干燥至恒质量的喜数幼苗叶片材料于研钵中研磨成粉末,精密称取2 mg喜树叶粉置于5 mL容量瓶中,加入4 mL 61%乙醇,50℃下超声提取10 min后取出,冷却至室温后定容。摇匀后经微孔滤膜(0.45 μm)过滤,取滤液作为样品溶液。
2 结果与分析
波长选择与HPLC色谱条件确定:以质量浓度为1 mg·L-1的喜树碱标准品溶液,摸索喜树碱荧光检测的最佳激发波长和发射波长。首先,以喜树碱的最大紫外吸收波长作为激发波长,扫描喜树碱荧光的发射波长;然后,以所得的最大发射波长,进一步扫描激发波长;如此反复,最终确定最佳荧光检测条件。结果显示:针对喜树碱的最佳激发波长为380 nm,发射波长为553 nm。
经试验,确定HPLC色谱条件为:Luna C18(250 mm×4.6 mm,5 μm)色谱柱;以乙腈 ∶水(体积比4 ∶6)为流动相进行等度洗脱;流速 1.0 mL·min-1;荧光检测激发波长380 nm,发射波长553 nm;进样量20 μL。对照品和样品色谱图见图1。
线性关系考察:取对照品储备液(20 mg·L-1)准确稀释成为20、40、80、160、200、320、400、800 μg·L-1的标准对照品溶液,按照本文确定的色谱条件进样分析。以对照品质量浓度(X)为横坐标、峰面积(Y)为纵坐标绘制标准曲线,得线性回归方程为Y=5 968.6X+2 447.9,r=0.999 6,喜树碱溶液质量浓度在20~800 μg·L-1范围内,与峰面积的线性关系良好。
精密度试验:取喜树叶片材料,按本文的方法制备样品溶液。吸取同一份样品溶液,按本文确定的色谱条件连续进样6次,峰面积的相对标准偏差为1.5%,精密度良好。
稳定性试验:取喜树叶片材料,按本文的方法制备样品溶液,于室温下分别放置 0、2、4、8、12、24 h后进样分析,峰面积的相对标准偏差为3.8%。表明:样品溶液在24 h内,测定结果基本保持稳定。
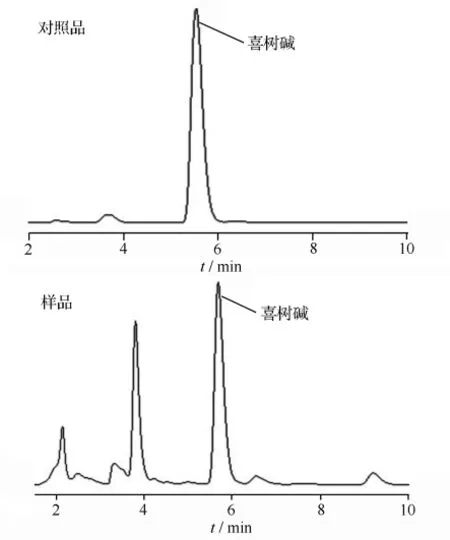
图1 喜树碱标准品及喜树幼苗样品HPLC色谱图
重复性试验:取喜树叶片材料研磨、混匀后,精密称取6份;按本文的方法制备样品溶液;按本文确定的色谱条件进样分析。计算得:喜树碱的平均质量分数为 0.911 mg·g-1,相对标准偏差为 2.4%。重复性良好。
加样回收率试验:精密称取6份已知喜树碱质量分数(0.911 mg·g-1)的喜树叶片粉末各 1 mg,分别加入喜树碱对照品储备液(20 mg·L-1)45.6 μL(加入量0.912 μg),按本文的方法制备样品后,按照本文确定的色谱条件进样分析。喜树碱的平均回收率为98.41%,相对标准偏差为1.88%(见表1)。
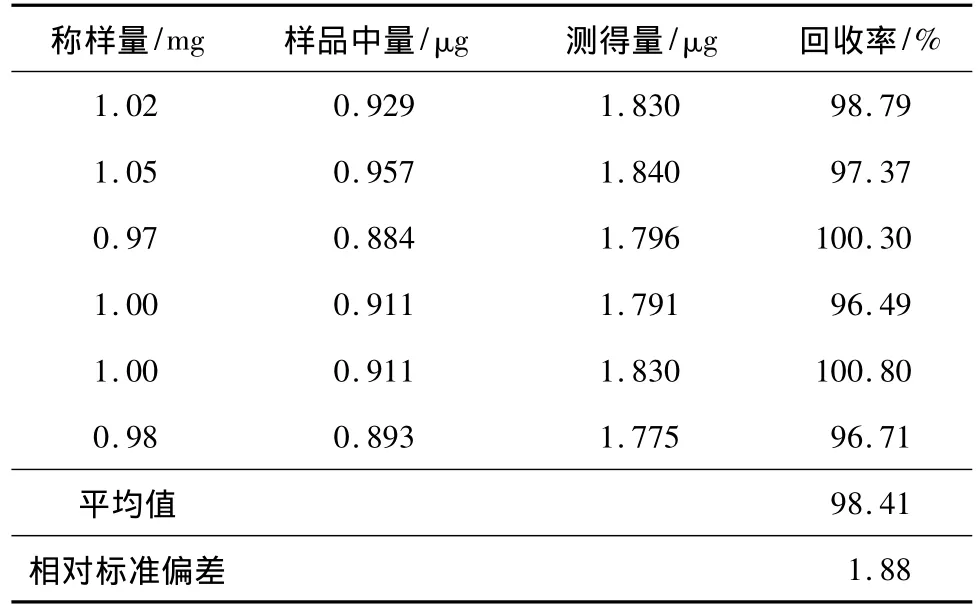
表1 喜树叶片中喜树碱的加样回收率
样品测定:准确量取喜树幼苗根、茎、叶、子叶和全株的样品各3份,按本文的方法制备样品,按照本文确定的色谱条件进样分析,计算喜树碱质量分数(见表2)。无论是喜树碱质量分数较高的叶片样品,还是质量分数低一些的根样品,测定结果的相对标准偏差均较小。
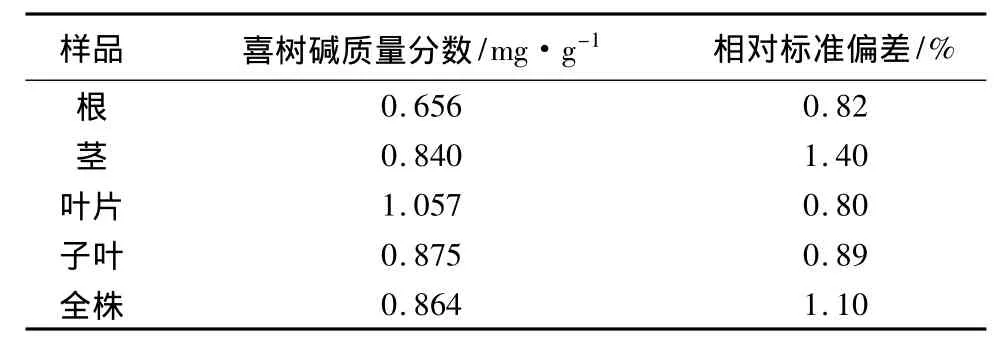
表2 喜树幼苗中喜树碱含量(n=3)
3 结论与讨论
本实验建立了一种基于HPLC—荧光检测的微量喜树植物材料中喜树碱含量的测定方法,只需2 mg(干质量)喜树材料即可实现对喜树碱含量的提取和测定,相对于现有基于HPLC—紫外检测的喜树碱含量测定方法大大减小了测定样品需要量。
相对于紫外检测器而言,荧光检测具有更高的灵敏度,因此适用于微量物质的检测。HPLC—荧光检测器测定喜树碱含量的方法,已用于动物血浆中各种喜树碱衍生物的含量测定[6-8];但对于以喜树植物材料为样品的喜树碱含量测定,目前还没有文献报道。在对丛枝菌根真菌与喜树幼苗共生关系的研究中,需要对喜树幼苗不同级别细根中的喜树碱进行精细分析,测定微小根段中的喜树碱含量,采用HPLC—荧光检测法代替传统的紫外检测法成为解决问题的关键。以2 mg干质量的植物样品用于喜树碱的提取和含量测定,可以满足对一株喜树幼苗不同根段、不同组织部位的微量样品进行喜树碱含量测定的需求。这对今后进一步研究丛枝菌根对喜树幼苗生长发育情况的影响以及喜树中喜树碱的合成及代谢机制提供了更精准可靠的方法。
[1]Wall M E,Wani M C,Cook C E,et al.Plant antitumor agentsⅠ:The isolation and structure of camptothecin a novel alkaloidal leukemia and tumor inhibitor fromCamptotheca acuminate[J].Journal of the American Chemical Society,1966,88:3888-3890.
[2]赵昕,阎秀峰.丛枝菌根对喜树幼苗生长和氮、磷吸收的影响[J].植物生态学报,2006,30(6):947-953.
[3]张丽艳,杨玉琴.反相高效液相色谱法测定喜树果实中喜树碱的含量[J].中国中药杂志,1997,22(4):234-235.
[4]王洋,于涛,张玉红,等.碱法提取喜树碱工艺的研究[J].植物研究,2000,20(4):433-437.
[5]阎秀峰,王洋,于涛,等.喜树叶中喜树碱含量的高效液相色谱分析[J].分析测试学报,2002,21(2):15-17.
[6]吴胜林,王翠兰,熊英,等.高效液相色谱法测定血浆中羟基喜树碱的浓度[J].中国医院药学杂志,2008,28(24):2149-2150.
[7]阎昭,朱仲玲,薛津怀,等.高效液相色谱荧光检测法测定人血浆中9-氨基喜树碱的浓度[J].药物分析杂志,2010,30(8):1416-1419.
[8]郭宏红,郑健,井立佳,等.RP—HPLC法测定小鼠血浆中10-羟基喜树碱的浓度[J].中国药房,2011,22(1):13-15.

