碱土掺杂硅酸镧电解质材料的制备与性能
黄志良,鲁 冕,石 月,詹 刚,陈巧巧,吴 博,陈亚男,池汝安
(1.武汉工程大学材料科学与工程学院,湖北 武汉 430074; 2.武汉工程大学化工与制药学院,湖北 武汉 430074)
0 引 言
作为一种新型固体电解质材料,磷灰石型La9.33(SiO4)6O2(简称LSO)因其良好的中低温电导性能和稳定性受到了广泛的关注.为了使其更好地应用到固体氧化物燃料电池中,通过掺杂影响结构从而提高其电导率,成为目前研究的重点.
LSO具有典型的p63/m磷灰石型晶体结构,O2-与Si4+构成的硅氧四面体[SiO4]孤立地分布在晶格中,彼此之间没有共同的氧离子,只能通过La3+相连[1].稀土金属La具有两种不同的配位数,分别是具有9和7配位数的LaⅠ和LaⅡ.[SiO4]四面体与LaⅡ共同形成平行于C轴的六边形离子传输通道,额外的2a位的自由氧O2-处于六边形通道中,决定了LSO具有较高的中低温氧离子传导性能[2-3].而间隙氧离子位于LaⅡ六边形通道的外侧,具有比通道氧离子更高的迁移活性,也可提高LSO的离子电导率[4-6].
目前,掺杂研究主要集中在提高LSO阳离子空位和间隙氧的数量上.一系列研究指出,较阳离子空位而言,间隙氧对改善电解质的电导率更有效.所以,间隙氧数量的提高是可行性较高的掺杂思路.就掺杂位置而言,主要是La位和Si位的部分阳离子的单位掺杂,其中La位取代以碱土金属和稀土金属为主[7].
现今有关磷灰石型LSO的合成工艺还不成熟,主要有高温固相法和溶胶-凝胶法,但各自的缺点限制了其进一步的发展[8].本文采用的尿素-硝酸盐燃烧法,不仅工艺简单,反应速度快,而且产物粒度细,纯度高,为LSO的碱土元素(Sr、Ca、Mg)掺杂研究提供了很好的前提条件.本文还通过对产物的结构、形貌及电导率进行表征,进一步研究了掺杂对其电导性能的影响,最后对电导机理进行了初步探讨.
1 实验部分
1.1 实验试剂与仪器
实验所用的试剂如表1所示.
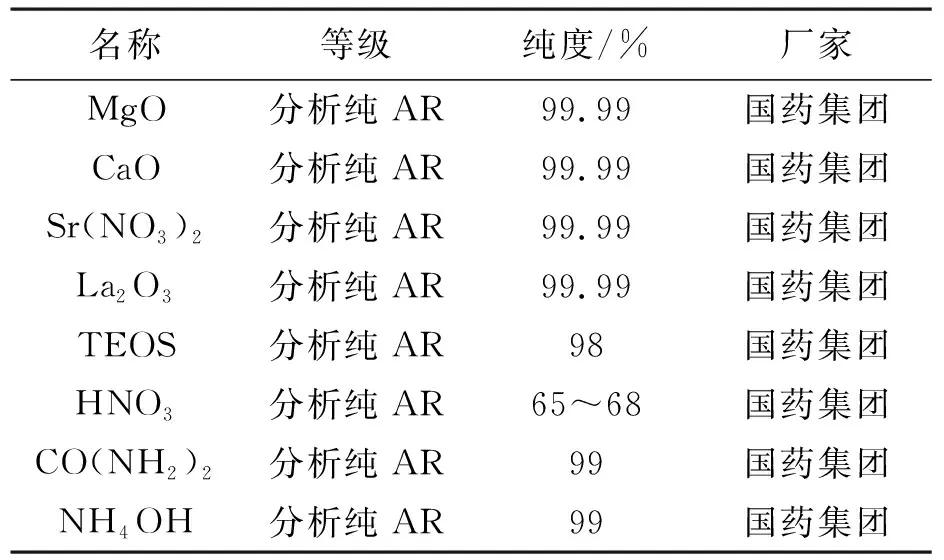
表1 原料Table 1 Raw materials
实验所需仪器:分析天平,CPA1245(精度0.1 mg),德国赛多利斯股份有限公司;智能控温磁力搅拌器,SZCL-4;智能恒温水浴锅,HH-S;真空干燥箱,DZF-1B,上海跃进医疗器械厂;高温箱式电阻炉,SX2-5-12(精度±1 ℃);粉末压片机,769YP-24B,天津市科器高新技术公司;游标卡尺;快速升温高温管式炉,SJG-16;智能箱式电炉;电化学工作站,CHI650C,上海辰华仪器有限公司.
1.2 实验方法
燃烧法,即以正硅酸乙酯(TEOS)、硝酸镧为基质;以浓硝酸、乙醇和水为溶剂;首先生成溶胶-凝胶前驱体;再以尿素为燃烧引发剂在较低温度(600~800 ℃)下燃烧合成LSO固体电解质的方法[9].Nakayama和J.E.H.Sansom等人的研究证明[4,10],当x的取值在0~0.34时,制得的电解质在中低温下具有最高的氧离子电导率,且不含杂质相.因此,实验确定La9.33Mx(SiO4)6O2+δ的掺杂量分别为x=0.1,0.2,0.3,0.4.
1.2.1 LSO粉体的燃烧合成
a. 依次称取La2O3和适量掺杂物融于硝酸和无水乙醇的混合溶液中,35 ℃加热搅拌;待溶液澄清后用氨水调节pH值至5~6;再按照化学计量比(La∶Si=9.33∶6)加入尿素和TEOS;从而得到前躯体溶液.
b. 前驱体溶液经80 ℃水浴加热2 h后形成前驱体凝胶;凝胶放入600 ℃的电炉中点燃,尿素-硝酸盐燃烧反应约5 min,产物为纯白色海绵状的泡沫;为了提高结晶度,研磨产物,并在800 ℃下煅烧12 h,最后得到粉体产物.
1.2.2 成型与烧结 分别称取0.8 g粉体,在50 MPa压力下先进行预压,然后再在225 MPa的压力下进行二次压片,得到素坯直径为13.1 mm.最后在1 400 ℃下烧结所得素坯,升温速率6 ℃/min,保温3 h,随炉冷却后取出.
1.3 测试与表征
通过日本理学电机D/MAX PC2200自动X射线衍射仪对不同碱土金属掺杂的LSO电解质的物相与晶体结构进行了分析表征.其中,Cu靶(Kα1,λ=0.154 06 nm),扫描速度为4(°)/min.
采用日本JEOL JSM 5510LV扫描电子显微镜(SEM)观察了碱土掺杂LSO的微观形貌.
实验还采用上海辰华电化学工作站(CHI650C)对产物进行了交流阻抗测试(400~800 ℃),并用ZSimpWin 3.10阻抗分析软件拟合图像,计算出了相应的电导率.
2 结果与讨论
2.1 XRD分析
掺杂量x=0.1的La9.33Mx(SiO4)6O2+δ(Sr, Ca, Mg)电解质粉体在800 ℃煅烧12 h后的XRD衍射图谱如图1所示.从图中可以看到,制得的3种碱土金属掺杂的电解质粉体的XRD衍射图谱形状基本相同,衍射峰较为尖锐清晰,说明粉体结晶度较高.另外,与H. Zhang等人[11]的研究结果类似,通过与PDF卡上LSO的标准衍射峰对比,可以看出800 ℃煅烧后所得样品是典型的p63/m磷灰石型结构,没有发现La2SiO5和La2Si2O7等杂质相,这也表明掺杂元素进入晶格后并没有影响LSO的晶体结构.
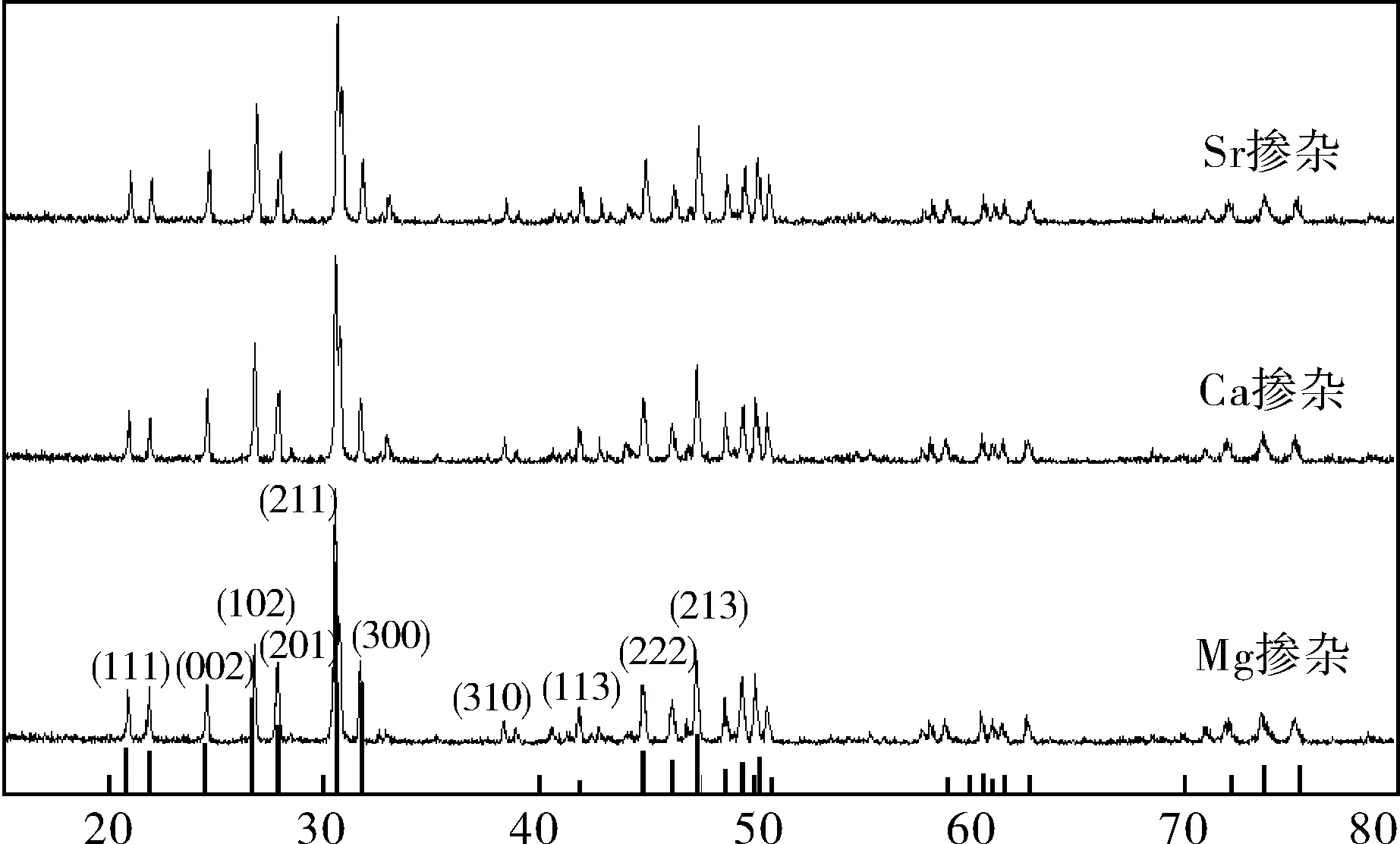
图1 La9.33Mx(SiO4)6O2+δ(M为Sr, Ca, Mg)电解质粉体的XRD图谱(x=0.1)Fig.1 XRD of La9.33Mx(SiO4)6O2+δ powders doping Sr, Ca and Mg (x=0.1)
2.2 烧结体SEM分析
1 400 ℃烧结体La9.33Srx(SiO4)6O2+δ(x=0.1,0.4)的SEM图如图2所示.从图中可以看到,烧结体颗粒晶界明显,但有明显孔隙,这可能是由于实验前期粉体的预处理(球磨1 h)不够好,还可能与烧结的温度和时间有关.通过不同掺杂量的对比发现,Sr的掺杂对LSO烧结体微观形貌产生了细微的影响,随着Sr掺杂量x的增大,电解质的致密化程度逐渐提高,而孔隙率变小.
另外,还可以看到,烧结体中存在一些尺寸很大的晶粒.可能是在烧结过程中,过大的成型压力使得坯体中的某些颗粒受到挤压,接触面积增大,烧结被加速.而在烧结的后期,这部分颗粒受力不均匀,发生了二次再结晶,从而形成了尺寸异常增大的颗粒.
图3为La9.33Cax(SiO4)6O2+δ在1 400 ℃烧结3 h后的SEM图.图3a是烧结体的表面图,可以看到明显的磷灰石型六边形结构,而图3b是烧结体的断面SEM图,可以看到烧结体内部有较多近四边形和六边形的孔道,这些通道直径约1.0~2.0 μm,孔洞分布比较均匀,这也是由LSO的磷灰石型结构所决定的.这与D. B. Leeh等人[12]测得的磷灰石型硅酸镧微观形貌分析结果类似.




图2 La9.33Srx(SiO4)6O2+δ烧结体的SEM图(1 400 ℃)Fig.2 SEM of La9.33Srx(SiO4)6O2+δ sintered body:x=0.1, x=0.4 (1 400 ℃)
图4是1 400 ℃下La9.33Mgx(SiO4)6O2+δ烧结体的SEM图.图4a中,晶体颗粒排列紧密,分布均匀,但是颗粒比较圆滑,可能是烧结初期升温相对过快,导致颗粒重排键合时线性收缩较大,因而难以看到明显的六方晶界.从图4b可以看到,晶体表面有小颗粒,坯体表面也不平整,原因可能是成型压力过大,颗粒排列紧密,某些颗粒发生了脆性断裂.


图3 La9.33Cax(SiO4)6O2+δ 1 400 ℃烧结3 h的SEM图Fig.3 SEM of La9.33Cax(SiO4)6O2+δ sintered at 1 400 ℃ for 3h


图4 La9.33Mgx(SiO4)6O2+δ烧结体的SEM图(1 400 ℃)Fig.4 SEM of La9.33Mgx (SiO4)6O2+δ sintered body(1 400 ℃)
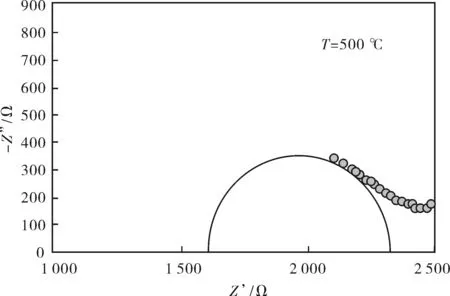

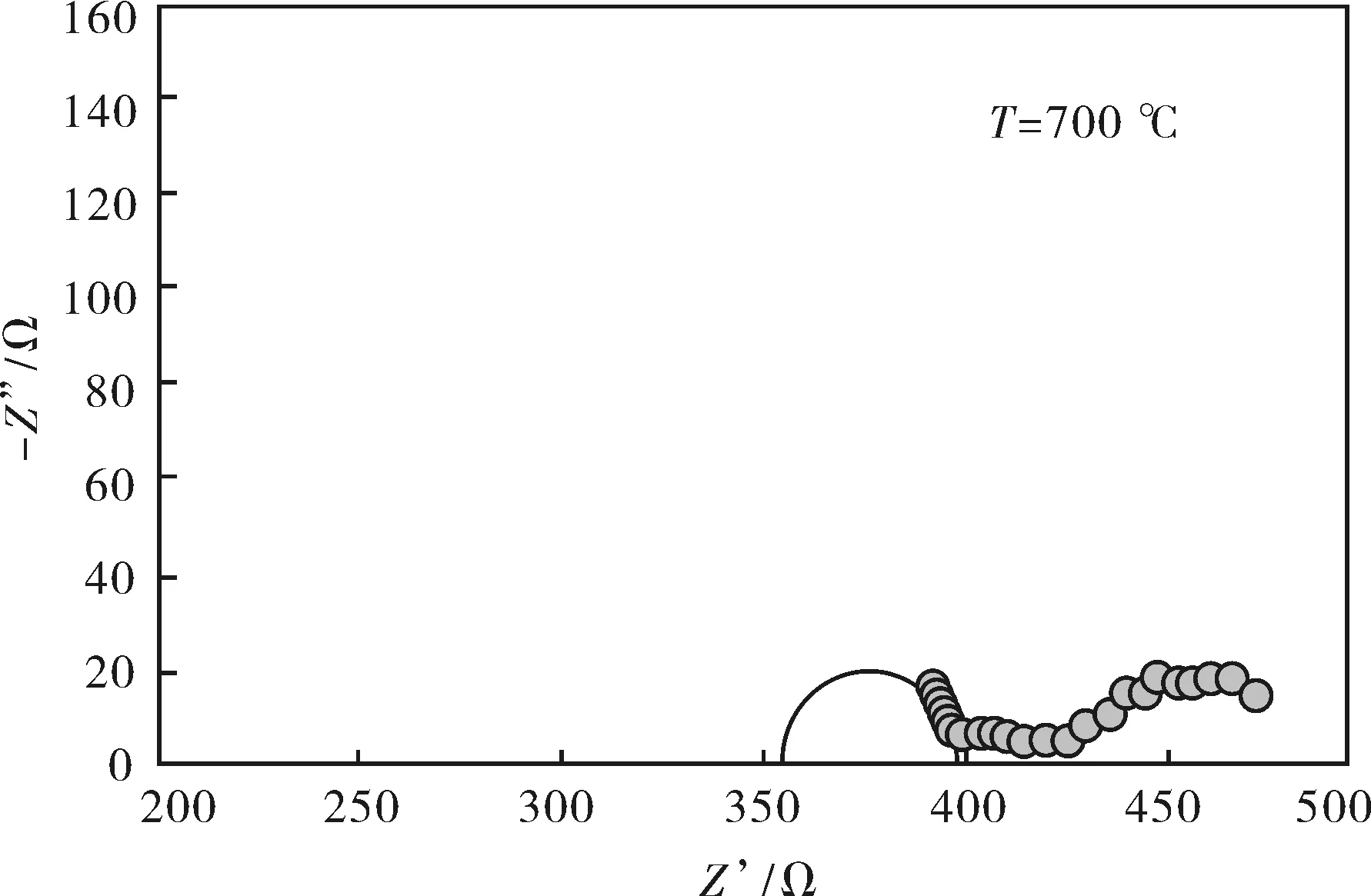
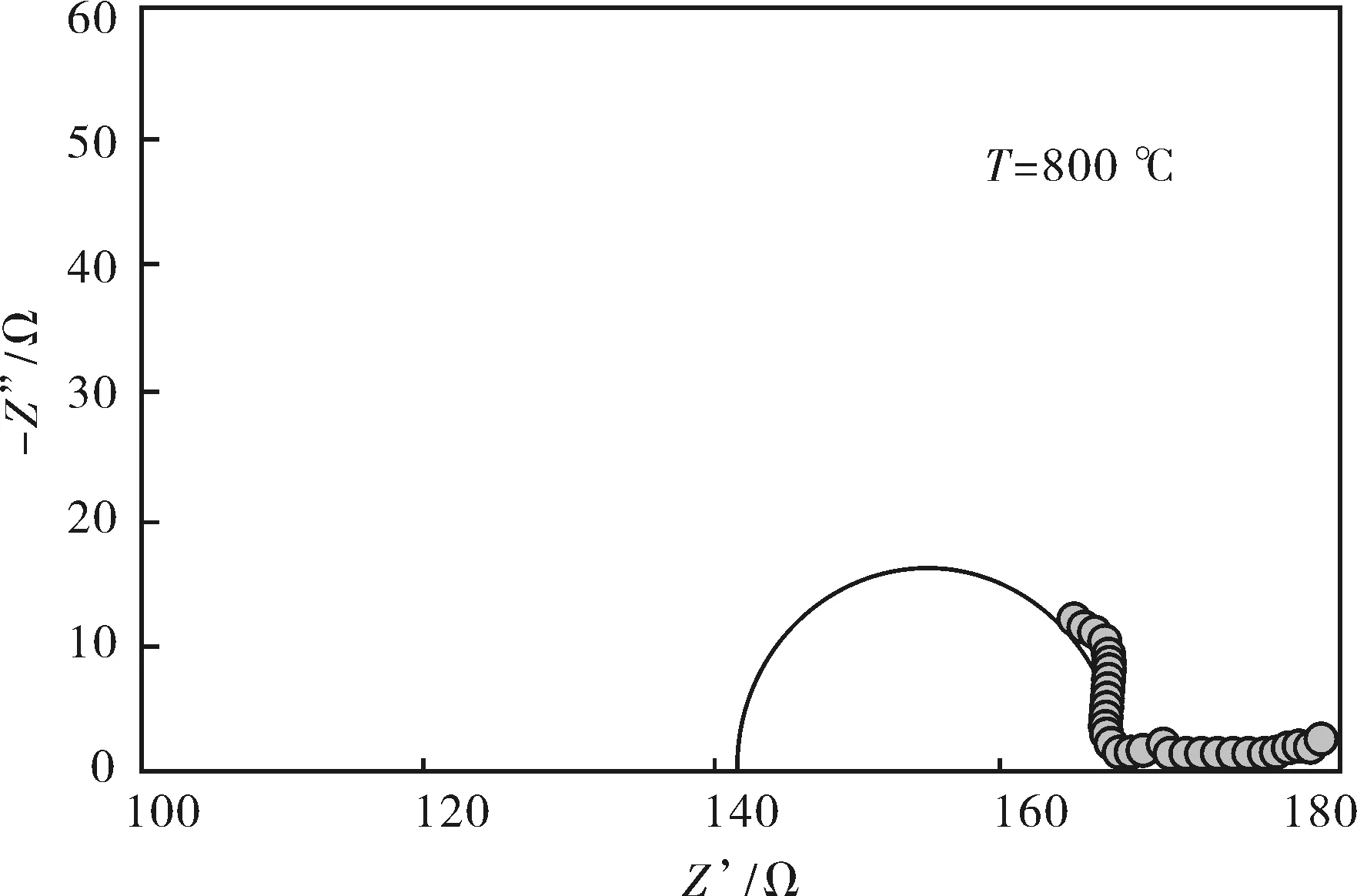
图5 La9.33Srx(SiO4)6O2+δ烧结体在500~800 ℃下的交流阻抗谱图Fig.5 AC impedance spectra of La9.33Srx(SiO4)6O2+δ at 500 ℃, 600 ℃, 700 ℃, 800 ℃
2.3 电导性能分析
图5为La9.33Srx(SiO4)6O2+δ电解质在500~800 ℃下的交流阻抗谱图.从图中可观察到,不同温度下,电解质的交流阻抗谱都是由两个半圆弧组成的,分别对应晶粒电阻和晶界电阻.使用ZSimpWin 3.10阻抗分析软件对其进行拟合,图中的实线半圆即拟合的结果图.
从拟合的结果来看,当测试温度T=500 ℃时,La9.33Srx(SiO4)6O2+δ交流阻抗谱中的晶粒电阻和晶界电阻都比较大.温度升高时,晶粒和晶界半圆弧向高频端移动,晶界电阻相对于晶粒电阻有所减小,T=800 ℃时,晶界响应半圆弧几乎消失,晶粒响应半圆弧却有增大的趋势,这表明高温范围的电阻主要由晶粒电阻控制,这也说明La9.33Srx(SiO4)6O2+δ烧结体的晶粒生长比较好.
结合以上拟合的交流阻抗谱图,利用公式计算相应的电导率(实际上是晶粒电导率和晶界电导率之和),进而得出了电导率与温度的关系图如图6所示.

图6 La9.33Srx(SiO4)6O2+δ(x=0.2)的电导率与温度的关系曲线Fig.6 La9.33Srx(SiO4)6O2+δ(x=0.2)的电导率与温度的关系曲线
图6中,LSO电解质的电导率(晶粒和晶界)与温度呈线性关系,符合Arrhenius经验公式:

其中,σ、σ0、ΔEa、k和T分别为电导率、指前因子、活化能、Boltzmann常数k=1.380 65×10-23J·K-1和绝对温度.各掺杂量的电导率如表2所示.

表2 La9.33Srx(SiO4)6O2+δ烧结体的电导率(t=800 ℃)Table 2 Electrical conductivity of La9.33Srx(SiO4)6O2+δ sintered body(t=800 ℃)
从表中可以看到,起初随着Sr掺杂量的增加,烧结体的电导率逐渐增加,x=0.2时电导率最大,800 ℃下达到4.89×10-3S·cm-1.这是由于,Sr进入LSO的晶格,增加了间隙氧的数量δ,作为离子传输的载体,δ的增加提高了氧离子的传输浓度,从而增强了LSO的电导性能[6].
值得注意的是,当掺入量继续增加到0.3时,烧结体的电导率反而下降,分析原因可能是,Sr掺入LSO晶格后,间隙氧数量增加的同时空隙率下降,阻碍了通道中氧离子的传输,使得烧结体的电导率有所下降.另外,由于Sr的离子半径(r=0.121 nm)比La的离子半径(r=0.113 nm)大,过量的掺入可能导致La位的取代而造成结构畸变,还可能使阳离子空位过少,间隙氧浓度相对变低,这些都会降低LSO总的离子电导率[13-15].因此,综合间隙氧与阳离子空位的双重作用可知,要有效提高LSO的电导性能,Sr的掺入应适量.
Ca和Mg的掺杂同样可以发现,最佳掺杂浓度是0.2.不同的是由于Ca的离子半径(r=0.108 nm)和Mg的离子半径(r=0.066 nm)小于La的离子半径,即使取代La位也不会对晶格产生太大的影响,因此电导率的下降没有Sr过量时那么明显.此外,引入间隙氧还需要形成结构畸变,同样不利于LSO电导率的提高[16].

表3 La9.33Cax(SiO4)6O2+δ和La9.33Mgx(SiO4)6O2+δ烧结体的电导率(t=800 ℃)Table 3 Electrical conductivity of La9.33Cax(SiO4)6O2+δ and La9.33Mgx(SiO4)6O2+δ(t=800 ℃)
3 电导机理
根据M. S. Islam等人[14]的研究可知,阳离子空位及氧过量的磷灰石型电解质La9.33+x(SiO4)6O2+3x/2(0≤x≤0.34)属于间隙氧离子传导机制.
实验制得的碱土掺杂La9.33Mx(SiO4)6O2+δ(M= Sr、Ca、Mg)为非化学计量的阳离子空位型电解质,且Sr、Ca、Mg的掺杂浓度控制在0~0.4,可知其传导机制也属于间隙氧传导.
综合以上电导率分析,在相同的测试温度和掺杂浓度(0~0.4)下,Sr掺杂比Ca,Mg掺杂更有利于间隙氧数量的提高,更能提高LSO的氧离子电导率.分析认为这可能是相同的掺杂浓度下,阳离子半径逐渐减小(Sr2+>La3+>Ca2+>Mg2+)的缘故.
另外值得注意的是,当掺杂浓度较小,虽然间隙氧离子数量提高的同时阳离子空位数减少,但电解质的电导率依然上升,这说明间隙氧离子对电导性能影响更大.而掺杂浓度过大时,电导率反而表现出不同幅度的下降.这可能是由于间隙氧是平行C轴的正弦曲线运动,过多的掺杂阻碍了氧离子的传输,使得电导率下降.
因此,适量的碱土掺杂(Sr、Ca、Mg)才能增加结构中间隙氧的数量,才能有效改善电导性能.
4 结 语
a. 采用尿素-硝酸盐燃烧法在较低温度下成功制得了碱土掺杂磷灰石型La9.33Mx(SiO4)6O2+δ电解质粉体,反应时间约5~7 min,较以往方法有效缩短了制备时间.
b. 通过对样品进行XRD、SEM和交流阻抗分析发现,无定形电解质粉体在800 ℃煅烧12 h即可具有p63/m磷灰石型晶体结构;掺杂对LSO电解质的形貌产生了细微的影响;同时,样品具有良好的稳定性和较好的中低温电导性能.
c. 分析产物的电导率,发现掺杂浓度为0.2时LSO的离子电导率最高,过量的掺杂反而会使电导率降低.对碱土金属离子而言,阳离子半径越大,掺杂效果越好.
d. 初步探讨了碱土掺杂LSO电解质的电导机理.实验认为La9.33Mx(SiO4)6O2+δ(Sr、Ca、Mg)属于间隙氧传导机制,间隙氧离子比阳离子空位对电导率的贡献更大.
参考文献:
[1] Baikie T, Mercier P H J, Elcombe M M, et al. Triclinic apatites [J]. Acta Cryst B, 2007, 63: 251-256.
[2] Panteix P J, Julien I, Bernache-Assollant D, et al. Synthesis and characterization of oxide ions conductors with the apatite structure for intermediate temperature SOFC [J]. Mater Chem Phys, 2006, 95: 313-320.
[3] Reina L L, Losilla E R, Lara M M, et al. Inters-titial oxygen conduction in lanthanum oxy-apatite electrolytes [J]. J Mater Chem, 2004, 14: 1142-1149.
[4] Nakayama S, Higuchi Y, Kondo Y, et al. Effects of cation-or oxide ion-defect on conductivities of apatite-type La-Ge-O system ceramics [J]. Solid State Ionics, 2004, 170: 219-223.
[5] Tolchard J R, Slater P R, Islam M S. Insight into doping effects in apatite silicate ionic conductors [J]. Adv Funct Mater, 2007, 17: 2564-2571.
[6] León-Reina L, Porras-Vázquez J M. Low tempera-ture crystal structures of apatite oxygen-conductors containing interstitial oxygen [J]. Dalton Trans, 2007,20:2058-2064.
[7] Sansom J E H, Kendric k E, Tolchard J R, et al. A comparison of the effect of rare earth vs Si site doping on the conductivities of apatite-type rare earth silicates [J].J Solid State Electrochem, 2006, 10: 562-568.
[8] 喻俊,赵旭,陈常连,等.燃烧法制备磷灰石型硅酸镧电解质材料的研究[J]. 武汉理工大学学报,2009(增刊), 32: 97-102.
[9] Yu J, wang H, Li J Q, et al. Preparation of apatite-type La9.33(SiO4)6O2electrolyte by urea-nitrates combustion[J]. Inorganic Materials, 2010, 46(11): 1212-1219.
[10] Sansom J E H, Tolchard J R, Slater P R, et al. Synthesis and structural characterisation of the apatite-type phases La10-xSi6O26+zdoped with Ga [J]. Solid State Ionics, 2004, 167: 17-20.
[11] Zhang H, Li F, Jin J. Synthesis and characteriza-tion of (Mg, Al)-doped apatite-type lanthanum germinate [J]. Solid State Ionics, 2008, 179: 1024-1028.
[12] Lee D B, Kim D J. The oxidation of Ni3Al contai-ning decomposed SiC-particles [J]. Intermetallics, 2001, 9: 51-56.
[13] Sansom J E H, Richings D, Slater P R. A powder neutron diffraction study of the oxide-ion-conducting apatite-type phases, La9.33Si6O26and La8Sr2Si6O26[J]. Solid State Ionics, 2001, 139(3-4): 205-210.
[14] Islam M S, Tolchard J R, Slater P R. An apatite for fast oxide ion conduction [J]. Chem Commun, 2003,13:1486-1487.
[15] Tolchard J R, Islam M S. Defect chemistry and oxygen ion migration in the apatite-type materials La9.33Si6O26and La8Sr2Si6O26[J]. J Mater Chem, 2003, 13:1956-1961.
[16] Irvine J T S, Corcoran D J D, Cull P A. Structure and ionic conduction in solids [J]. Nordic Energy Workshop, 2000(7):37-40.

