正确区分医疗器械编码与UDI间的不同概念
岳伟
上海市食品药品监督管理局,上海市,200010
在我国《医疗器械监督管理条例(修正案)》将要发布之前,医疗器械的命名和编码问题引起相关人士的重视。特别是医疗器械的编码,在医疗器械命名、医疗器械分类目录等一些监管基础工作中的作用,应当建立怎样的医疗器械编码制度等引起了笔者的思考。
1 医疗器械编码的内涵及其衍生作用
首先,我们必须理清一些基本概念。
所谓编码,是指一种信号系统能把一定的信息内容包含在少量特定信号(数字或字母)的排列组合之中。
所谓医疗器械编码,就是指含有少量特定信号(数字或字母)的排列能够标记出特定的医疗器械。
所谓UDI(Unique Device Identification),译成中文就是唯一的医疗器械标识。
唯一的医疗器械标识具有什么作用呢?
从医疗器械本身特征而言,唯一性标识应当:①能够区别不同国家厂商生产的不同型号规格的产品;② 能够按照医疗器械分类目录确定医疗器械的特征类别和管理类别;③ 能够获取医疗器械注册相关的部分信息;④ 能够在医疗器械产品上进行标记;⑤能够在现代管理技术中进行快速检索。
从医疗器械产品使用的角度而言,唯一性标识应当:① 能够对出厂和采购的产品进行区分,包括在不同时间段获得的产品;② 能够对销售和采购的产品使用智能化的信息管理;③ 能够追溯到产品的生产批号和对原材料的溯源;④ 能够在医疗器械使用中进行追溯和跟踪管理。
确保医疗器械的唯一性就必须具备两个层次的要求,其一就是在全中国或全世界这种型号或规格的产品是唯一的;其二是这种型号或规格的产品在不同的时间段生产出来是唯一的。由此可见,唯一性标识是需要有唯一的医疗器械特征编码和唯一的生产批号特征来共同构成。产品批号特征是由企业在生产过程中附注的。
由此可见,唯一性的标识(UDI)包含了医疗器械编码;而医疗器械编码并不是UDI。但医疗器械编码是唯一性标识的基础。为了获得统一的可以表述特定的医疗器械或医疗器械特性的编码,就必须建立强制统一的标准。而UDI在实际使用领域里是可以多样性的,是在服从医疗器械编码的基础上,适合产品的特点并形成共识公用的使用结果。
2 中国医疗器械编码发展的历史演变
中国医疗器械产品的编码是伴随着中国商品编码一起发展的,但是又远远落后于其他商品编码技术。早在20世纪90年代,在中国商品编码中心的统一组织下,由原上海医疗器械研究所承担了我国医疗器械编码工作,最后形成了“68”系列的医疗器械国家编码标准(见表1)。这个编码系统共设置了50个种类,共确定4000多个医疗器械产品目录,为国家食品药品监督管理局发布的2002版《医疗器械分类目录》中的医疗器械编码打下了基础。但是,这个编码建立时间比较早,所表述的医疗器械种类比较原始,没有建立一套可扩展、延续、修改和补充的机制。随着时间的推移,新型医疗器械的出现和医疗器械定义类别的扩充和调整,而目录没能及时进行调整,也没有专门机构管理,目前已经很少有直接使用这套编码的了。

表1 68系列医疗器械产品编码表Tab.1 code table of medical devices product of series 68
2002年国家食品药品监督管理局正式发布了《医疗器械分类目录》(以下简称分类目录)。这个《分类目录》(见表2)沿用了“68”系列的编码,并扩充了部分内容。但这个《分类目录》并没有重视医疗器械编码的作用,其重点放在风险管理等级的划分上,确定I类、II类、Ⅲ类医疗器械的分类,划分注册审批的事权。随着医疗器械产品的快速发展,很快就感到这个《分类目录》不够用了,为此当时国家局器械司提出了2005版的《分类目录》(修订稿),并向全国征求意见。但是,不知什么原因,这个征求意见稿至今没有正式发布。在这期间国家食品药品监督管理局采用了不定期发布新医疗器械的《分类界定通知》方式,来公布新的(包括新命名产品名称)医疗器械的分类规定。同样由于机制设计缺乏系统性的原因,《分类界定通知》的结果越来越乱,同样产品有不同的名称被划分在不同类别中,产品类别的划分越来越不适应技术的发展。由于产品分类不适当,出现了医疗器械的高类低批、低类高批和非医疗器械作医疗器械审批等弊端,更不用说在医疗器械产品注册编号中建立可分类、可追溯的作用了。

表2 医疗器械分类目录Tab.2 The category of medical device classification
2009年为了配合《医疗器械监督管理条例》的修订,国家食品药品监督管理局医疗器械司组织进行配套性法规编制和修订工作。其中:由上海市食品药品监督管理局承担了《医疗器械命名原则》和《医疗器械编码方式》的起草工作;由重庆市食品药品监督管理局承担了《医疗器械分类规则》和《医疗器械分类目录》的修订工作。这是国家食品药品监督管理局第一次把这4个题目集中在一起讨论,由此从系统性的角度思考,建立医疗器械命名→医疗器械分类→医疗器械分类目录→医疗器械编码之间的关系。图1表示了这种系统性的关系,所有的制度规则最终应当落实到制定《医疗器械分类目录》上,而《医疗器械分类目录》正是指导医疗器械注册、生产许可、经营许可和使用监管的基础。
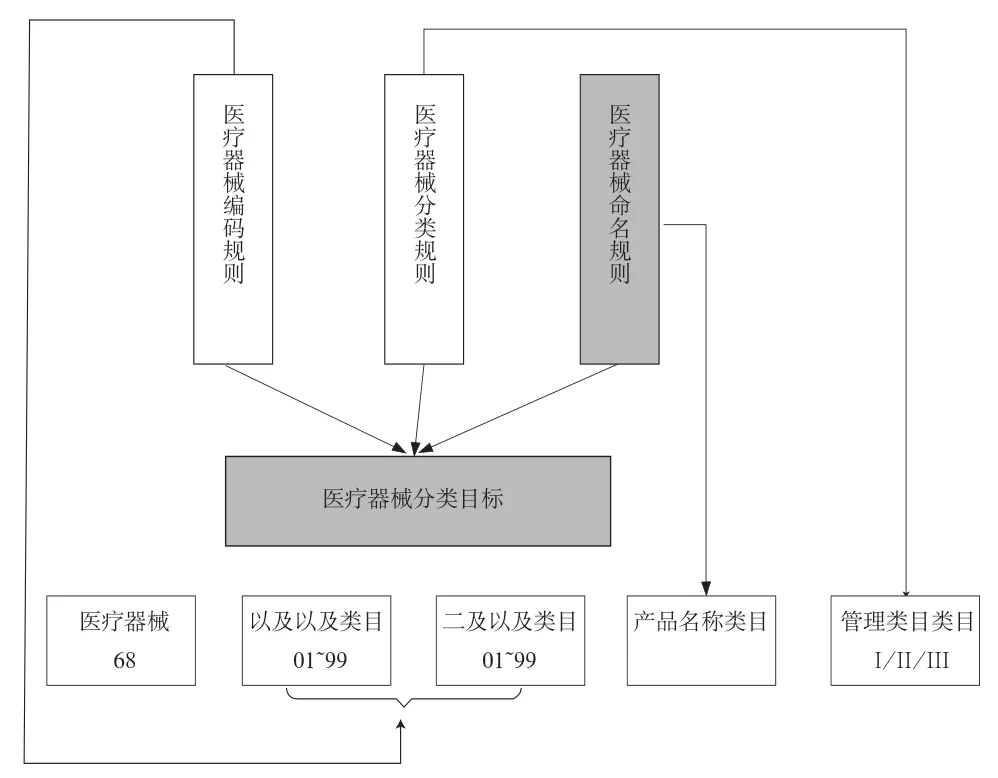
图1 医疗器械命名、分类、编码和目录之间的关系Fig.1 Relationship among nomenclature,classification, code and directory of medical devices
2007年上海市食品药品监督管理局为了对植入性医疗器械进行可追溯性管理,制定了《上海市关于加强植入性医疗器械管理的意见》,在意见中提出:植入性医疗器械应编制程序文件,规定植入性医疗器械产品可追溯的范围、程度,植入性医疗器械产品出厂必须建立可追溯的产品编码标识,产品编码包括产品特征编码和产品序列号两部分(两段)内容。这是在我国第一次提出建立植入性医疗器械可追溯的唯一性标识(UDI)。因为任何一种医疗器械首先要知道是哪一国、哪一厂生产、什么品种、什么规格的产品,这些要素组成了产品特征编码。其次要知道是什么时候、用什么材料、在什么条件下生产的和有效期到何时,这些要素组成了产品序列号。只有当产品特征编码和产品序列号合在一起,才能确定该产品是唯一的。
上海当时规定产品特征编码采用我国商品通行的编码—EAN/UCC13位码(XXX XXXX XXXXX X 即3位国别码、4位厂商识别码、5位品种规格码、1位校验码)。这组编码通过国家编码中心管理和注册,是可以得到唯一性的保证。但是其和普通商品没有什么区别。首先,没有医疗器械的特征,不适合医院采购、医保核准、产品核价以及上市后统计管理;其次,为了能够通过编码获得产品的详细信息,必须建立一个强大的专用后台数据库,这个数据需要有专门的人员和机构进行实时维护;第三,这样的数据库一旦被某些公司垄断了,就会直接影响生产经营企业产品的流通,并可以给医疗机构带来许多问题;第四,目前采用这样的编码,只针对一类特定的产品(植入性器械),且与医疗器械的分类目录和产品注册证书没有任何关联,如果所有的医疗器械产品都采用,则必然会引起新的混乱。所以从上海试行的情况来看,要建立所有医疗器械的唯一性标识(UDI),就一定要研究与所有医疗器械相关的具有特征性的医疗器械分类编码规则,也要要研究体现品种规格唯一性的产品编码规则。
最近,在讨论医疗器械唯一性标识时,有人建议我国直接采用全球医疗器械协调组织(GHTF)编制的GMDN CODE(欧盟医疗器械命名和编码)或者UMDN CODE。图2中显示的为部分UMDN CODE。
图2 UMDNS CODE部分内容示例Fig.2 UMDNS CODE part model
尽管多年来GHTF做了大量的工作,但欧洲标准化技术委员会在1994年还是建立了自己的专门标准研究小组。1996年,世界标准组织接受采用欧洲医疗器械命名标准,形成全球统一用于管理信息交换为目的医疗器械命名标准EN ISO 15225 。目前正在建立全球医疗器械命名系统(GMDN),并且已经取得初步成果。在2011年11月19日,全球医疗器械协调组织(GHTF),针对全球各国存在的认识问题,发布了支持全球单一医疗器械命名及其编码符号系统(GMDN)的立场声明。但是,这仍然是一个不十分成熟编码系统:① 其编码并不简单实用;② 其编码没有层次性;③ 其编码体现不出类别特性;④ 其编码没有原则和规律。所以,该编码系统并不符合具有医疗器械特征性和体现品种规格唯一性的原则。
另外,在医疗器械命名上GHTF编制了“命名说明”,对产品的预期用途和结构特性与医疗器械命名的关系进行了详细描述。但是,GHTF对医疗器械的命名与我国医疗器械监督管理的制度和习惯不一致的问题必须引起重视。比如,① GMDN的英文名称要完全翻译成中文,与我国生产和使用医疗器械的习惯会有冲突,必然会产生许多歧义;② GHTF推荐的医疗器械管理原则和方法与我国不一样,因为GHTF的命名系统UMDN建立的出发点是为了进行商业贸易活动。比如,国外认定的某些医疗器械我们是按照药品在进行管理;国外认为是医疗器械,我国认为是非医疗器械;国外可以很随意地将许多部件、零件命名为医疗器械,因为他们是不用上市许可的,这在我国是不适用的。我国一旦认定为医疗器械,就会采用强烈的行政管理措施;③ GHTF全球命名系统GMDN是一个国际非政府组织的收费服务项目,我国政府如果强制采用了,那么这些费用应当由谁来支付呢?
至今为止,世界上的许多国家并没有采用UMDN,比如美国采用的是FDA的医疗器械编码;日本是自成系统;即使在欧洲,德国的CA注册至今仍使用UMDNS和EDMS;英国的MD注册时使用MHRA自编的Code系统,IVD注册时可在GMDN或EDMS任选。为此,也有学者提出:鉴于目前合法取得GMDN Code的经济成本不菲,在没有EU或EEA相关盟国国内法规明确要求下,任何第三方都不应该强迫(包括中国的)制造商(非志愿性地)将GMDN Code写入DoC中,除非GMDN有朝一日能变成包括所有EU官方语言的版本并(或)大幅度降低使用者的费用(甚至变为免费使用)。欧盟要一刀切地强制所有医疗器械制造商使用GMDN code,既不现实,也不可能。
当然, UMDN和GMDN的工作做得十分细致,对医疗器械产品命名后的描述是比较详细和完整的,所以可作为我国各专业标准技委会确定医疗器械名称的基础和参考资料,也是我国建立医疗器械命名和分类目录的重要参考工具。
3 建立中国医疗器械编码的基本原则
从我国医疗器械的历史和发展角度来看,在《医疗器械监督管理条例》(修正案)出台以后,建立医疗器械编码的工作十分重要。医疗器械编码既是一项监督管理工作的基础,也是要满足医疗器械从注册生产、流通储存、采购销售、价格核准、医保核销、医院使用和报废处置全过程的贯联要求。所以,医疗器械编码应具有标准化、简明性、唯一性、层次性、稳定性和可扩展性的特征。
① 标准化
医疗器械编码必须全国统一,要符合我国商品编码的基本原则,同时考虑与国际商品编码的原则接轨。所以,我们认为中国医疗器械编码应当建立在“68”商品编码的基础上,建立在EAN/UCC编码的基础上。至于涉及编码分类细致程度的数码位数,可以根据实际需要进行必要的调整。
② 简明性
医疗器械编码可以为产品注册、生产、流通、临床各管理环节使用,也可以为生产流通、产品选择、招标采购、库存流通、统计分析等使用,所以编码的结构要清晰明了,编码的组成要简单,编码的位数不能太多。
③ 特征性
医疗器械涵盖机电、物理、化学、生物和计算机等技术,可以针对人体各种器官和组织,用于预防、诊断、治疗、监护和康复等的复杂产品。从医疗器械监管或医疗器械使用的角度来讲,编码应当具有标识医疗器械特征性的功能。我国现行《医疗器械分类目录》使用的编码,已经具有初步的特征性,只是长期没有修正而渐不可用了。
④ 唯一性
在本文前面已经说明,产品的唯一性是通过医疗器械的UDI构成,但是唯一性包含的特征性需要医疗器械编码解决。
⑤ 层次性
我国医疗器械管理将医疗器械分为三类,并分别有国家局、省级局和县级药监部门来审批注册。这种注册审批的层次性,也需要有清晰的标识。
⑥ 稳定性
为了准确地使用医疗器械的编码,建立医疗器械的唯一性标识,就必须保持医疗器械编码的稳定,保持可长期追溯的功能,而不可轻易改变。
⑦ 可扩展性
考虑到医疗器械新技术和新产品的发展,所以医疗器械编码要有可扩展性,在编码之间要有一定的可插入空间。
4 对一种建立编码原则的建议
笔者在长期的医疗器械监管工作中,总结了一种通过三维坐标对医疗器械进行分类分析的方法。图3可以非常直观地理解这种分类方式。
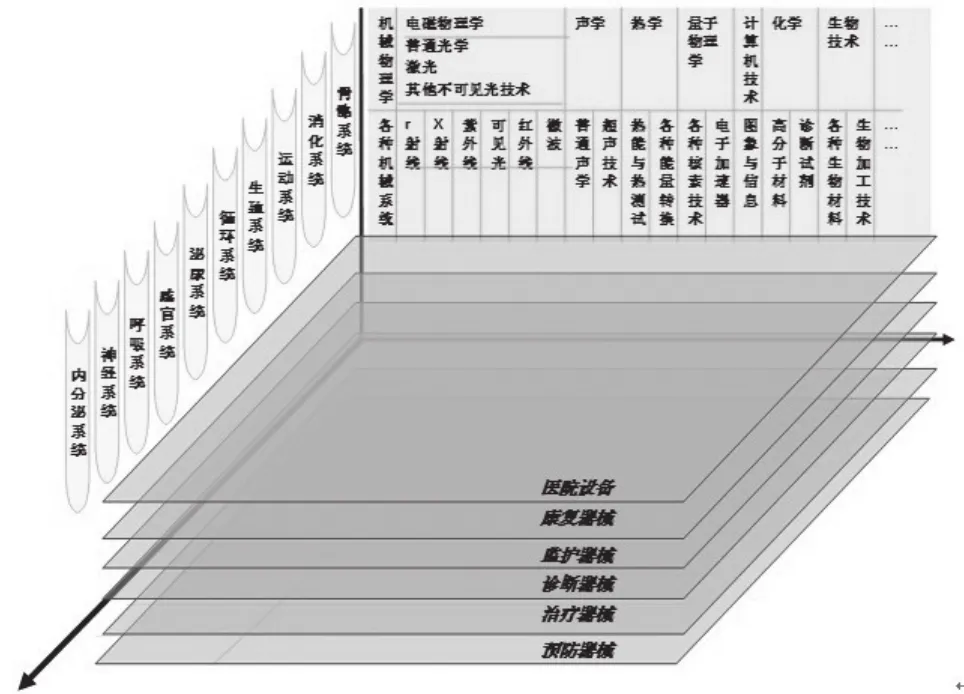
图3 医疗器械分类结构Fig.3 cvarieties structure of medical devices
假设X坐标体现了组成医疗器械的技术要素,比如:机械机构、光学、激光、声学、超声、电学、电子、电场、磁学、高能物理和量子物理等;以及纤维材料、膜技术材料、金属材料、化学材料、纳米材料、动物材料、生物材料和组织工程材料等;还有计算机技术、网络技术和人工智能技术等。Y坐标可以是组成人体的各个系统或器官,也可以是部分临床科室。其发展的趋势是人体的分解已经从器官组织向细胞分子水平的方向发展;临床科室越来越细化或者交叉。Z坐标表示医疗器械的主要预期用途,比如预防、治疗、诊断、监护、康复和辅助设备等,还包括器具、辅料、敷料、手术器械和辅助器具等。
上述三维要素的组合可以形成编制医疗器械编码的基本原则方法。该方法是采用“68 XX YY”编码,其中“68”已经约定为“医疗器械”,所以可以考虑“缺省”;“XX”主要按照X坐标的技术要素,可以形成从01~99分类;“YY”可以采用Y坐标和Z坐标混合的编码,形成01~99的分类,以针对特定的人体结构或临床科室,包括可通用的器械根据目前的医疗器械种类划分,这其中会有许多空缺数码,可以留待新技术的发展而补充。当一个全新类别的医疗器械出现,在未能完成对其分类和编码之前,可以约定采用“99”作为临时编码。另外,考虑到医疗器械的风险类别也是十分重要的信号,在编码中可加上“A”码。“A”码就是“3、2、1”,代表“Ⅲ、Ⅱ、Ⅰ”类医疗器械。最后,形成的医疗器械编码是“A XX YY”,十分简单。其实,目前我国实行的“68”系列的编码、《分类目录》的编码已经采用了这样一个原则方法,问题在于我们以前的工作太粗,不够细致,没有及时随着技术的发展进行调整,也没有一个可以调整的空间和制度保证。
最后必须指出,要建立一个科学、完整、实用、发展的医疗器械编码,以及用好医疗器械唯一性标识,一定要依靠现代网络技术,实行信息公开。希望国家医疗器械监管部门能够在实行我国医疗器械编码和推行医疗器械唯一性标识时,能够建立一个专业网站,以使我国医疗器械监督管理的基础更加扎实。
参考文章
[1]统一医疗器械命名和唯一标识, 推动医院信息化发展——访上海食品药品安全研究中心资深顾问严樑.http//www.tech-ex.com/equipment/interview, 2012, 4, 9.
[2]岳伟.对医疗器械命名规则和分类目录的见解[J].中国医疗器械杂志, 2010, 34(1): 44-46.
[3]武俊华.医疗器械命名系统规范——国际标准介绍[J].海外信息, 2000, (3): 43-46.

