新型二茂铁新木脂素类化合物的合成与表征
张春香, 刘正联, 周诗彪, 郑清云, 申有名
(湖南文理学院 化学化工学院, 湖南 常德, 415000)
新型二茂铁新木脂素类化合物的合成与表征
张春香, 刘正联, 周诗彪, 郑清云, 申有名
(湖南文理学院 化学化工学院, 湖南 常德, 415000)
以芳香醛和丙二酸为原料, 通过Knoevenagel反应、酯化反应、氧化偶联反应合成了苯并呋喃类新木脂素, 苯并呋喃类新木脂素与二茂铁甲酸反应, 首次合成了2种新型二茂铁基新木脂素化合物, 其结构经1H NMR、MS、IR进行了表征.
二茂铁; 新木脂素; 合成; 表征
木脂素是一类广泛存在自然界的天然化合物, 具有良好的生理活性, 如保肝、抗病毒、抗肿瘤、抗氧化活性等[1-5]. 新木脂素属于木脂素的一种, 自从 eptoside木脂素化合物作为抗癌药物应用于临床之后[5], 新木脂素化合物也引起了人们的高度重视. 二茂铁具有亲油性、低毒性、抗肿瘤等多种生理活性[6], 能在生物酶作用下参与各种代谢, 因而得到了广泛的应用. 有报道显示, 具有生物活性分子中的某些芳香环被二茂铁基取代后, 可提高整个化合物的活性[7]. 如二茂铁阿司匹林[8]、异维A酸二茂铁[9]、青霉烯二茂铁[10]等. 基于二茂铁衍生物和木脂素这两种物质的特性, 以实现活性成分的优化叠加, 为此我们首次合成了2 种未见文献报道的新型二茂铁新木脂素类化合物(图1).
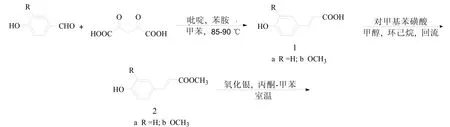

图1 化合物合成路线
1 仪器与试剂
Varian INOVA-400型核磁共振仪(CDCl3为溶剂, TMS为内标); Nicolet FTIR-3700型红外光谱仪(KBr压片); Agilent 1100型液质联用仪; 二茂铁甲酸按文献[11]方法合成; 甲苯、丙酮、二氯甲烷经干燥处理后使用. 其他试剂均为市售分析纯.
2 化合物合成
2.1 1a的合成
将4-羟基苯甲醛12.00 g(100 mmol)、丙二酸13.84 g(108 mmol)、13 mL吡啶、28 mL甲苯和1.6 mL苯胺依次加入到三颈瓶中, 加热至85-90 ℃搅拌7 h, 冷至室温, 加入54 g 25%的碳酸钾溶液, 搅拌15 min后分出水层, 冷却下水层用浓盐酸调pH值至3~5, 析出粗品, 粗品用水重结晶, 得淡黄色针状结晶11.80 g, 产率72%.
2.2 2a的合成
将1a 10.00 g(60 mmol)、对甲苯磺酸5.16 g (30 mmol)、40 mL环己烷和40 mL甲醇加入到三颈瓶中, 加热回流3 h, 减压蒸出环己烷和未反应完的甲醇. 残留物用饱和 NaHCO3溶液中和, 抽滤, 水洗,得淡黄色固体9.51 g, 产率为89%, 该产品较纯, 可直接用于下一步反应.
2.3 3a的合成
氮气保护下, 将2a 8.90 g (50 mmol)、125 mL干甲苯和75 mL干丙酮, 加入到三颈瓶中, 搅拌溶解后加入氧化银5.80 g(25 mmol), 室温反应60 h(TLC跟踪), 过滤, 旋干, 柱层析[洗脱剂为V(石油醚)/V(乙酸乙酯) = 3:1], 得化合物3a.
用相同的方法合成化合物3b.
3a: 产率32%.1H NMRδ: 7.65(d, J = 16.0 Hz, 1H), 7.55(s, 1H), 7.42(d, J = 8.4 Hz, 1H), 7.28(d, J = 8.0 Hz, 2H), 6.89(d, J = 8.4 Hz, 1H), 6.81(d, J = 8.0 Hz, 2H), 6.32(d, J = 16 .0 Hz, 1H,), 6.11(d, J = 7.6 Hz, 1H), 4.26(d, J = 7.6 Hz, 1H), 3.84(s, 3H), 3.80(s, 3H); MS: m/z: 355 [M+H]+; IR(KBr) cm-1: 3 421, 1 696, 1 642, 974.
3b: 产率51%.1H NMRδ: 7.66(d, J = 16.0 Hz, 1H), 7.31 ~ 6.80(m, 5H), 6.45(d, J = 16.0 Hz, 1H), 6.02(d, J = 8.0 Hz, 1H), 4.50(d, J = 8.0 Hz, 1H), 3.93(s, 3H), 3.86(s, 3H), 3.83(s, 3H), 3.80(s, 3H); MS: m/z:415 [M+H]+; IR(KBr) cm-1: 3 421, 1 748, 1 645, 981.
2.4 4a的合成
氮气保护下, 将二茂铁甲酸 0.232 g (1 mmol)和10 mL 二氯甲烷加入到三颈瓶中, 搅拌溶解冷却至0 ℃后, 加入HOBt (162 mg, 1.2 mmol)、 Et3N (0.33 mL, 2.4 mmol)和EDCI (230 mg, 1.2 mmol), 搅拌30 min. 反应温度升至室温, 加入3a 0.354 g (1 mmol), 搅拌过夜. 反应液加水, 然后用乙酸乙酯萃取3 次, 合并有机层, 有机层用1 M的盐酸溶液、水、饱和碳酸氢钠溶液、饱和食盐水分别洗涤2次, 无水硫酸镁干燥, 旋干, 经柱层析[洗脱剂为V(石油醚)/V(乙酸乙酯) = 8:1], 得化合物4a.
用相同的方法合成化合物4b.
4a: 产率87%.1H NMR (CDCl3, 400 MHz) δ ppm: 7.66(d, J = 16.0 Hz, 1H), 7.55(s, 1H), 7.43(d, J = 8.4 Hz, 1H), 7.41(d, J =8.8 Hz, 2H), 7.19(d, J = 8.8 Hz, 2H), 6.91(d, J = 8.4 Hz, 1H), 6.32(d, J = 16.0 Hz, 1H), 6.17(d, J = 7.6 Hz, 1H), 4.27(d, J = 7.6 Hz, 1H), 4.29 (s, 2H), 4.21 (s, 2H), 4.18 (s, 5H), 3.83(s, 3H), 3.81(s, 3H); MS: m/z: 567 [M+H]+; IR(KBr) cm-1: 2 934, 1 734, 1 721,1 624, 1 071, 1 028, 975.
4b: 产率74%.1H NMR (CDCl3, 400 MHz) δ ppm: 7.65(d, J = 16.0 Hz, 1H), 7.34~6.85 (m, 5H), 6.37(d, J = 16.0 Hz, 1H), 6.09(d, J = 7.6 Hz, 1H), 4.50(d, J = 7.6 Hz, 1H), 4.27 (s, 2H), 4.23 (s, 2H), 4.19(s, 5H), 3.93(s, 3H), 3.94(s, 3H), 3.84(s, 3H), 3.80(s, 3H); MS: m/z: 627 [M+H]+; IR(KBr) cm-1: 2 946, 1 734, 1 725, 1 627, 1 070, 1 025, 977.
3 结论
在碱的催化下, 芳醛与丙二酸发生脱水缩合反应, 合成了化合物1, 是一个典型的Knoevenagel反应. 但在该反应中, 当反应温度超过100 ℃时, 得到的是不需要的顺式产物[12]. 在化合物2的合成中,以对甲苯磺酸代替浓硫酸作为催化剂, 以环己烷作为带水剂, 缩短了反应时间, 提高了反应产率. 在化合物3的合成中, 氧化银氧化酚羟基得到自由基, 该反应是一种自由基仿生氧化偶联反应. 在化合物4的合成中, 以EDCI和HOBt代替了常用的DCC和DMAP作为缩合剂, 得到的副产物脲容易除去, 从而简化了纯化过程.
[1] Hu C, Yuan Y V, Kitts D D. Antioxidant activities of the flaxseed lignan secoisolar iciresino diglucoside, itsaglycone secoiso lariciresinol and the mammalian lignans enterodio and enterolactone invitroc[J]. Food and Chemical Toxicology, 2007, 45(11): 2219-2227.
[2] Kim Y W, Lee S M, Shin S M, et al. Efficacy of sauch inone as a nove lampk-activ ating lignan for preventing ironinduced ox ida tive stress and liver injury[J]. Free Radical Biology and Medicine, 2009, 47(7): 1082-1092.
[3] 胡俊杰, 李炳瑞, 黄林春, 等. 一类鬼臼毒素衍生物抗癌(KB细胞)活性的三维定量构效关系[J]. 兰州大学学报:自然科学版, 2008, 44(5): 59-62.
[4] Fan Y, Ma Y, Peng Y, et al. A new lignan from fruit of Schisandra wilsoniana A. C. Smith and its ant-IH IV activity[J]. Asian Journal of Chemistry, 2009, 21(7): 5488-5492.
[5] Li Y, Ma Y, Peng Y, et al. A new lignan from the fruit of Schisandra lancifolia and its anti-H IV activity[J]. A sian Journal of Chemistry, 2009, 21(7): 5794-5796.
[6] Kelly P N, Pretre A, Dovoy S, et a1. Synthesis, stntctural characterisation and biological activity of novel N-ferocenylmethyl benzene-carboxamide derivatives[J]. Journal of Organometallic Chemistry, 2007, 692(6): 1327-1331. [7] Staveren D R V, Metzler N N. Bioorganometallic chemistry of ferrocene[J]. Chem. Rev, 2004, 104(12): 5931-5986.
[8] Biot C, Francois N, Maciejewski L, et al. Synthesis and antifungal activity of a ferrocene-fluconazole analogue[J]. Bioorg Med Chem Lett, 2000, 10(8): 839-841.
[9] 梁盛宗, 忻鼎丞, 龙伯华, 等. 异维A酸二茂铁基衍生物的合成及其细胞毒活性的研究[J]. 有机化学, 2009, 29(7):1092-1095.
[10] 杨迎, 何纯莲, 吴超, 等. 青霉烯二茂铁衍生物的合成与抗菌活性研究[J]. 有机化学, 2010, 30(12): 1840-1847.
[11] 王世辉, 洪秀云, 孙蕊, 等. 二茂铁甲酸的合成[J]. 应用化工, 2007, 36(6): 540-541.
[12] 张春香. 苯并呋喃和8-5'新木脂素类化合物的合成方法研究[D]. 长沙: 湖南大学, 2006.
(责任编校: 刘晓霞)
Synthesis and characterization of new ferrocenyl neolignan
ZHANG Chun-xiang, LIU Zheng-lian, ZHOU Shi-biao, ZHENG Qing-yun, SHEN You-ming
(Departement of Chemistry, Hunan University of Arts And Scince, Changde 415000, China)
Benzofuran neolignan compounds were synthesized via Knoevenagel reaction, esterification and oxidative coupling from aromatic aldehyde and malonic acid. Two ferrocenyl neolignans were obtained by the reaction of benzofuran neolignan compounds with ferrocenecarboxylic acid. Their structures were characterized by1H NMR, MS and IR.
ferrocene; neolignan; synthesis; characterization
O 621.3
1672-6146(2012)02-0031-03
10.3969/j.issn.1672-6146.2012.02.008
2012-02-08
湖南文理学院科学研究基金项目(JJYB1010); 湖南省重点学科建设项目(应用化学).
张春香(1981-), 女, 硕士, 主要从事有机合成. E-mail: cxzhang81@163.com

