高粱DNA导入“豫麦66”引起后代变异及SSR分析
张彦波,张希太,谢淑芹,肖磊
(河北省邯郸市农业科学院生物技术中心,河北邯郸056001)
小麦是世界上最重要的粮食作物之一,也是我国的第二大粮食作物.我国小麦常年种植面积在0.3亿hm2以上.小麦育种工作一直是农业科研关注的问题,随着人口的持续增长和耕地面积的不断减少,我国的粮食问题表现得更加突出,寻求具有抗逆、优质、高产、稳产等优良性状的转基因小麦和弥补种质资源的短缺一直是从事小麦研究的科研工作者不懈努力的目标.C4植物(高粱、玉米等)具有生育期短、高光合效率、高产量等突出特点,近年来,一些育种工作者探索着将高光效的C4植物的总DNA导入C3植物并取得了一定的成绩[1].詹庆才等[2]采用花粉管通道法将玉米、高粱、稗子总DNA导入栽培水稻中,后代在抽穗期、穗型、株高、生育期等方面出现了变异.倪建福[3]通过花粉管通道将高粱总DNA导入3个春小麦品种,经过多代选择获得了多个稳定的品系.于元杰[4]、张希太等[5-7]将高粱DNA和牛胸腺DNA导入“周麦16”、“藁优9415”、“矮抗58”等冬小麦品种选育出了多个变异种质系.为了在“豫麦66”的遗传基础上创造新的冬小麦品种资源,我们开展了将高粱DNA导入“豫麦66”选育新的冬小麦变异种质系的研究.
1 材料与方法
1.1 试验材料
供体为高粱“抗5”种子,由河北省张家口市农业科学院赠送;受体材料为“豫麦66”种子,由河南省兰考天民种业赠送。
1.2 试验方法
1.2.1 高粱DNA的提取与导入液的制备 先将高粱“抗5”的种子播种到沙盘中,长成幼苗后剪取幼嫩部分,采用CTAB法提取总DNA并纯化.将纯化后的DNA溶于1×TE缓冲液,取少量DNA液稀释后用紫外分光光度计测定 OD260、OD230、OD280的值,若 OD260/OD230≥2.0 且 OD280/OD260≥1.8,表明 DNA 的纯度达标,否则继续纯化直至达标;计算DNA母液的质量浓度(DNA母液的质量浓度/(μg/mL)=稀释倍数×OD260×50),根据DNA母液的质量浓度和花粉管通道法导入的要求用0.1×TE缓冲液稀释母液到500 μg/mL并按每10 mL加入1 μL的“Triton X-100”后即为导入液,分装后在-20℃冰箱中保存备用.
1.2.2 DNA的花粉管通道法导入 在大田小麦的抽穗扬花期,选择大部分小花正在扬花的“豫麦66”的麦穗作为导入材料,在扬花后2 h开始整穗,去掉尚未开放或已开过的小花,在颖片内沿柱头与子房颈分叉处剪去羽毛状柱头,立即用微量注射器滴加8~10 μLDNA导入液于子房颈切口处,然后套袋并挂标签标记.2~4 h后复滴1次,以滴加0.1×TE缓冲液(按每10 mL加入1 μL的“Triton X-100”)的受体材料作为对照.
1.2.3 后代材料的收获种植与选择 小麦成熟后按处理穗和对照穗分别收获,并分别脱粒后保存D0代种子.当年的9月底在大田中,将DNA导入处理的D0种子按小区单穴单粒播种,并以同样的方法种植经0.1×TE缓冲液处理的种子为对照.第二年小麦成熟收割前进行大田调查与选择,主要调查DNA导入处理的变异株率、变异类型等,然后选择各具特色的优良的变异单株,按株系脱粒保存D1代种子.以后每年按株系单穴单粒播种,并逐年选择直到获得稳定的变异株系.
1.2.4 稳定变异株系的SSR分子标记检测
模板DNA的提取:采用SDS法并参照文献[3]的方法,从样品小麦暗培养的黄花麦芽中提取DNA并纯化,然后取少量的DNA样品溶于无菌的超纯水中制成质量浓度约为20 ng/μL的模板液.
PCR反应体系的构建与引物的选择:根据Roder发表的SSR引物[4-5],随机选取分布于各对染色体上的SSR引物32对,由上海生工生物工程技术服务有限公司合成.PCR反应采用25 μL体系,其中Taq DNA 聚合酶(5U/μL)0.2 μL,DNA 模板液 0.5 μL,上下游引物各 1 μL,25 mmol/L MgCl22 μL,各种核苷酸浓度均为 2.5 mmol的 dNTP 1 μL,10×buffer 2.5 μL,无菌超纯水 16.8 μL,矿物油 15 μL.PCR 反应在英国TECHNE公司生产的TC-5000 PCR仪上进行,反应程序为:94℃预变性5 min,94℃变性50 s,50℃退火50 s,72℃延伸1 min,30个循环;72℃后延伸5 min,4℃保存.
扩增产物的检测:扩增产物采用6%的变性聚丙烯酰胺凝胶电泳检测,每泳道上样量为8 μL,在200 V恒电压下电泳2.5 h,剥胶,银染,照相,进行扩增条带的分析.
2 结果与分析
2.1 高粱“抗5”DNA导入小麦“豫麦66”D1代、D2代性状变异的统计分析
2004年5 月份我们采用花粉管通道法将高粱“抗5”的DNA导入“豫麦66”小麦单穗106个,共收获D0代种子1 960粒,当年10月初在试验田中将D0代种子采用单穴单粒播种,共出D1代苗1 710株.同样采用单穴单粒播种0.1×TE缓冲液处理的种子为对照.从D1代就开始出现少量的变异单株,2005年10月份,我们从D1代中共选出13个变异单株分别按株系单穴单粒播种,并播种适量的“豫麦66”作为对照.从D2代开始我们选择优良变异单株,淘汰劣变,直到获得稳定的株系为止.高粱“抗5”DNA导入小麦“豫麦66”D1代D2代性状变异的统计结果见表1.
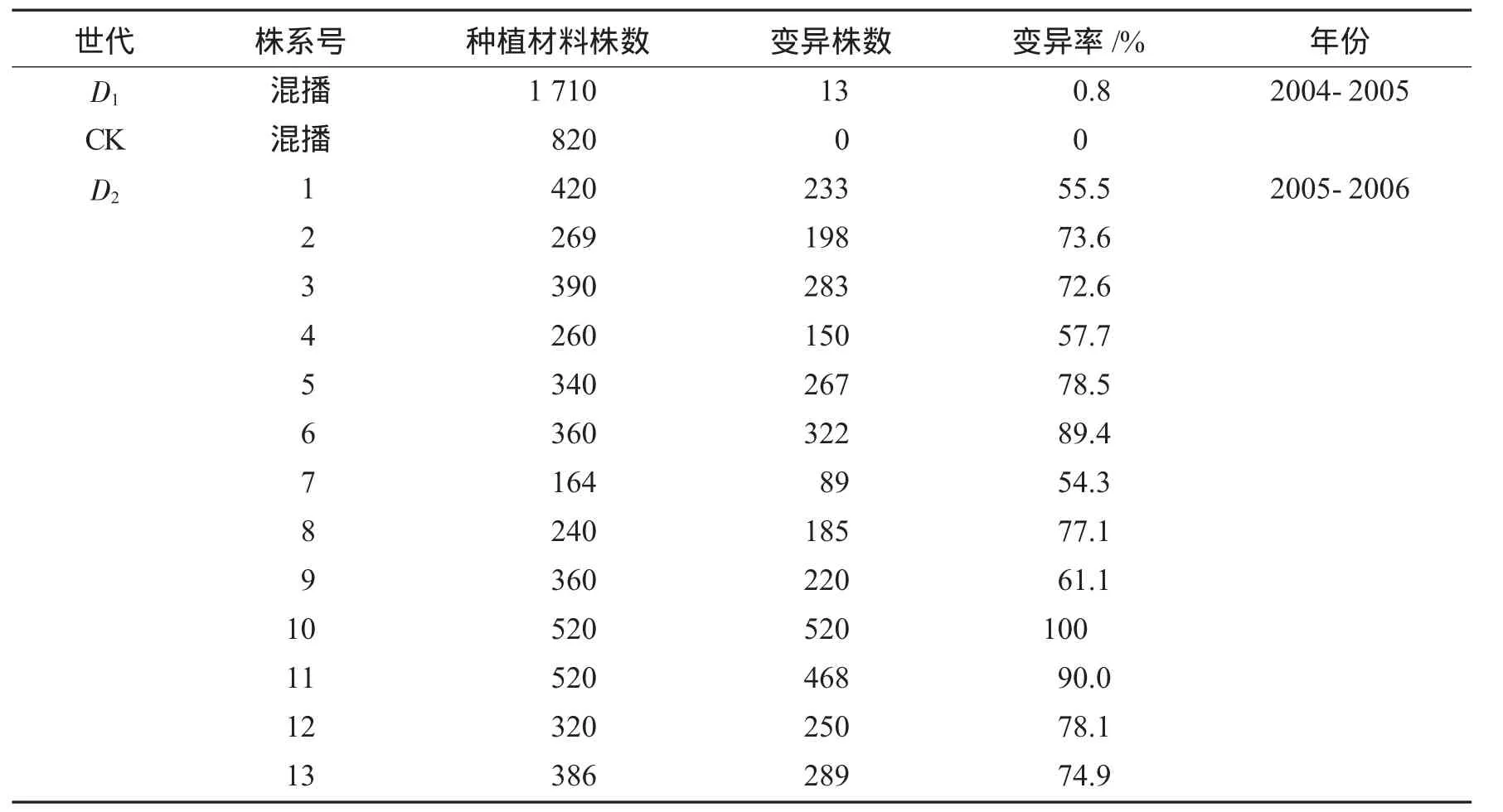
表1 D1代和D2代性状变异率
由表1可见,高粱“抗5”的DNA采用花粉管通道法导入“豫麦66”后,从D1代就开始出现少量的变异单株,变异率仅为0.8%.将D1代选出的13个变异单株分别按株系单穴单粒播种,产生的D2代中变异株数和变异率均显著升高.在D2代中13个株系均发生性状分离,大部分株系除分离出各种变异类型外还分离出一定数量的“豫麦66”原型.
D1代D2代性状变异类型统计结果见表2.

表2 D1代、D2代性状变异类型
由表2可见,13个D1代变异单株的性状变异类型分别表现在株高、蜡质层、芒型、穗型、旗叶、成熟期几个方面,用0.1×TE缓冲液处理的对照种子在D1代无变异出现.将D1代选出的13个变异单株分别按株系单穴单粒播种,得到的D2代变异单株的性状变异类型也基本上表现在株高、蜡质层、芒型、穗型、旗叶、成熟期几个方面.
2.2 D66-6和D66-1的SSR分子标记检测结果
从D3代开始已经有部分株系表现稳定,经过多代的选择,目前我们已经从高粱“抗5”的DNA导入“豫麦66”的变异系统中获得稳定的各具特点的种质系4个.其中D66-6和D66-1两个品系综合农艺性状好,经2年计产对比试验,平均产量分别超对照品种“石4185”8.38%和9.64%.为了给D66-6和D66-1寻找分子水平的证据,为今后参加品种区域试验做准备,我们对“豫麦66”、D66-6、D66-1、高粱“抗5”的DNA进行了SSR分子标记检测,结果见表3.
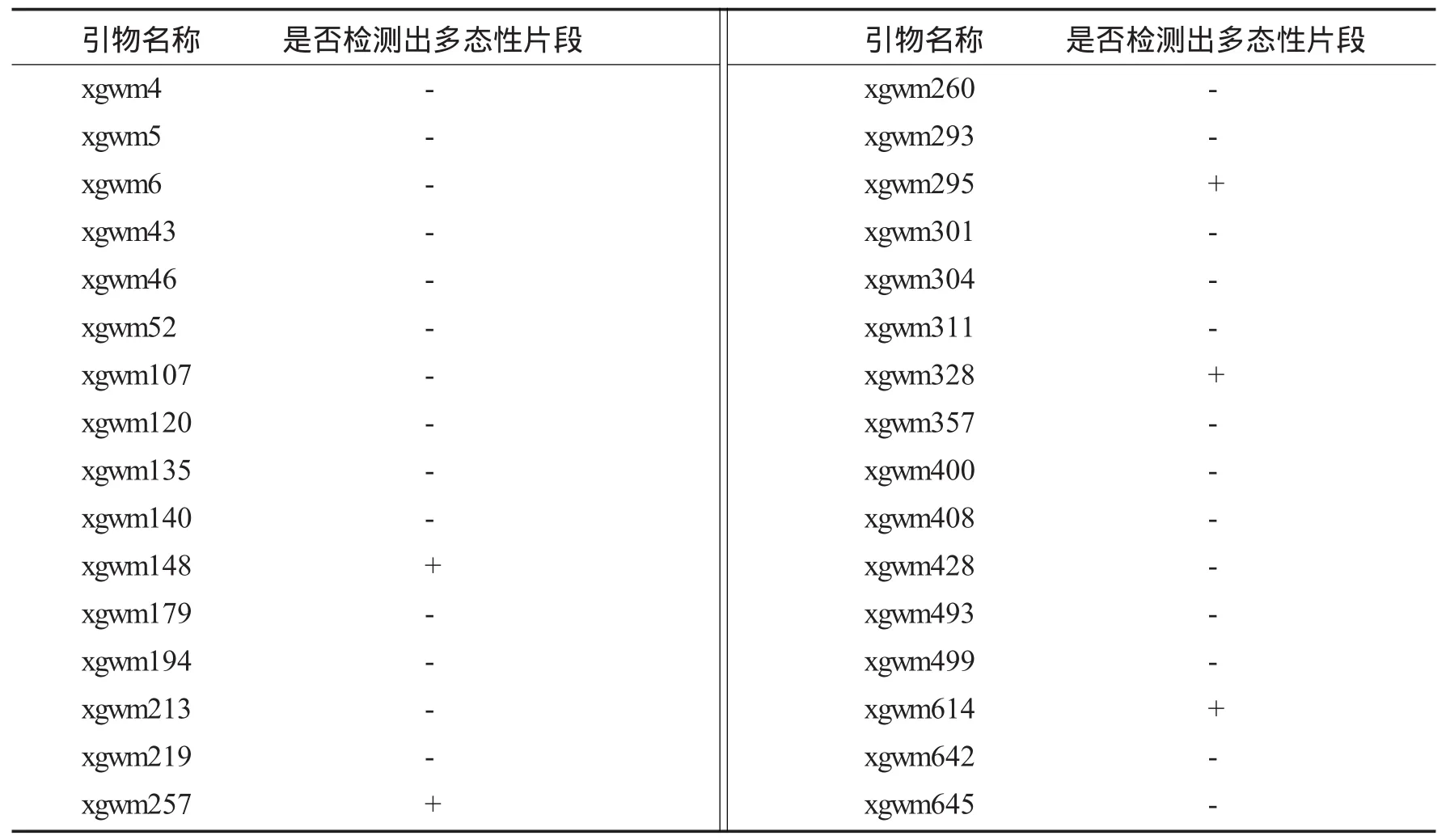
表3 SSR分子标记检测
由表3可见,在用于SSR分子标记检测的32对引物中有5对引物检出较丰富的多态性片段,所用引物的多态性片段检出率达 15.6%.其中引物 xgwm148、xgwm614、xgwm295、xgwm328、xgwm257 在“豫麦66”、D66-6、D66-1、高粱“抗5”的DNA中检出较丰富的多态性条带(见图1).这些多态性条带中和对照“豫麦66”相比有的是新增条带,有的是缺失条带.
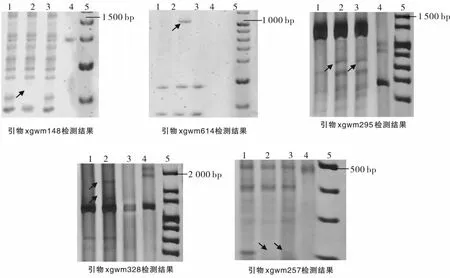
图1 5对引物的检测结果
3 小结与讨论
高粱“抗5”的DNA采用花粉管通道法导入“豫麦66”后,D1代就开始在株高、蜡质层、芒型、穗型、旗叶、成熟期几个方面出现少量的变异单株;在D2代中变异株系均发生性状分离,D3代开始出现稳定的品系.用SSR分子标记检测D66-6和D66-1两个稳定品系,引物xgwm148、xgwm614、xgwm295、xgwm328、xgwm257检测出了较丰富的多态性DNA片段.
本试验中,用SSR分子标记检测D66-6和D66-1两个稳定品系的基因组DNA时只检出了和“豫麦66”不同的多态性片段,没有检测出高粱“抗5”的DNA所特有的带型,有待于加大引物的使用数量,进一步检测.本研究结果表明,利用外源DNA导入技术可实现小麦远缘、超远缘遗传物质的转移,极大地丰富了小麦遗传的物质基础,为创造新的突破性的种质资源材料开辟了有效途径.
[1]周文鳞,倪建福,王亚馥,等.外源 C4作物 DNA 导入小麦的研究[J].作物学报,1992,18(6):418-423.
[2]詹庆才,刘志刚,张玉烛,等.外源DNA导入水稻引起形状变异的研究[J].作物研究,1995,9(2):10-11.
[3]倪建福.高粱DNA导入小麦选育出抗条锈病白粒新品系[J].甘肃农业科技,1994(7):10-11.
[4]于元杰.超远缘DNA导入小麦选育种质系的研究[J].农业生物技术学报,2000,2(增刊):32-35.
[5]张希太,谢淑芹,张彦波,等.高粱DNA导入小麦“周麦16”引起后代变异的研究及SSR分析[J].安徽农业科学,2011,39(15):8872-8874.
[6]张希太.牛胸腺DNA导入“藁优S415”后代变异及SSR分析[J].安徽农学通报,2011,17(7):41-44.
[7]张希太,谢淑芹,张彦波,等.牛胸腺DNA导入“矮抗58”后代变异及SSR分析[J].山西农业大学学报:自然科学版,2011,31(2):151-155.
[8]王关林,方宏筠.植物基因工程原理与技术[M].北京:科学出版社,1998:598-599.

