乳腺肿瘤高频彩超及超声造影与微血管密度的相关性
乳腺癌是妇女最常见的恶性肿瘤之一,严重威胁女性健康,且发病年龄呈年轻化趋势。术前准确、无创地判断肿瘤的血供情况及性质,对临床选择治疗方案具有重要意义。乳腺癌的生长、转移与血管生成密切相关[1],微血管密度(microvessel density, MVD)是反映恶性肿瘤是否侵袭和转移的一个重要指标,也是判断肿瘤患者预后的重要因素[2]。本研究通过检测乳腺良恶性肿瘤的彩色多普勒血流显像(CDFI)血流参数、超声造影(CEUS)参数及病理MVD,研究CDFI血流分级、超声造影定量参数与MVD的相关性,以探讨CEUS在乳腺肿瘤鉴别诊断中的应用价值。
1 资料与方法
1.1 研究对象 2009-03~2010-12在弋矶山医院行乳腺肿瘤手术切除的82例患者,手术后病理证实乳腺癌55例,良性肿瘤27例,患者均为女性,年龄19~89岁,平均(48.0±14.5)岁。所有患者于超声造影检查前均签署检查同意书。排除超声造影检查前接受其他治疗者及严重心脑血管疾病者。
1.2 仪器与方法
1.2.1 仪器 采用百胜Mylab 90彩色多普勒超声诊断仪,仪器内置有实时造影匹配成像(contrast tuned imaging, CnTI)技术及造影曲线自动分析软件。高频探头为LA523变频线阵探头,造影探头为LA522变频线阵探头。设定造影机械指数为0.07。造影剂为声诺维(SonoVue),微泡平均直径2.5µm。
1.2.2 乳腺超声检查 顺序扫查,测量肿块大小,观察肿块形态、边界、内部及后方回声、包膜是否完整及纵横比。采用CDFI模式观察病灶周边及内部血流信号及其分布情况,按Adler分级[3]将肿块内血流分为4级:0级无血流信号;Ⅰ级少量血流,可见1~2处点状血流;Ⅱ级中等量血流,可见多条小血管或1条血管超过病灶的半径;Ⅲ级血流丰富,可见4条以上血管或交织成网状。多普勒取样选择色彩相对明亮的血管,校正声束与血流夹角θ<60°,取样容积宽度为1mm,测量动脉血流峰值流速(PSV)、阻力指数(RI)。激活超声造影模式,选择合适的切面切换至实时灰阶超声造影显像模式,保持探头稳定且清晰显示乳腺肿块;适当降低中后场增益,82例患者使用相同的仪器条件。经肘静脉团注造影剂2.4ml,快速推注5ml生理盐水,同时启动CLIP、START/TIMER按钮。记录造影全过程并动态观察,手动勾画出病灶增强图像,应用时间-信号强度曲线(TIC)分析软件测定峰值强度(peak intensity, PI)、达峰时间(time to peak, TTP)、斜率(obliquity rate, OR)及曲线下面积(areas under curve, AUC)。
1.2.3 免疫组化 肿瘤组织蜡块行4µm厚度连续切片后行免疫组化染色。采用兔多克隆抗CD34抗体和抗CD34(北京中杉金桥生物技术有限公司)行免疫组化(SP法)。判定标准:MVD计数采用Weidner[4]报道的方法,被染成棕黄色的内皮细胞或内皮细胞簇,有或无管腔,只要与其他组织成分有区别,均作为1个微血管计数。连续观察5个高倍视野下的微血管数,取平均数作为MVD值。
1.3 统计学方法 采用SPSS 10.0软件,计量资料数据以±s 表示,采用t检验;两组间血流分级比较采用χ2检验,血流分级与MVD之间行Spearman等级相关分析,PI与MVD之间行Pearson相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 病理结果 55例乳腺癌患者中,浸润性导管癌46例,导管内癌4例,浸润性小叶癌2例,基底细胞样型癌1例,腺样囊性癌1例,化生性癌1例;27例良性肿瘤中,纤维腺瘤22例,腺病伴腺瘤形成4例,青春期腺瘤1例。
2.2 良恶性肿块CDFI表现 恶性组血流检出率高,血流丰富,且以Ⅱ~Ⅲ级为主;良性组血流检出率低,以0~Ⅰ级为主。恶性组血流丰富程度(图1B、2B)及PSV、RI(图1C、2C)均高于良性组,差异有统计学意义(P<0.05)。见表1。
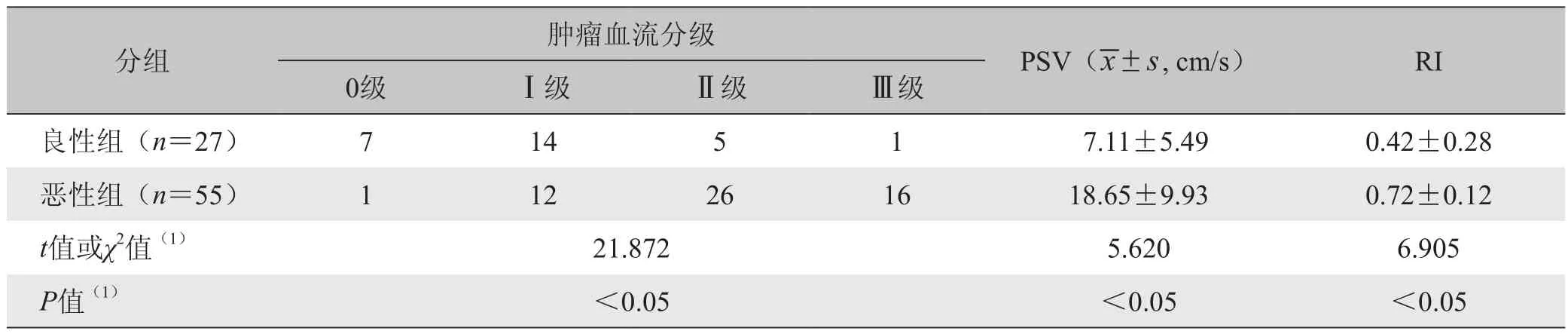
表1 乳腺良恶性肿瘤血流信号及参数比较
2.3 良恶性肿块超声造影表现 注入造影剂后,原肿瘤血流丰富区显著增强,原少血供区也有不同程度增强。良性组显示血流束细窄、平直(图1D),恶性组显示血流不规则,血管数量较多,但血管粗细不等(图2D)。TIC形态特征:良性组20例(74.1%)呈慢进快出型(图1E);恶性组43例(78.2%)呈快进慢出型(图2E)。恶性组造影灌注上升支陡直,下降支平缓,9例90s后仍较高,下降极慢;而良性组上升支缓慢。各型曲线在两组间存在部分重叠。恶性组PI、AUC均大于良性组,TTP小于良性组(P<0.05);两组OR差异无统计学意义(P>0.05)。见表2。
表2 乳腺肿瘤超声造影时间-信号强度曲线定量参数比较(±s )
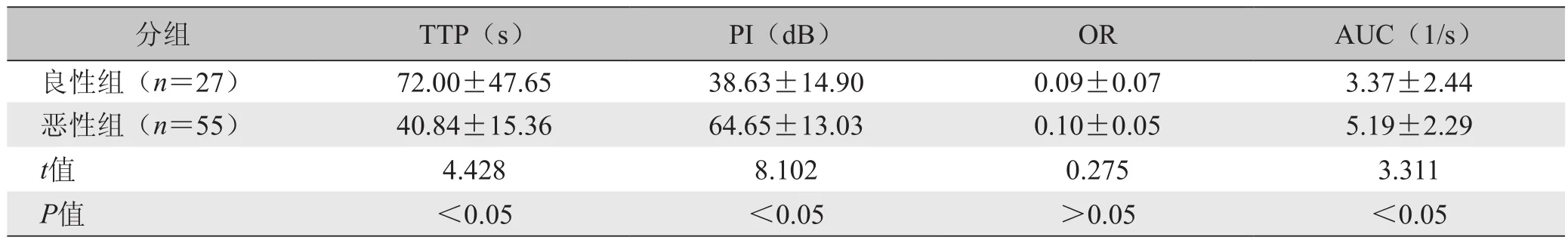
表2 乳腺肿瘤超声造影时间-信号强度曲线定量参数比较(±s )
注:TTP:达峰时间;PI:峰值强度;OR:斜率;AUC:曲线下面积
分组 TTP(s) PI(dB) OR AUC(1/s)良性组(n=27) 72.00±47.65 38.63±14.90 0.09±0.07 3.37±2.44恶性组(n=55) 40.84±15.36 64.65±13.03 0.10±0.05 5.19±2.29 t值 4.428 8.102 0.275 3.311 P值 <0.05 <0.05 >0.05 <0.05
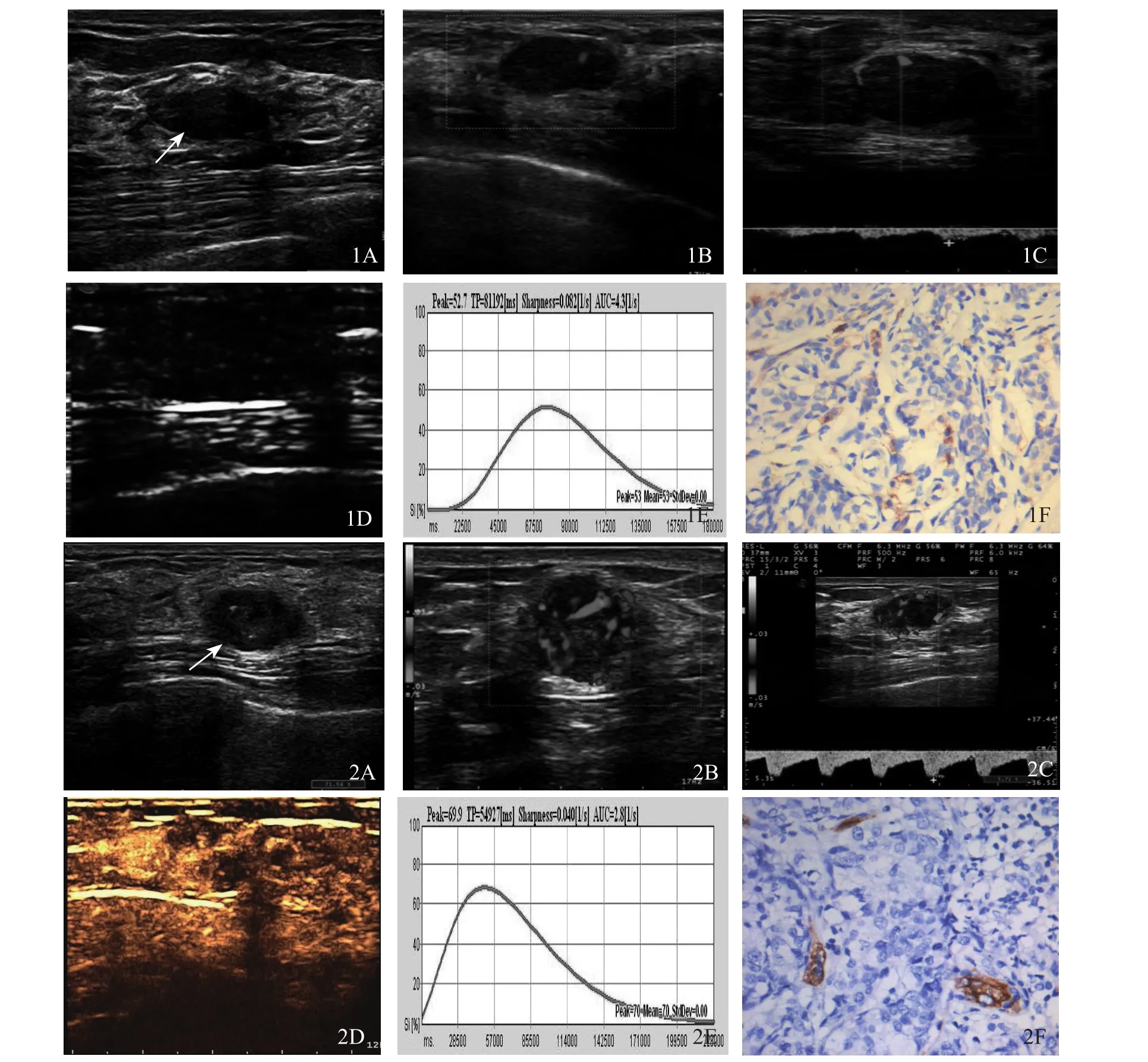
图1 A.右乳实性占位,边界清晰,包膜完整;B.血流Adler分级Ⅰ级;C.肿瘤内动脉血流频谱显示为低速低阻;D.超声造影显示肿瘤均匀性增强;E.时间-信号强度曲线表现为慢进快出;F.病理切片示CD34免疫组化染色(×200)。图2 A.左乳浸润性导管癌,肿块边界欠清,形态欠规则,内伴微钙化;B.血流Adler分级Ⅲ级;C.肿瘤内动脉血流频谱显示为高速高阻;D.超声造影显示肿瘤不均匀增强;E.时间-信号强度曲线表现为快进慢出;F.病理切片示CD34免疫组化染色(×200)
2.4 良恶性肿瘤微血管表达 恶性组肿瘤组织中CD34标记的MVD为(82.35±20.36)条/200倍视野,明显高于良性组的(23.56±10.70)条/200倍视野(图1F、2F),差异有统计学意义(P<0.001)。
2.5 MVD与CDFI血流分级的相关性 CDFI血流丰富程度与MVD呈正相关(r=0.456,P<0.01),MVD随血流分级升高而增加。
2.6 乳腺肿瘤MVD与CEUS造影参数的相关性 PI与CD34标记的MVD呈显著正相关(r=0.783,P<0.01)。
3 讨论
乳腺肿瘤生成新生血管是CDFI检测的病理学基础,血流等级是反映其血流丰富程度的重要超声指标,能够评价肿瘤血管分布情况、血管数量、性质及其血流动力学参数,为乳腺良恶性肿瘤鉴别诊断提供了更丰富的信息[5]。本研究中恶性组血流检出率和血流丰富程度显著高于良性组。乳腺肿块内动脉血流频谱特征反映了其小动脉水平的血流动力学改变,多数乳腺癌肿块见动脉血流穿入,脉冲多普勒检出高速高阻型动脉血流,与文献[6]报道基本一致。良性组多为静脉血流,动脉血流相对低速低阻;两组间有显著差异。
随着彩色多普勒技术的提高,CDFI对肿块内小血管及低速血流检测的敏感性也有较大提高,为临床无创评价肿瘤血管提供了有效方法。但它仅能显示小动静脉血流的相关信息,不能显示肿瘤微循环情况。Weidner提出的MVD测定是目前最常用的评价肿瘤血管生成的方法,已用于多种恶性肿瘤的预后评估。但这种方法是对术后病理组织标本进行免疫组化染色后的微血管计数,不能对术前肿瘤内血管作出无创在体的评价。而超声造影在肿瘤血流检测方面优势明显[7],可以显示肿瘤组织的微循环灌注情况,能更加客观地评估肿瘤血管的生成,其诊断的敏感性和特异性较高。
实时灰阶谐波超声造影技术是一种反映微循环血流灌注的新方法,其TIC上升支及下降支反映肿块内血管床微气泡流速和流量随时间变化的规律,峰值强度反映了进入肿块血管床的微气泡数总量;曲线下面积是流速、流量和时间三者的综合评价。关于CEUS TIC的研究国内外已有较多报道[7-12],但结果各异,定量指标不统一。江泉等[11]对32例乳腺肿块的研究显示,良性肿块的造影剂到达时间及达峰时间比恶性肿块长。方华等[12]对52例乳腺肿块的造影参数分析结果显示,恶性组斜率、第90秒增强比、峰值至90s曲线下面积及增强强度均高于良性组。本组中恶性组TIC多呈快进慢出型,而良性组多呈慢进快出型,参数特征与上述研究类似。罗葆明等[13]认为单一的病灶内部TIC分析,其峰值时间、峰值强度等受到造影剂剂量、注射速度、受检者全身因素如心功能状态、血管解剖是否存在变异等因素的影响,个体差异大。而通过比较病灶与周围组织的TIC参数的差值可能更有助于良恶性病变的鉴别诊断。这一观点与Balleyguier等[14]及Kook等[15]报道的结果相似。本研究发现,彩色血流取样、TIC分析时的病灶感兴趣区的选择、TIC分析软件的差异、受检者呼吸及其他原因导致的探头切面移位等因素均可能导致结果差异,有待进一步规范提高。
本研究中恶性组CD34标记的微血管计数明显高于良性组,其原因考虑为肿瘤微血管生成增多导致肿瘤细胞周围MVD升高,说明MVD与肿瘤生长密切相关。本研究结果显示,CEUS时TIC中的PI及CDFI时血流Adler分级与MVD呈显著正相关,其产生机制可能为:恶性肿瘤细胞浸润破坏正常血管,肿瘤细胞分泌血管生长因子,诱导肿瘤新生血管形成,使肿块血管增多,血流量增加;但新生血管壁薄、缺乏肌层,弹性差,从而造成血流灌注早期流量大、流速快,TIC形态表现为上升支陡直,达峰时间短,峰值强度高。血流频谱形态表现为恶性肿块的峰值流速明显高于良性肿块。同时恶性肿块内大量新生微血管,使微血管密度增加,细小动脉增多、走向不规则,丰富的血管吻合形成动静脉瘘;部分静脉血管内癌栓使静脉回流受阻等因素造成血流紊乱,表现在血流频谱形态上的改变为:舒张期血流快速下降,血流持续时间短,甚至血流中断或湍流。在TIC上表现为造影剂持续时间长,曲线下面积明显高于良性肿块。乳腺纤维腺瘤等良性肿块内部血管主要是正常血管的增生、有正常的静脉回流,因此频谱多普勒表现为PSV较低、舒张期流速降幅较小(RI多<0.7);TIC上表现为上升支平缓,峰值强度及曲线下面积偏小。
综上所述,超声造影技术分析TIC形态及定量参数,能实时在体定量评价乳腺肿瘤的血管生成,为临床肿瘤早期诊断提供了更多信息,可以作为乳腺肿瘤的高频彩超及钼靶检查后的有效补充。
[1]Schneider BP, Miller KD. Angiogenesis of breast cancer. J Clin Oncol, 2005, 23(8): 1782-1790.
[2]Svagzdys S, Lesauskaite V, Pavalkis D, et al. Microvessel density as new prognostic marker after radiotherapy in rectal cancer. BMC Cancer, 2009, 95: 1-8.
[3]Adler DD, Carson PL, Rubin JM, et al. Doppler ultrasound color fl ow imaging in the study of breast cancer: preliminary fi nding. Ultrasound Med Biol,1990,16(6): 553-559.
[4]Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors. J Breast Cancer Res Treat, 1995,36(2): 169-180.
[5]孙霞,牟荣骥,刘书海,等.肿瘤血管阻力指数和内径在乳腺良、恶性肿瘤鉴别中的应用.中国医学影像学杂志,2010, 18(3): 201-204.
[6]张清.超声诊断乳腺癌. 上海医学影像,2008,17(3): 249-250.
[7]李颖嘉,文戈,何洁.超声造影对乳腺良、恶性病变及其相关预后评价的研究进展.中国医学影像学杂志,2011, 19(2): 155-157.
[8]肖炜袆,郭庆禄,罗葆明,等.超声造影结合时间-强度曲线在乳腺肿块鉴别诊断中的应用.影像诊断与介入放射学, 2007, 16(5): 211-214.
[9]Zhao H, Xu R, Ouyang Q, et al. Contrast-enhanced ultrasound is helpful in the differentiation of malignant and benign breast lesions. E J Radiol, 2010, 73(2): 288-293.
[10]杜晶,李凤华,方华,等.超声造影微血管成像评估乳腺肿瘤血管形态及分布特征.中华超声影像学杂志, 2007,16(9): 773-776.
[11]江泉,张渊,张婉莹,等.实时超声造影成像在乳腺良恶性肿块中的应用.上海医学影像, 2007, 16(4): 273-275.
[12]方华,李凤华,夏建国,等.实时灰阶超声造影在乳腺肿瘤诊断中的应用研究.中国超声医学杂志, 2007, 23(6):423-425.
[13]罗葆明,肖伟炜,郭庆禄, 等. 乳腺肿块超声造影及时间-强度曲线分析再探讨.中国超声医学杂志, 2008, 24(3):216-218.
[14]Balleyguier C, Opolon P, Mathieu MC, et al. New potential and applications of contrast-enhanced ultrasound of the breast: own investigations and review of the literature. Eur J Radiol, 2009, 69(1): 14-23.
[15]Kook SH, Kwag HJ. Value of contrast-enhanced power Doppler sonography using a microbubble echo-enhancing agent in evaluation of small breast lesions. J Clin Ultrasound, 2003, 31(5): 227-238.

