瘦素受体基因多态性与急性胰腺炎的相关性
郭继文 李德强
瘦素(leptin)为肥胖(OB)基因的表达产物,是一种由167个氨基酸组成的分泌性蛋白质类激素,主要由脂肪细胞分泌。研究发现,瘦素与急性胰腺炎(AP)之间有密切关系,瘦素通过作用于瘦素受体(LEPR)而发挥作用。本研究运用多聚酶链反应一限制性片段长度多态性(PCR-RFLP)技术检测LEPR A668 g位点和G3057A位点基因多态性,探讨LEPR基因多态性与AP的关系,为AP的防治提供理论依据。
1 资料与方法
1.1 一般资料 本组患者46例,其中男27例,女19例,年龄18~75岁,平均53.7岁。其中胰管狭窄、胰管结石者11例,胆道感染及胆石症23例,暴饮暴食者7例,不明原因者5例。患者临床症状有不同程度的腹痛,呈绞痛、刀割样痛或钝痛;发热23例,平均体温为38.6℃;伴有不同程度腹胀、恶心、呕吐者32例;并发低钾血症29例;重症急性胰腺炎1例,有反跳痛及腹肌紧张表现,全腹有明显压痛,伴有血性腹水,可触及明显压块。所有患者均经B超、腹部平片、血淀粉酶检查明确诊断。对照组45例为同期体检科正常体检者。两组间一般情况比较见表1,两组间TC、TG及血糖水平差异有统计学意义。
1.2 方法
1.2.1 LEPR基因检测方法 ①DNA提取:取入组者外周血0.5 ml,2%EDTA抗凝,按Axygen试剂盒说明提取DNA。②LEPR 引物设计:参照文献[1]:5'-ACCCTTTAAGCTGGGTGTCCCAATAG-3';5'-GCTAGCAAATATTTTTGTAAGCAATT-3”。③PCR 扩增:PCR 反应体系体积为 30 μl,2 μl DNA,2 mmol/L NTP 2 μl,引物 P1 40 pmol/L,引物 P2 40 pmol/L,10 × PCR 缓冲液3ul,2.5U Taq聚合酶。PCR反应条件:94℃预变性5 min,94℃ 50s,61℃ 60s,72℃ 90s,共 35 个循环。④RFLP 分析:A668 g、G3057A内切酶消化产物:取22 μl PCR产物,10×Buffer3 ul,H2O 1.5 μl,内切酶10U,37℃水浴过夜;取 20 ul酶切产物加入琼脂糖凝胶负极端的加样孔,以溴酚蓝为指示剂,溴化乙锭为染色剂,在150伏电压下电泳30 min,在300 mm紫外线灯下观察带型。A668 g位点共有3种基因型:GG为纯合子突变型(300bp、140bp),GA 为杂合子(440bp、300 bp、140bp),AA为纯合子野生型(440 bp);G3057A位点也有3种基因型:AA为纯合子突变型(253bp),GA为杂合子(253bp、221bp、32bp),GG 为纯合子野生型(32bp、221bp)。
1.2.2 统计学方法 应用统计SPSS 13.0软件,基因型和等位基因频率采用基因计数法,组间率的比较用R×C表χ2检验。
2 结果
2.1 LEPR基因多态性结果两组间基因型GG、GA、AA的观察值和期望值Hardy-Weinberg平衡吻合度良好(P>0.05),符合Hardy-Weinberg平衡定律,提示个体间无血缘关系。
2.2 两组A668 g、G3057A基因型及等位基因分布频率见表2。A668 g、G3057A基因型及A668 g等位基因频率在AP组和对照组间差异无统计学意义;G3057A等位基因A在对照组的分布频率低于AP组,差异有统计学意义。
2.3 LEPR基因型对血脂水平的影响LEPR A668 g位AG基因型携带者与GG基因型携带者血浆TG和TC水平差异无统计学意义。LEPR G3057A位不同基因型携带者的血浆血脂水平差异亦无统计学意义(均P>0.05),见表3。

表1 两组间一般情况比较

表2 两组A668G、G3057A基因型及等位基因分布频率
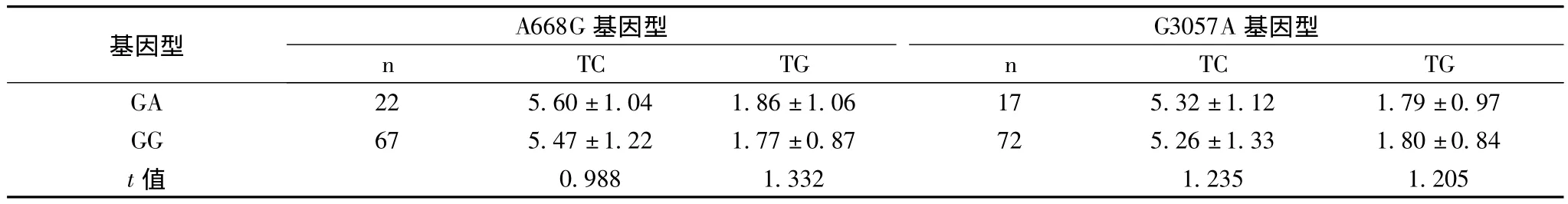
表3 LEPR A668 g、G3057A基因型与血脂的关系(mmol/L)
3 讨论
瘦素是肥胖基因编码的脂源性激素,由脂肪细胞等合成后分泌入血,与特异的运输蛋白结合,通过血脑屏障作用于下丘脑的瘦素受体,或直接作用于靶细胞的瘦素受体而发挥作用,其受体后机制是通过JAK-STAT信号转导途径实现的,主要活化JAK2-STAT3途径,在特定基因启动子区域发挥作用,调节靶基因转录[2,3]。瘦素具有广泛的生物学效应,近年国外研究表明[4],胰腺存在瘦素受体,瘦素与AP之间有密切关系,AP时炎症诱导局部瘦素表达增高,给予外源性瘦素预处理胰腺组织瘦素受体表达亦升高。肥胖者AP预后差,可能与其存在的瘦素抵抗有关。给予外源性瘦素后的受体表达上调及受体激活可能缓解瘦素抵抗,从而保护肥胖症AP患者的胰腺。AP时机体处于高度应激状态[5],体内应激激素分泌增加,如糖皮质激素、儿茶酚胺水平升高。糖皮质激素是瘦素分泌的强烈刺激物,诱导体循环瘦素水平升高,而升高的瘦素又对糖皮质激素起负反馈调节,可抑制应激激素的失控反应,因而瘦素可能具有改善AP预后的作用。由于瘦素必须通过与瘦素受体的结合才可以发挥其生理功能,因而许多学者推测瘦素受体基因的变异可能影响瘦素功能的发挥,并与血压的变化有关。目前已在LEPR基因20个外显子中发现了19种基因多态现象,但关于该基因变异与AP发病的关系报道结果不一。
本课题对瘦素受体基因Gln223Arg、PRO1019Pro多态性与AP的相关性进行了初步探讨。Gln223Arg突变即基因编码区第6外显子668位核苷酸由A变异为G,使编码第223位的谷氨酰胺(Gln)变为精氛酸(Arg);PRO1019pro为一沉默突变,基因编码区第20外显子3057位核苷酸由G变异为A,仍编码脯氨酸(Pro)。
本组研究显示AP组和对照组A668 g、G3057A基因型及A668 g等位基因频率在AP组和对照组间差异无统计学意义;G3057A等位基因A在对照的分布频率为8.89%,AP组14.13%,差异有统计学意义(χ2=6.544,P<0.05)。从表3可以看出不同基因携带者在血脂水平差异上亦无统计学意义。
本研究结果提示AP与LEPR基因型频率分布无明显相关性,而G3057A等位基因A可能与AP的发病相关。由于遗传机制比较复杂,一个基因多态性的表达是通过一个或一些与此多态性连锁不平衡的其他的多态性的效应联合发挥作用。并且AP的发生还受到地理条件、人的种族、生存环境等诸多因素的影响。目前有关AP与瘦素受体基因多态性关系的研究较为少见,这个基因变异是否与AP发病有密切的关系尚需大样本、多地域、多民族广泛深入的协同研究。
[1] Kang SM,Kwon HM,Hong BK,et al.ExPression of lePtin reeePtor(Ob-R)in human atheroselerotic lesion:Potential role inintimal neovaseularization.Yonsei Medieal J,2000,41:68-72.
[2] KitaA,Uotani S,Kuwahara H,et al.Vanadate enhances leptin-induced activation of JAK/STAT pathway in CHO cells.BiochemBiophysResCommun,2003,302:805-809.
[3] Hegyi K,Fulop K,Kovacs K,et al.Leptin-induced signaltransduction pathways.CellBiol Int,2004,28:159-169.
[4] Jaworek J,Bonior J,Konturek SJ,et al.Role of leptin in the controlof postprandial pancreatic enzyme secretion.J Physiol Pharmacol,2003,54:591-602.
[5] Warzecha Z,DembinskiA,Ceranowicz P,et al.Influence of leptin administration on the course ofacute ischemic pancreatitis.J Physiol Pharmacol,2002,53(4 Pt2):775-790.

