细胞抗氧化活性方法在食物抗氧化活性评价中的研究进展
夏春燕,郭晓晖,李富华,陈 龙,赵国华,2,明 建,2,3,*
细胞抗氧化活性方法在食物抗氧化活性评价中的研究进展
夏春燕1,郭晓晖1,李富华1,陈 龙1,赵国华1,2,明 建1,2,3,*
(1.西南大学食品科学学院,重庆 400715; 2.西南大学 国家食品科学与工程实验教学中心,重庆 400715;3.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
由体内过剩自由基引起的心脑血管疾病和癌症病人日渐增加,通过抗氧化物质的作用清除体内过量的自由基是减少此类疾病发生的最主要而有效的方法。大量研究证实,植物化学物质具有显著的抗氧化作用,这些物质的最好来源是水果、蔬菜和谷物等,其在体内的抗氧化效果及活性评价是当前功能食品研究的热点。细胞抗氧化活性(CAA)测定方法是目前建立起的能有效预测植物化学物质在生物系统中抗氧化活性的评价方法,被广泛用于食物中抗氧化活性物质的功能评价。本文综述国内外关于CAA测定方法及其在抗氧化功能食品评价中的研究进展。
细胞抗氧化活性;果蔬;谷物
由于抗氧化物质与促氧化物质的平衡失调而导致机体细胞长期处于氧化应激状态,这种失调会导致细胞内大分子物质(如蛋白质、脂质、糖类、DNA)的积累性氧化损伤,加速人体细胞的衰老或病变。有研究[1]总结了体内氧化应激是诱导多种慢性疾病(心血管疾病和癌症等)发生、发展的主要机制:体内(尤其是血液中)所载细胞外脂类物质被自由基氧化后,产生有毒性的氧化产物干扰细胞正常功能,从而引发炎症(inflammation),导致各种慢性疾病的发生。如心脏病是由高含量的低密度脂蛋白(LDL)导致高发生率的胆固醇氧化,产生高含量的胆固醇氧化产物改变了胆固醇新陈代谢有关细胞的功能,从而导致心血管板块的形成。而流行病学研究证实,经常摄入富含抗氧化物质的食物(如果蔬、谷物等)可有效降低慢性疾病的发病几率[2-4]。
食物抗氧化是指食物中的抗氧化活性成分(如多酚类植物化学物质及VA、VE、VC等)清除体内过多自由基或抑制自由基活动的作用。为了评价该作用的大小(即抗氧化活性的强弱),研究者不断建立起多种食物抗氧化的化学评价方法,这些体外的化学模型是评价植物化学氧化功能抑制体内毒性氧化产物和炎症的一个重要指标。但已有的大部分研究中,反应介质通常只是针对某一类的植物化学物质的理化特性(如水溶性或脂溶性)做出抗氧化能力测定,而且不以易被自由基氧化与疾病密切相关的脂类为参照底物,所以结果很难与人体实际情况相比拟。最新研究用水脂乳状液模拟人体生理体液作为化学模型介质,加自由基诱导胆固醇和脂肪酸氧化,很好地解决了这两个问题,从而更可靠地判断各类植物化学物质(如酚类化合物)的体内抗氧化和抗炎症能力[5]。为了更能反映食物抗氧化剂在生理条件、细胞或体内产生的效应,应用细胞为基础的抗氧化活性评价方法,如抗癌细胞增殖实验,逐步得到采用。美国康奈尔大学刘瑞海教授率先建立了细胞抗氧化活性(cellular antioxidant activity,CAA)评价方法[6]。CAA方法以人体肝癌细胞HepG-2为实验模型,观察抗氧化物质在细胞中的反应情况,如抗氧化成分在细胞内的生物利用率、吸收和代谢情况,比传统的化学方法更具有生物相关性,比动物模型和临床研究更经济、快捷,该方法的建立被认为是抗氧化剂研究方法中的革命。
1 细胞抗氧化活性方法的建立
20世纪90年代中期,随着纯化合物、食物和膳食补充剂的总抗氧化活性测定方法的建立,抗氧化活性评价方法得到了广泛应用。抗氧化活性的评价方法分为体内(动物实验)和体外(化学分析法)方法,后者主要包括Trolox当量的抗氧化能力(trolox equivalent antioxidant capacity,TEAC)[7]、总氧自由基清除能力(total oxyradical scavenging capacity,TOSC)[8]、总自由基捕获抗氧化参数 (total radical-trapping antioxidant parameter,TRAP)[9]、1,1-二苯基-2-三硝基苯肼(DPPH)[10]、羟自由基清除能力(peroxyl radical scavenging capacity,PSC)[11]和氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)[12]等方法。这些方法在食物抗氧化活性评价中起到了非常重要的作用,但同时也存在一些缺陷:如DPPH方法易受光强度、氧浓度、溶剂类型[13]等条件影响,某些被测物与DPPH存在光谱重叠和反应可逆现象[14];凡是能生成电子且电势低于氧化还原对Fe(III)/Fe(II)的非抗氧化剂会影响FRAP方法的测定结果,某些抗氧化物质(如体内重要的抗氧化剂谷胱甘肽)不能还原Fe(III),导致被测物质抗氧化活性被低估;TEAC法中产生的自由基不稳定,将低估抗氧化能力;ORAC方法的荧光指示剂对pH值敏感,pH<7时荧光强度显著降低[15]。

表1 细胞生物方法测定食品抗氧化活性的原理和应用Table 1 Principle and application of cell-based bioassays for food antioxidant activity
食物中往往含有多种抗氧化成分,不同的膳食成分之间会发生附加和协同效应[16],化学方法通常只适用于几种单一化学物质抗氧化活性的比较,难以评价整个食物的抗氧化效果;由于抗氧化活性物质往往会受到体内环境(如温度、pH值、微生物等)的影响,其生物利用率和代谢又是研究抗氧化作用效果的重要问题[17](食物抗氧化成分之间的相互作用及食品加工等条件对其生物利用率有影响,且各成分消化吸收后的形式和活性都可能发生改变,导致最终表现出的总抗氧化活性也改变)。并且,化学抗氧化方法仅关注食物的抗氧化值,而没有考虑到抗氧化成分在细胞内的生物利用率、吸收和代谢等情况,因此不能反映细胞生理条件[18];此外,抗氧化剂的作用机理在预防疾病和促进健康的过程中远不止是清除自由基,它还可通过抑制自由基产生或提高内源性抗氧化物质的水平来达到抗氧化效果,因而试管内进行的抗氧化实验是非常单一的;动物模型和临床研究是评估抗氧化剂体内实际效果较好的方法,但它们既昂贵又耗时,不适于大批量检样的初筛操作。于是一种新的抗氧化活性评价方法——基于细胞的生物方法,即CAA方法被建立起来并得到广泛的应用和发展。
Eberhardt等[19-20]较早应用细胞培养来测定物质的抗细胞增殖活性,CAA实验将抗氧化活性的评价提升到一个新的水平,是抗氧化研究领域的突破。继CAA方法建立后,许多研究小组在CAA方法的基础上建立了其他细胞模型(如Caco-2、RBC、AGS)的抗氧化活性评价方法,使细胞抗氧化方法得到丰富和发展,常用的测定食物中抗氧化活性的细胞生物方法主要有4种,其原理和应用见表1。
2 细胞抗氧化的原理与测定方法
2.1 CAA方法的基本原理

图1 CAA方法原理[6]Fig.1 Principle of cellular antioxidant activity assay[6]
CAA方法的基本原理如图1所示。细胞用抗氧化剂混合物(AOx)或水果提取物以及本身无荧光的指示剂混合物2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)预处理,抗氧化剂结合在细胞膜上并通过细胞膜进入细胞,DCFH-DA穿过细胞膜进入细胞内,细胞酯酶分解DCFH-DA形成极性更强的还原型二氯荧光素 (DCFH)。然后用2,2,-偶氮二异丁基脒二盐酸盐 (ABAP)处理细胞,ABAP分散在细胞中并自发分解形成过氧化自由基ROO*,这些过氧化自由基攻击细胞膜产生更多自由基或活性氧(ROS*)。细胞内的DCFH极易被氧自由基或活性氧氧化成荧光物氧化型二氯荧光素 (DCH),荧光物DCH可通过分光光度法测定。抗氧化剂可在细胞膜外部结合氧自由基而阻止其进入细胞,或者在细胞膜内部与ROS*和ROO*结合而阻断DCFH氧化成DCF的过程,从而减少DCF的形成。CAA方法测定抗氧化剂阻止人体HepG-2癌细胞中ABAP产生的氧自由基导致DFC形成的能力,与对照组相比,细胞荧光物质的减少量就能反映该化合物的抗氧化能力。
2.2 CAA的操作方法
根据文献[6,32-33],总结了CAA的操作方法如下:测定前对肝癌细胞HepG-2进行传代培养,VE培养基添加5%牛胎血清(PBS)、10mmol/L羟乙基哌嗪乙硫磺酸、2mmol/L L-谷氨酰胺、5μg/mL胰岛素、0.05μg/mL皮质醇、50μg/mL青霉素、50μg/mL链霉素和100μg/mL庆大霉素,于37℃、5% CO2且具有较高湿度条件下培养,培养基每2~3d更换一次。
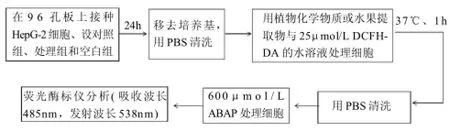
图2 CAA方法流程图Fig.2 Flow chart of cellular antioxidant activity assay
CAA方法流程如图2所示,HepG-2细胞在96孔板上按6×104个/孔的密度接种,接种24h后除去培养基,用100μL PBS洗涤一次。用100μL含有不同浓度抗氧化物与25μmol/L DCFH-DA的溶液处理1h(37℃)。然后去除DCFH-DA,用100μL PBS洗涤一次。再用100μL 600μmol/L ABAP处理,最后用荧光酶标仪(538nm)每5min测一次荧光值,持续1h。每个平板上对照组用DCFH-DA和ABAP处理,空白组只用DCFH-DA处理。经过空白调零和荧光度初值调零后,可谱出荧光值随时间的变化曲线,由曲线下的面积便可计算出抗氧化物质的CAA值,计算公式为CAA unit=1-(∫SA/∫CA)。式中:∫SA为样品荧光值相对于时间曲线下的完整面积;∫CA为对照组曲线下的完整面积。
CAA实验中将槲皮素作为标准物,纯植物化学物质的CAA值以mmol QE(槲皮素当量)/100μmol化合物表示,食物提取物的CAA值以mmol QE/100g食物表示。研究发现,CAA值与被测样品的总酚含量紧密相关,CAA值可用于准确地反映总酚含量[6,34]。另外,CAA值可由EC50(半数有效量)按每100μmol纯植物化学物质或100g样品含多少μmol QE转换而来,EC50越小,CAA值越高,抗氧化活性则越好。
3 细胞抗氧化方法的应用
细胞抗氧化测定方法往往通过抗细胞增殖能力来反映其体内抗氧化效果,主要用于食物如果蔬、谷物、豆类和纯植物化学物质等的抗氧化活性的评价。
果蔬抗氧化活性成分是当前科学研究的热点,国外研究者相继从多种果蔬中提取并鉴定出抗氧化成分,并测定其抗氧化能力。Eberhardt等[20]对苹果抑制Caco-2和HepG-2细胞增殖的能力进行了研究,结果表明,带皮和去皮的苹果水提物质量浓度各为50mg/mL时,对Caco-2的抑制率分别为(43±1)%和(29±4.1)%,对HepG-2的抑制率分别为(57±0.21)%和(40±0.64)%,说明带皮苹果的提取物较去皮苹果的提取物抑制癌细胞增殖的能力强。进一步研究[35-38]表明,苹果皮的提取物比苹果果肉提取物抑制癌细胞增殖的能力更强,比较4个苹果品种(Rome Beauty、Idared、Cortland、Golden Delicious)发现,Rome Beauty苹果果皮提取物质量浓度在(12.4± 0.4)mg/mL时,能抑制50%的HepG-2细胞生长,具有相对较高的抑制癌细胞增殖能力[39]。Meyers等[40]研究发现,草莓的抗细胞增殖能力仅次于苹果,8个不同品种的草莓提取物质量浓度各为50mg/mL时,对HepG-2癌细胞的抑制率分别为:Earliglow(8 9.1±0.9)%、Evangeline(88.7±0.7)%、Sable(86.1±5.0)%、Jewel (83.2±2.7)%、Sparkle(78.5±3.3)%、Mesabi(76.4± 1.7)%、Allstar(72.2±2.2)%、Annapolis(68.2±0.0)%。常见水果中,蔓越橘、柠檬、苹果、草莓、葡萄、香蕉、桃子对HepG-2细胞增殖抑制的EC50值依次增加,即抑制细胞增殖的能力依次减弱[41];常见蔬菜中,菠菜、大白菜、红辣椒、洋葱、花椰菜、土豆和甜菜的EC50值依次增加,即抑制HepG-2细胞增殖的能力依次减弱[42]。大量实验证实,被测物的提取浓度与抑制细胞增殖的能力是存在剂量-效应关系的,浓度越大,抗增殖能力越强。Wolfe[33]、Song Wei[34]等测定了几十种常见果蔬提取物的抗氧化活性,发现两种不同处理方法(不用PBS和用PBS)测得苹果的CAA值分别为(21.9± 4.0)μmol QE/100g和(17.2±2.0)μmol QE/100g,野生蓝莓的CAA值分别为(292±11)μmol QE/100g和(74.1± 12.5)μmol QE/100g。浆果类一般具有较高的CAA值,如野生蓝莓、草莓、黑莓、树莓等,而瓜果类的CAA值较低,如哈密瓜等。蔬菜中则是甜菜、花椰菜和红辣椒的CAA值较高。CAA值高低与总酚含量是密切相关的。
谷物中也含有酚酸、黄酮、单宁等酚类化合物,含量和种类与果蔬中的相当,与果蔬不同的是谷物中的酚大多是结合酚,很多实验都证明谷物如有色稻米等具有抗氧化活性[43]。研究发现,米糠提取物对细胞HL-60和MOL-4的IC50值分别为2.3mg/kg和2.8mg/kg[44]。Hu Chun等[21]用RAW264.7细胞系证明了深蓝色粒小麦的麦麸能使H2O2自由基氧化产生的荧光迅速减少,且存在剂量-效应关系。
CAA方法用于评价纯植物化学物质的抗氧化活性时发现:具有3,,4,-O-二羟基、2,3双键结合的4-酮基、3-羟基结构的类黄酮具有较高的CAA值[45];不同纯植物化学物质中,槲皮素的CAA值最高,山奈酚、表没食子儿茶素没食子酸酯(EGCG)、杨梅酮、木犀草素次之[6]。以Wolfe等[45]的CAA方法以及Honzel等[46]的基于人体血红细胞的CAP-e方法(cell-based antioxidant protection assay utilising erythrocytes)为基础,Blasa等[31]建立了CAA-RBC方法(cellular antioxidant activity utilising red blood cells),用该方法对各种纯黄酮类物质进行分析,发现异鼠李素、杨梅酮、山奈酚表现出较高细胞抗氧化活性,而木犀草素、EGCG、白藜芦醇、芹菜素和儿茶素表现出较低活性,与上述CAA方法的结果有一定差异。
此外,CAA方法在豆类[47]、咖啡[48]、茶叶(茶多酚)[49]等提取物的细胞抗氧化活性研究中也有应用。
4 结 语
细胞抗氧化实验反映了抗氧化物质在细胞内的吸收、代谢和分布等方面,比化学抗氧化方法更具有生物相关性,能更好地预测物质在体内的抗氧化活性,目前被广泛用于果蔬等食物细胞抗氧化活性的评价。细胞抗氧化实验在评估其他各种抗氧化剂、具有抗氧化活性的食物和膳食补充剂上具有广阔的应用前景。
细胞抗氧化实验也面临着一些挑战。Girard-Lalancette等[29]实验证明,大多数果蔬汁提取物(如胡萝卜、花椰菜、桃子、草莓、蓝莓)在质量浓度大于6.25mg/mL时能显著增加DCF荧光的猝灭,因此测定物质抗氧化活性之前要先测定其对荧光的猝灭作用,否则不能准确评估抗氧化剂清除自由基的能力。实验过程中,细胞用DCFH处理之前一般先用不含DCFH的溶液处理,因而细胞内的DCFH、DCF水平降低了,反之,细胞外的水平则增加了,这将在一定程度上影响实验结果。细胞模型介质中很多对脂溶性植物化学不相溶的,一般都需要用二巯甲基过渡,因引入了不必要的干扰物质,影响了实验结果,所以对照的做法很重要。CAA值与总酚或总抗氧化活性具有较强的相关性,比ORAC值更能预测总酚的含量,但体外细胞培养模式并不能完全代表抗氧化物质在生物体内的代谢和作用情况,因为不是任何植物化学物质经消化后都能被吸收进入人体肝脏细胞或到达上述的有关细胞,所以大部分细胞抗氧化实验直接用提取物做细胞模型可能与人体的摄入含植物化学物质的食物后的实际情况有很大差别,一般先要经人体各种消化酶和消化条件降解后,或肠胃细菌酵解后再做细胞模型测试结果相对可靠。因此细胞抗氧化实验面临的最大挑战就是将CAA的结果与体内方法(动物实验)的结果相联系,判断其是否能预测体内实验的结果。
[1]XU Lijia, HOWARD L R, XU Zhimin. Analysis of antioxidant-rich phytochemicals[M]. New York: John Wiley & Sons Inc, 2012: 3-4.
[2]HERTOG M G, BUENO-de-MESQUITA H B, FEHILY A M, et al. Fruit and vegetable consumption and cancer mortality in the caerphilly study[J]. Cancer Epidemiology Biomarkers and Prevention, 1996, 5(9): 673-677.
[3]DJURIC Z, DEPPER J B, UHLEY V, et al. Oxidative DNA damage levels in blood from women at high risk for breast cancer are associated with dietary intakes of meats, vegetables, and fruits[J]. Journal of the American Dietetic Association, 1998, 98(5): 524- 528.
[4]JOSHIPURA K J, HU F B, MANSON J E, et al. The effect of fruit and vegetable intake on risk for coronary heart disease[J]. Annals of Internal Medicine, 2001, 134(12): 1106-1114.
[5]TIAN L, WANG H, ABDALLAH A M, et al. Red and white wines inhibit cholesterol oxidation induced by free radicals[J]. Journal of Agricultural and Food Chemistry, 2011, 59(12): 6453-6458.
[6]WOLFE K L, LIU Ruihai. Cellular antioxidant activity (CAA) assay for assessing antioxidants, foods, and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 8896-8907.
[7]MILLER N J, RICE-EVANS C, DAVIES M J, et al. A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates[J]. Clinical Science, 1993, 84 (4): 407-412.
[8]WINSTON G W, REGOLI F, DUGAS A J, Jr, et al. A rapid gas chromatographic assay for determining oxyradical scavenging capacity of antioxidants and biological fluids[J]. Free Radical Biology and Medicine, 1998, 24(3): 480-493.
[9]GHISELLI A, SERAFINI M, MAIANI G, et al. A fluorescence-based method for measuring total plasma antioxidant capability[J]. Free Radical Biology and Medicine, 1995, 18(1): 29-36.
[10]BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology, 1995, 28(1): 25-30.
[11]ADOM K K, LIU Ruihai. Rapid peroxyl radical scavenging capacity (PSC) assay for assessing both hydrophilic and lipophilic antioxidants [J]. Journal of Agricultural and Food Chemistry, 2005, 53(17): 6572-6580.
[12]CAO Guohua, ALESSIO H M, CUTLER R G. Oxygen-radical absorbance capacity assay for antioxidants[J]. Free Radical Biology and Medicine, 1993, 14(3): 303-311.
[13]APAK R,K, DEMIRATA B, et al. Comparative evaluation of various total antioxidant capacity assays applied to phenolic compounds with the CUPRAC assay[J]. Molecules, 2007, 12(7): 1496-1547.
[14]HUANG D J, OU B X, PRIOR R L. The chemistry behind antioxidant capacity assays[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 1841-1856.
[15]KARADAG A, OZCELIK B, SANER S. Review of methods to determine antioxidant capacities[J]. Food Analytical Methods, 2009, 2(1): 41-60.
[16]LIU Ruihai. Health benefits of fruit and vegetables are from additive and synergistic combinations of phytochemicals[J]. The American Journal of Clinical Nutrition, 2003, 78(3): 517S-520S.
[17]LIU Ruihai, FINLEY J. Potential cell culture models for antioxidant research[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 4311- 4314.
[18]MERMELSTEIN N H. Determining antioxidant activity[J]. Food Technology, 2008, 11: 63-66.
[19]EBERHARDT M V, KOBIRA K, KECK A S, et al. Correlation analyses of phytochemical composition, chemical, and cellular measures of antioxidant activity of broccoli (Brassica oleracea L. Var. italica)[J]. Journal of Agricultural and Food Chemistry, 2005, 53(19): 7421-7431. [20]EBERHARDT M V, LEE C Y, LIU Ruihai. Nutrition: antioxidant activity of fresh apples[J]. Nature, 2000, 405: 903-904.
[21]HU Chun, CAI Yizhong, LI Wende, et al. Anthocyanin characterization and bioactivity assessment of a dark blue grained wheat (Triticum aestivum L. cv. Hedong Wumai) extract[J]. Food Chemistry, 2007, 104 (3): 955-961.
[22]HEO H J, CHOI S J, CHOI S G, et al. Effects of banana, orange, and apple on oxidative stress-induced neurotoxicity in PC12 cells[J]. Journal of Food Science, 2008, 73(2): 28-32.
[23]KHONKARN R, OKONOGI S, AMPASAVATE C, et al. Investigation of fruit peel extracts as sources for compounds with antioxidant and antiproliferative activities against human cell lines[J]. Food and Chemical Toxicology, 2010, 48(8/9): 2122-2129.
[24]SERRA A T, MATIAS A A, FRADE R F M, et al. Characterization of traditional and exotic apple varieties from Portugal. Part 2: antioxidant and antiproliferative activities[J]. Journal of Functional Foods, 2010, 2 (1): 46-53.
[25]FUSI E, REBUCCI R, PECORINI C, et al. Alpha-tocopherol counteracts the cytotoxicity induced by ochratoxin A in primary porcine fibroblasts [J]. Toxins, 2010, 2(6): 1265-1278.
[26]GOYA L, MARTIN M A, RAMOS S, et al. A cell culture model for the assessment of the chemopreventive potential of dietary compounds[J]. Current Nutrition and Food Science, 2009, 5(1): 56-64.
[27]ELISIA I, HU C, POPOVICH D G, et al. Antioxidant assessment of an anthocyanin-enriched blackberry extract[J]. Food Chemistry, 2007, 101 (3): 1052-1058.
[28]JENSEN G S, WU X L, PATTERSON K M, et al. in vitro and in vivo antioxidant and anti-inflammatory capacities of an antioxidant-rich fruit and berry juice blend. Results of a pilot and randomized, double-blinded, placebo-controlled, crossover study[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8326-8333.
[29]GIRARD-LALANCETTE K, PICHETTE A, LEGAULT J. Sensitive cell-based assay using DCFH oxidation for the determination of pro-and antioxidant properties of compounds and mixtures: analysis of fruit andvegetable juices[J]. Food Chemistry, 2009, 115(2): 720-726.
[30]XU Baojun, CHANG S K C. Phenolic substance characterization and chemical and cell-based antioxidant activities of 11 lentils grown in the northern United States[J]. Journal of Agricultural and Food Chemistry, 2010, 58(3): 1509-1517.
[31]BLASA M, ANGELINO D, GENNARI L, et al. The cellular antioxidant activity in red blood cells (CAA-RBC): a new approach to bioavailability and synergy of phytochemicals and botanical extracts[J]. Food Chemistry, 2011, 125(2): 685-691.
[32]费洪新, 孙丽慧, 张涛, 等. 人肝癌HepG2细胞培养的体会[J]. 卫生职业教育, 2007, 25(8): 138-139.
[33]WOLFE K L, KANG Xinmei, HE Xiangjiu, et al. Cellular antioxidant activity of common fruits[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8418-8426.
[34]SONG Wei, DERITO C M, LIU M K, et al. Cellular antioxidant activity of common vegetables[J]. Journal of Agricultural and Food Chemistry, 2010, 58(11): 6621-6629.
[35]HE Xiangjiu, LIU Ruihai. Phytochemicals of apple peels: isolation, structure elucidation, and their antiproliferative and antioxidant activities [J]. Journal of Agricultural and Food Chemistry, 2008, 56(21): 9905-9910.
[36]YANG Jun, LIU Ruihai. Synergistic effect of apple extracts and quercetin 3-β-D-glucoside combination on antiproliferative activity in MCF-7 human breast cancer cells in vitro[J]. Journal of Agricultural and Food Chemistry, 2009, 57(18): 8581-8586.
[37]HE Xiangjiu, LIU Ruihai. Triterpenoids isolated from apple peels have potent antiproliferative activity and may be partially responsible for apple,s anticancer activity[J]. Journal of Agricultural and Food Chemistry, 2007, 55(11): 4366-4370.
[38]YOON H, LIU Ruihai. Effect of selected phytochemicals and apple extracts on NF-κB activation in human breast cancer MCF-7 cells [J]. Journal of Agricultural and Food Chemistry, 2007, 55(8): 3167-3173.
[39]WOLFE K, WU Xianzhong, LIU Ruihai. Antioxidant activity of apple peels[J]. Journal of Agricultural and Food Chemistry, 2003, 51(3): 609-614.
[40]MEYERS K J, WATKINS C B, PRITTS M P, et al. Antioxidant and antiproliferative activities of strawberries[J]. Journal of Agricultural and Food Chemistry, 2003, 51(23): 6887-6892.
[41]SUN Jie, CHU Yifang, WU Xianzhong, et al. Antioxidant and antiproliferative activities of common fruits[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7449-7454.
[42]CHU Yifang, SUN Jie, WU Xianzhong, et al. Antioxidant and antiproliferative activities of common vegetables[J]. Journal of Agricultural and Food Chemistry, 2002, 50(23): 6910-6916.
[43]ZHANG M W, ZHANG R F, ZHANG F X, et al. Phenolic profiles and antioxidant activity of black rice bran of different commercially available varieties[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 7580-7587.
[44]PARRADO J, MIRAMONTES E, JOVER M, et al. Preparation of a rice bran enzymatic extract with potential use as functional food[J]. Food Chemistry, 2006, 98(4): 742-748.
[45]WOLFE K L, LIU Ruihai. Structureactivity relationships of flavonoids in the cellular antioxidant activity assay[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8404-8411.
[46]HONZEL D, CARTER S G, REDMAN K A, et al. Comparison of chemical and cell-based antioxidant methods for evaluation of foods and natural products: generating multifaceted data by parallel testing using erythrocytes and polymorphonuclear cells[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8319-8325.
[47]XU Baojun, CHANG S K C. Reduction of antiproliferative capacities, cell-based antioxidant capacities and phytochemical contents of common beans and soybeans upon thermal processing[J]. Food Chemistry, 2011, 129(3): 974-981.
[48]CHU Yifang, CHEN Yumin, BLACK R M, et al. Type 2 diabetes-related bioactivities of coffee: assessment of antioxidant activity, NF-κB inhibition, and stimulation of glucose uptake[J]. Food Chemistry, 2011, 124(3): 914-920.
[49]HAN D H, JEONG J H, KIM J H. Anti-proliferative and apoptosis induction activity of green tea polyphenols on human promyelocytic leukemia HL-60 cells[J]. Anticancer Research, 2009, 29(4): 1417-1421.
Research Progress of Cellular Antioxidant Activity Assay for Antioxidant Evaluation of Foods
XIA Chun-yan1,GUO Xiao-hui1,LI Fu-hua1,CHEN Long1,ZHAO Guo-hua1,2,MING Jian1,2,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China;3. Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Preservation(Chongqing), Ministry of Agriculture, Chongqing 400715, China)
It is well known that increasing cardiovascular diseases and cancers were caused by excessive free radicals in vivo. Scavenging of excessive free radicals by antioxidants is one of the effective methods to reduce such diseases. Numerous studies have demonstrated that phytochemicals from fruits, vegetables and whole grains, possess strong antioxidant activity. Therefore, studies on antioxidant effects in vivo or antioxidant activity evaluation of these substances have become a hot topic in the field of functional foods. Cellular antioxidant activity (CAA) assay has been established and widely applied in antioxidant evaluation of functional foods, which can effectively predict the antioxidant activity of phytochemicals in biological system. In this paper, the current research progress of CAA in China and other countries and its application in antioxidant evaluation of functional foods are reviewed in this paper.
cellular antioxidant activity;fruits and vegetables;grains
TS201.2
A
1002-6630(2012)15-0297-06

