低剂量X线照射对诱导大鼠骨髓间充质干细胞成骨分化的影响
刘洪鹏
传统观点一直认为电离辐射是对生物机体有害的,即使是很小的照射剂量也会对生物体造成损伤。并且随着照射剂量的增加其造成的损伤也呈线性增加,即所谓的线性无阈理论(linear no threshold,LNT)。但近年来有研究表明低剂量照射(Low dose irradiation)对机体可能产生有益的作用。对低剂量电离辐射的生物学效应成为国内外放射医学界研究的热点。
骨髓间充质干细胞(BMSCs)是一类具有多分化潜能的前体细胞,在应激条件下可向不同成体细胞方向分化。Sabine Francois等认为LDI后损伤部位的组织修复可能与照射促使骨髓间充质干细胞“归巢”、即向损伤部位趋化有关。本实验以BMSCs作为实验对象,在对其进行LDI照射后,检测照射对其成骨潜能的影响,以期能够从细胞水平部分解释LDI促进大鼠骨折后骨痂矿化的机理。
1 材料与方法
1.1 一般资料 间充质干细胞(BMSCs)的提取取4周龄清洁级SD大鼠,颈椎脱臼处死,无菌条件下分离出双侧股骨,以取磷酸盐缓冲液(PBS)对骨髓腔反复冲洗并吹打混匀获取细胞悬液。收集细胞悬液并将其转移入15 ml离心管中1000 r/min,离心5 min。弃上清液,加入含10% 胎牛血清的α-MEM培养液重悬,以1×106/cm2密度接种于25 cm2的培养瓶中,置于37℃、体积分数为0.05的CO2饱和湿度的培养箱中培养。于接种第24小时半量换液,待细胞贴壁后可全量换液。以后各每3 d全量换液1次。
1.2 分组及X线照射处理 细胞分为6组,分别为0 gy(假照射组)、25 mGy、50 mGy、75 mGy、100 mGy、1 gy(高剂量照射组)。每组设两个培养板,每块培养板设4个复孔。
1.3 成骨诱导 照射后更换含有10%胎牛血清、地塞米松、抗坏血酸、β-甘油磷酸的DMEM成骨诱导培养液。调整细胞浓度至1×104/ml,接种于24孔细胞培养板,每孔加培养基2 ml。同步化培养24 h,待细胞贴壁后,给予不同剂量X线照射处理。每3 d换液一次,持续诱导培养14 d。
1.4 RT-PCR法检测成骨相关基因 由Genebank查出COL-1、OPG、BGP三种基因的碱基序列,根据引物设计原则选择相应的碱基片段,并分别设计上下游引物。三种基因引物序列分别为
COL-1上游引物:5'-GATGCCAATGTGGTTCGTG-3'
下游引物:5'-TTCTTGCGGCTGCCCTCT-5'
OPG上游引物:5'-GGAGCAGAAGACATTGAA-3'
下游引物:5'-TGGACCTGGTTACCTATC-3'
BGP上游引物:5'-GCCCTCACACTCCTCGCCCTAT-3'
下游引物:5'-GCTCCAGGGGATCCGGGTAG-3'
内参GADPH上游引物:5'-TGCGTGACATTAAGGAGAAG-3'
下游引物:5'-CTGCATCCTGTCGGCAATG-3'
以Trizol裂解细胞,提取细胞内的RNA,以如上引物逆转录制得cDNA并进行PCR扩增,各组分别吸取6 μl PCR产物与标准100bpDNAmarker在1.2%琼脂糖凝胶进行电泳,电压220 V,电泳时间30 min。紫外光下拍照后以全自动凝胶成像分析系统进行相对积分光密度分析,并与内参照物GADPH的光密度比较。
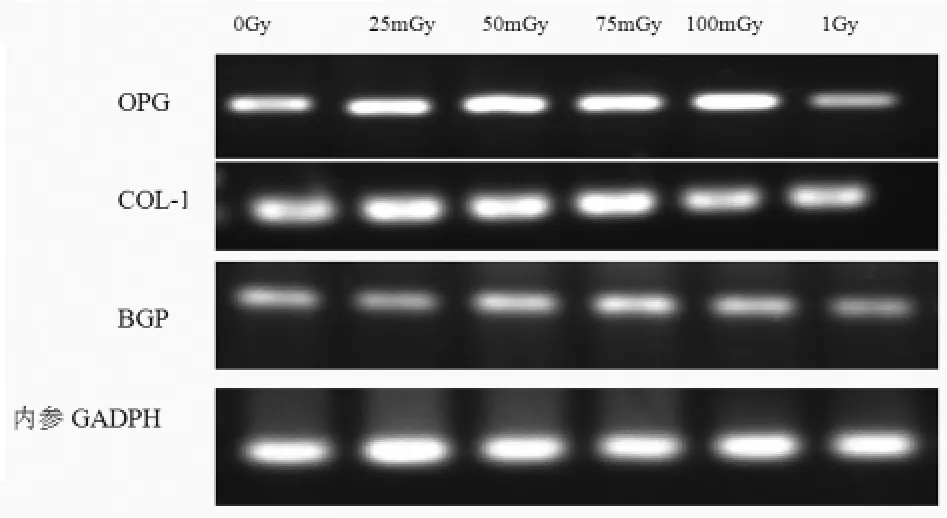
图1 RT-PCR检测不同剂量X线照射后成骨相关基因的表达情况
2.2 RT-PCR检测成骨相关基因结果 RT-PCR产物经1.2%琼脂糖凝胶电泳结果显示如图1。结果显示经低剂量X线照射后,成骨相关基因COL-1、OPG、BGP较之假照射组相比,表达均有增强,其中以75 mGy与100 mGy照射组增强最为显著,差异有统计学意义(P<0.05);而在1 Gy高剂量X线照射后,成骨相关基因COL-1、OPG、BGP较假照射组相比表达均有减弱,差异有统计学意义(P<0.05)。提示低剂量的X线照射在诱导BMSCs向成骨细胞分化的过程中可促进相关成骨基因的表达,增强BMSCs的成骨分化潜能,而高剂量X线照射则会对BMSCs的成骨分化有抑制作用(表1)。
表1 不同剂量X线照射后成骨相关基因的表达(n=8,)
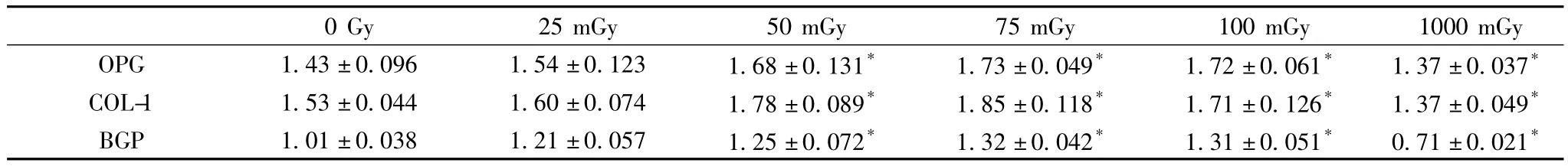
表1 不同剂量X线照射后成骨相关基因的表达(n=8,)
注:与0 Gy组相比,P<0.05
0 Gy 25 mGy 50 mGy 75 mGy 100 mGy 1000 mGy OPG 1.43±0.096 1.54±0.123 1.68±0.131* 1.73±0.049* 1.72±0.061* 1.37±0.037*COL-1 1.53±0.044 1.60±0.074 1.78±0.089* 1.85±0.118* 1.71±0.126* 1.37±0.049*BGP 1.01±0.038 1.21±0.057 1.25±0.072* 1.32±0.042* 1.31±0.051* 0.71±0.021*
3 讨论
骨髓间充质干细胞作为成骨细胞的前体细胞,参与骨折后的愈合过程。因此,我们认为低剂量电离辐射促进BMSCs向成骨细胞方向分化可能是其促进骨痂矿化的机制之一。
我们通过RT-PCR法检测了三种成骨基因:COL-1(Collagen I,Ⅰ型胶原)、OPG(osteoprotegerin,骨保护素)以及BGP(bone gla protein,骨钙素)。三种基因均对骨折的愈合和成骨细胞的矿化有重要作用。
COL-1的合成和分泌是骨组织形成的前提条件,其合成和分泌的增加将对成骨细胞的矿化有促进作用,且在成骨分化的早期即有表达[1],有研究报道COL-1的缺乏会导致成骨不全甚至骨折[2,3]。
OPG主要由骨组织中的成骨细胞产生[4]。其具有增加骨密度和抑制破骨细胞分化的作用,同时是是促进成骨细胞分化、成熟的重要细胞因子[5]。有研究表明将敲除小鼠OPG基因后,可导致严重的骨质疏松症[6]。
BGP又名骨γ-羧谷氨酸包含蛋白,由成骨细胞合成和分泌,并且不受骨吸收因素的影响,含量比较稳定,通过对BGP基因的检测,可以了解成骨细胞的活动状态,从而可以反映诱导的BMSCs向成骨分化的能力。
本实验中,结果证实在接受低剂量X线照射后,诱导分化的BMSCs表达COL-1、OPG、BGP的量均有明显增加,以75 mGy与100 mGy组最为显著,相关深层机制的研究有待于进一步探究。但可以肯定的是LDI具有促进骨髓间充质干细胞成骨分化潜能的作用,LDI的兴奋性效应是医学界的重大发现,在不久的将来有望应用于临床,用于治疗骨折延迟愈合和骨不连等。
[1] Pochampally RR,Horwiitz EM,et al.Correction of a minerralezation defect by overexpression of wild-type cDNA for COL1A1 in marrow stromal cells(MSCs)from a patient with osteogenesis imperfecta:a strategy for rescuing mutations that produce dominantnegative protein defects.Gene Ther,2005,12:1119-1125.
[2] Rauch F,Glorieux FH.Osteogenesis imperfecta.Lancet,2004,363:1377-1385.
[3] Sakkers R,Kok D,Engelbert R,et al.Skelet al et al.Skelet al effects and functional outcome with olpadronate in children with osteogenesis imperfecta:a 2-year randomised placebo-controlled study.Lancet,2004,363:1427-1431.
[4] Simon WS,Lacey DL,et al.Osteoprotegerin:a novel seccreted protein involved in the regulation of bone density.Cell,1997,89:309-319.
[5] Lacey DL,Timms E,Tan HL,et al.Osteoprotegerin(OPG)ligand is a cytokine that regulate osteoclast differentiation and activation.Cell,1998,93:165-176.
[6] Bucay N,Sarisi I,Dunstan CR,et al.Osteoprotegerin-deficient mice develop early onset osteoprosis and arterial calfinication.Gene Dev,1998,12:1260-1268.

