外来入侵生物福寿螺β-actin基因片段的克隆及表达分析
郑国湾,董胜张,俞晓平
(中国计量学院 生命科学学院,浙江省生物计量与检验检疫重点实验室,浙江 杭州 310018)
肌动蛋白(actin)是一种广泛存在于真核生物细胞中的多功能球状蛋白,由单个亚基构成,主要分为:参与细胞骨架组成的微丝,参与肌肉细胞的收缩的肌细丝[1,2].肌动蛋白是一类高度保守的蛋白质,其氨基酸序列在各个物种间的差异不超过20%,是细胞内的管家基因.肌动蛋白参与许多重要的细胞生理过程,包括肌肉收缩,细胞运动,细胞分裂,细胞信号转导,细胞连接建立和细胞形态维持等[1,3].作为细胞内的管家基因,肌动蛋白在生物体内的生理或者受刺激状态下都保持持续恒量表达,因此在许多量化实验中,如实时荧光定量PCR,半定量RTPCR,Western blot和Northern blot杂交中均作为内参基因[4].
福寿螺Pomacea canaliculata(Lamarck),又名苹果螺、大瓶螺,是一种大型的淡水螺类,隶属于软体动物门(Mollusca)、腹足纲(Gastropoda)、新进腹足目(Caenogastropoda)的瓶螺科(Ampullariidae).福寿螺原产于南美洲亚马逊流域,因其被高估的经济价值在20世纪80年代相继被亚洲许多国家引进并饲养[5].福寿螺适应能力强,繁殖快,食性杂,在食物充足并缺乏有效天敌的环境中能迅速建立起种群,并成为当地生物群落的优势种[6,7].福寿螺喜食水稻幼苗及其它水生作物,现已成为我国及其他亚洲国家严重的农业有害生物之一[7,8].
然而迄今为止,有关福寿螺β-actin基因的研究尚未见报道.本研究成功地克隆了入侵我国的福寿螺β-actin片段cDNA,并分析了其序列组成.通过检测其在鳃、消化腺、肾和足部肌肉组织等中的表达情况,为以后研究福寿螺其它功能基因提供了分子内标.此外,分析福寿螺β-actin基因片段序列与其他物种序列的差异性,并采用NJ法同其它相近物种构建了系统发育树,初步探讨福寿螺与其它物种的亲缘关系,为福寿螺的入侵和危害提供理论依据.
1 材料和方法
1.1 样品采集和处理
成年福寿螺采自浙江余姚茭白田间.所有福寿螺个体在恒温实验室进行缸养,饲养温度为(26±1)℃,光照D∶L=12h∶12h,喂养食料为新鲜白菜叶.在实验前,所有采集的福寿螺进行至少10d以上的驯养.挑取健康福寿螺,进行24h饥饿处理后进行相关实验.
1.2 主要试剂
Trizol®reagent购自美国Invitrogen公司;PrimeScript®1st Strand cDNA Synthesis Kit,LA-Taq DNA 聚合酶,r-Taq DNA 聚合酶,DL2000DNA Marker,pMD-18Tvector购 自TaKaRa公司;Gel Extraction kit购自Axygen公司;其它试剂均为分析纯,所用水均为超纯水.
1.3 总RNA的提取和cDNA第一链的合成
取福寿螺鳃、消化腺、肾和足部肌肉鲜活组织,按照Trizol试剂操作说明书抽提总RNA,电泳检测其完整性,通过核酸定量仪检测其浓度和纯度,以保证其OD260/OD280在1.8到2.0的范围内.按照反转录PrimeScript®1st Strand cDNA Synthesis Kit说明书合成第一链cDNA.
1.4 福寿螺β-actin cDNA片段序列的获得
根据GenBank中的相近种光滑双脐螺Biomphalaria glabrata(登录号:U53348),盘鲍螺Haliotis discus(登录号:EF103363),文蛤 Meretrix meretrix(登 录 号:JN084197),栉 孔 扇 贝Chlamys farreri(登录号:AY335441),紫贻贝Mytilus galloprovincialis(登录号:AF157491)的β-actin cDNA序列保守区域设计简并引物actin-F和actin-R,用于来扩增β-actin的cDNA 片段.PCR 反应体系为:5μl 10×PCR Buffer(Mg2+Plus),4 μl dNTP Mixture (each 2.5mM),2μl模板cDNA正反引物(10μM)各1μl,TaKaRa Taq(5U/μl)0.25μl,加ddH2O至50μl.扩增程序为:94℃预变性3min;然后94℃变性30s,55℃退火30s,72℃延伸1min,共35个循环;最后72℃延伸10min.所得的PCR产物均用1.2%的琼脂糖凝胶电泳,切胶回收后,连接到pMD-18T,转化到大肠杆菌DH-5α感受态细胞,挑取的阳性克隆送至上海博尚生物有限公司测序.
1.5 序列分析和数据处理
通过美国国家生物技术信息中心(NCBI)的BLAST功能,鉴定获得的β-actin cDNA全长是否属于相应的actin基因家族.使用DNAMAN软件,将根据β-actin cDNA推测出的编码框氨基酸序列同其它部分已知物种相应的β-actin氨基酸序列进行同源性比对,并且使用 MEGA 5.0(Neighbor-Joining)构建了相应的生物系统进化树,采用Bootstrap(重复数1000)检验分子系统树各分支的置信度.
1.6 福寿螺β-actin基因在4个组织中的转录水平
根据获得的β-actin基因核苷酸序列,设计一对特异性引物actin-F和actin-R:5′-TCACCAT TGGCAACGAGAGAT-3′和5′-TCTCGTGA ATACCAGCCGACT-3′,对福寿螺鳃组织cDNA进行PCR扩增,并对退火温度及循环次数进行优化,获得适宜的实验参数.采用优化后的反应体系对福寿螺鳃、消化腺、肾和足部肌肉组织的RNA进行半定量PCR检测.PCR反应条件为:94℃预变性3min;然后94℃变性30s,55℃退火30s,72℃延伸1min,共28个循环;最后72℃延伸10 min.PCR产物经2.0%琼脂糖凝胶电泳分离检测.
2 结果与分析
2.1 序列特征分析
经RT-PCR扩增,电泳后获得福寿螺β-actin基因片段清晰单一的扩增产物(图1).序列测定表明福寿螺β-actin基因序列长度为840bp,与电泳图预测大小一致.其推导的氨基酸序列(280个)均为β-actin基因开放阅读框的一部分(图2).
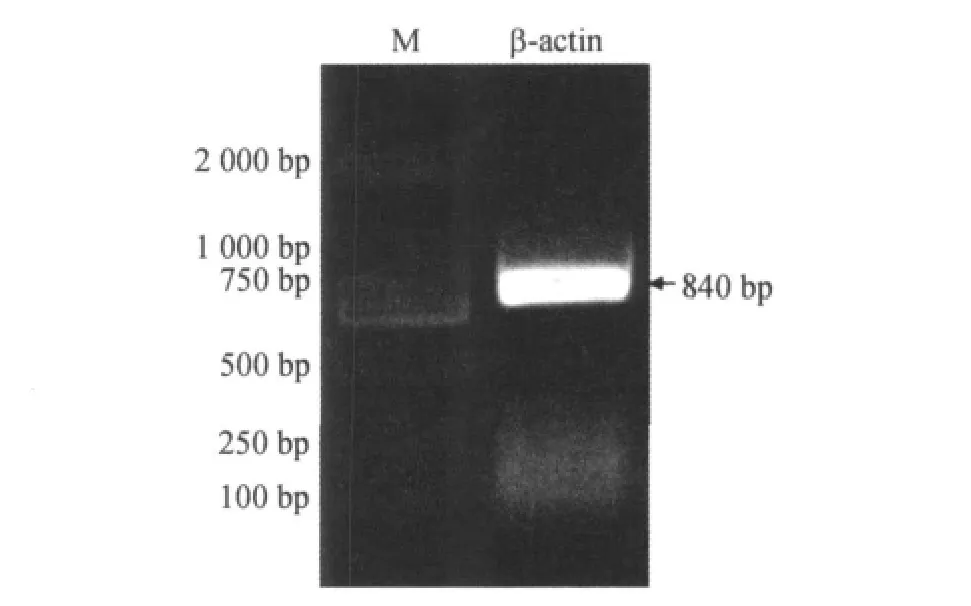
图1 福寿螺β-actin扩增电泳图谱Figure 1 PCR amplification ofβ-actin in apple snail

图2 福寿螺β-actin基因片段核苷酸序列及其推导氨基酸序列Figure 2 Nucleotide and deduced amino acid sequences ofβ-actin cDNA fragment
福寿螺β-actin基因片段推导的氨基酸序列在NCBI中经过BLAST搜索,与其他已知物种β-actin基因进行同源性比较.发现其氨基酸序列与其他已知相近物种基因的部分片段或全长具有高度同源性94%~98%(表1),且与软体动物间具有更高的同源性.

表1 福寿螺β-actin基因推导的片段氨基酸序列同源性比较Table 1 Identity comparison of the amino acid sequences of theβ-actin cDNA fragments in apple snail
基于福寿螺β-actin推导氨基酸序列及表1物种的序列,采用MEGA 5.0软件以NJ法构建了8种动物的系统进化树(图3).福寿螺与软体动物门的其他物种聚为一簇,然后与节肢动物聚为一簇,再与脊椎动物聚为一簇.

图3 根据部分β-actin氨基酸序列构建的NJ系统进化树Figure 3 Phylogenetic tree of amino acids sequences of β-actin genes constructed with the neighborjoining method
2.2 福寿螺β-actin基因的表达分析
在优化的PCR条件下,使用RT-PCR检测福寿螺β-actin基因在其鳃、消化腺、肾和足部肌肉等组织的转录水平.电泳结果(图4)显示β-actin基因在这四个组织中的表达基本一致,具有良好的稳定性,表明该基因适合作为内参基因.

图4 福寿螺四种组织β-actin基因的RT-PCR检测Figure 4 Relative expression ofβ-actin mRNAs in four different tissues
3 讨 论
本研究采用简并PCR成功地获得了福寿螺β-actin基因部分cDNA序列,这是在淡水螺类中是首次报道.目前对软体动物β-actin基因的研究主要集中在海水贝类等经济软体动物,如太平洋牡蛎(C.giga)[9]、虾夷扇贝(Patinopecten yessoens)[10]、皱纹盘鲍(H.discus hannai)[11]等.本次得到的福寿螺β-actin氨基酸序列不但与太平洋牡蛎、光滑双脐螺(B.glabrata)等软体动物具有很高的相似性,而且与果蝇(D.melanogaster)、斑马鱼(D.rerio)、大鼠(R.norvegicus)等动物也有较高的相似性,这符合β-actin基因氨基酸编码区高度保守的特点[4,12],可能与它参与构成细胞骨架等重要功能密切相关.
β-actin基因一直以来被作为内参基因广泛应用于基因的相对表达实验中.本实验从半定量PCR得到的结果表明,福寿螺β-actin基因在鳃、消化腺、肾和足部肌肉组织等组织中表达基本一致,并具有良好的稳定性.软体动物分子生物学研究中,β-actin基因仍是最常用的内参基因,如栉孔扇贝(C.farreri)[13]、皱纹盘鲍(H.discus hannai)[14]、合浦珠母贝 (Pinctada fucata)[15]等,而且表达稳定.因此,只要通过在福寿螺表达试验中β-actin基因是否受到实验操作的影响的研究,就可以判定该基因是否可以作为研究福寿螺其他功能基因相对表达的内参基因.
[1]RUBENSTEIN P A.The functional importance of multiple actin isoforms[J].BioEssays,1990,12(7):309-315.
[2]KABSCH W,VANDEKERCKHOVE J.Structure and function of actin[J].Annual Review of Biophysics and Biomolecular Structure,1992,21(1):49-76.
[3]POLLARD T D,COOPER J A.Actin and actin-binding proteins.A critical evaluation of mechanisms and functions[J].Annual Review of Biochemistry,1986,55(1):987-1035.
[4]ZHONG H,SIMONS J W.Direct comparison of GAPDH,β-Actin,cyclophilin,and 28SrRNA as internal standards for quantifying RNA levels under hypoxia[J].Biochemical and Biophysical Research Communications,1999,259(3):523-526.
[5]JOSHI R C.Problems with the management of the golden apple snail Pomacea canaliculata:an important exotic pest of rice in Asia [M].Springer:Netherlands,2007:257-264.
[6]YUSA Y,SUGIURA N,WADA T.Predatory potential of freshwater animals on an invasive agricultural pest,the apple snail Pomacea canaliculata (Gastropoda:Ampullariidae),in Southern Japan[J].Biological Invasions,2006,8(2):137-47.
[7]DONG S Z,ZHENG G W,YU X P,et al.Biological control of golden apple snail,Pomacea canaliculata by Chinese soft-shelled turtle,Pelodiscus sinensis in the wild rice,Zizania latifoliafield[J].Scientia Agricola,2012,69:142-146.
[8]CARLSSON N O L,BRÖNMARK C,HANSSON L A.Invading herbivory:the golden apple snail alters ecosystem functioning in asian wetlands[J].Ecology,2004,85(6):1575-1580.
[9]MIYAMOTO H,HAMAGUCHI M,OKOSHI K.Analysis of genes expressed in the mantle of oyster Crassostrea gigas[J].Fisheries Science,2002,68(3):651-658.
[10]刘卫东,赫崇波,刘 形,等.虾夷扇贝肌动蛋白基因cDNA序列克隆与分析[J].水产科学,2008,27(10):519-522.
[11]张志峰,茅云翔,潘 洁,等.皱纹盘鲍肌动蛋白基因启动子的克隆和序列分析[J].水产学报,2001,25(5):398-401.
[12]MA H M,MAI K S,LIUFU Z G,et al.Cloning and characterization of an actin gene of the scallop Chlamys farreri and the phylogenetic analysis of mollusk actins[J].Chinese Journal of Oceanology and Limnology,2007,25(3):304-309.
[13]胥 炜,王 昊,宋林生,等.栉孔扇贝C型凝集素基因的克隆与表达研究[J].高技术通讯,2005,15(1):83-88.
[14]MA H M,XU W,MAI K S,et al.Cloning and characterization of an abalone(Haliotis discus hannai)actin gene[J].Journal of Ocean University of China(English Edition),2004,3(2):145-149.
[15]WANG Z L,WU Z H,JIAN J C,et al.Cloning and expression of an actin gene in the haemocytes of pearl oyster(Pinctada fucata,Gould 1850)[J].Marine Genomics,2008,1(2):63-67.

