黄芪杂多糖通过调节IL-6和PG-1的表达提高仔猪免疫力
范阔海,张 蓓,李娟娟,李宏全
(山西农业大学动物科技学院,山西太谷 030801)
天然来源的多糖是一类大分子,它对免疫系统有重要影响,因此在临床应用上可能作为一种免疫调节剂[1-2]。黄芪多糖 (Astrgaluspolysaccharides,APS)是从中药黄芪中提取出的多糖类物质[3]。据相关研究报道,APS具有增强或调节免疫的功能,Li研究证明APS通过调节体液免疫和细胞免疫对Ⅰ型糖尿病的小鼠有免疫治疗作用[4];Kong X 等[5]通过体内和体外试验证明,APS通过促进外周淋巴细胞增殖和增加血清中抗体来发挥增强免疫的作用。猪源抗菌肽PG-1属于Cathelicidin家族,具有广谱抗菌活性,在动物机体免疫中发挥着重要的作用[6-7]。Cathelicidin 基因的 5′端启动子区域包含NF-κB、NF-IL-6和IL-6等调控因子结合的位点,这表明Cathelicidin基因的表达可能被这些因子所调控[8-9]。Wu H 等[10]将脂多糖(LPS)、白介素-6(IL-6)、全反式视黄酸(ATRA)与猪骨髓细胞一起进行体外培养,通过Northern blot检测发现培养上清液中的PG-1和PR-39mRNA表达水平显著增加。但黄芪多糖对仔猪的免疫调控作用如何以及发挥作用的机制尚不清楚。本试验通过给仔猪体内注射AHPS注射剂,设定不同的剂量组,研究主要产生IL-6的T淋巴细胞和单核细胞的活性,检测IL-6的表达量和PG-1基因的表达水平,分析T淋巴细胞和单核细胞的活性、IL-6的表达量、PG-1基因的表达水平与AHPS剂量的相关性,来研究黄芪多糖对仔猪的免疫调控作用。
1 材料与方法
1.1 材料
1.1.1 试剂 按照本课题组报道的微波萃取法制备 AHPS[11-13],参 考 《中 国 药 典 》自 制 AHPS 注 射剂,通过中药制剂的9项安全检查确定自制注射剂可用于动物试验。淋巴细胞分离液,天津灏洋生物有限公司产品;Trizol试剂,Invitrogen公司产品;猪IL-6ELISA 试 剂 盒,美 国 R○RD 公 司 产 品;DNA Marker DL2000和 SYBR PrimeSciptTM RT-PCR Kit(Perfect Real Time),宝生物工程(大连)有限公司产品。
1.1.2 组织材料 12头健康杜长大杂交仔猪,体重为10kg±1kg,20日龄仔猪购自山西天禄丰种猪育种有限公司养猪场,未注射过疫苗,健康,观察饲养15 d后,将其随机分为4组(每组3头),其中1组为对照组,3组分别为注射50、100、200mg/kg体重剂量的AHPS试验组,每日注射1次,连续注射7d。注射黄芪多糖的第1、3、5、7天采血,分抗凝血和非抗凝血两种,分别用于T淋巴细胞和单核细胞的增殖活性和IL-6含量的检测;第7天采血后处死仔猪,无菌条件下取股骨骨髓,置于DEPC处理过的EP管中,立即放入液氮中保存,用于总RNA的提取。
1.2 方法
1.2.1 T淋巴细胞和单核细胞的增殖活性检测在2mL抗凝血中加等体积的无血清RPMI Medium 1640培养基,将其缓慢加入至淋巴细胞分离液中,离心分层,吸取灰白色的中间层,主要为外周血单个核细胞。用含100mL/L胎牛血清的RPMI-1640重悬洗涤后的外周血单个核细胞,接种至一次性培养瓶中,放入培养箱进行培养,在37℃、体积分数为5%的CO2培养箱中培养2h后,非贴壁细胞为淋巴细胞(97%以上为T淋巴细胞),贴壁细胞即为单核细胞。将非贴壁细胞悬液吸出离心,1 000 r/min,10min,弃上清,加含100mL/L胎牛血清的RPMI-1640重悬;将贴壁的单核细胞用2.5g/L胰蛋白酶进行消化,37℃培养箱中消化15min,胎牛血清终止消化,加完全RPMI-1640培养基重悬,台盼蓝染色计数测活性均在95%以上,将细胞浓度均调整为1×106个/mL。用MTT法检测T淋巴细胞和单核细胞的增殖活性。
1.2.1.1 MTT法测定T淋巴细胞活性 于96孔培养板中加入T淋巴细胞悬液100μL,使每孔细胞为1×105个,每头猪做了5个重复,同时设无细胞孔作为调零孔及试验孔。用完全RPMI1640培养基将每孔补至200μL,试验孔加入CoA(终浓度为5 μg/mL),在37℃、体积分数为5%的CO2培养箱中培养48h,培养结束前4h,从每孔吸出100μL上清,再加 MTT(5μg/mL)15μL,继续培养,结束前将上清完全弃去,然后加150μL DMSO溶解细胞,10min内用酶标仪测定各孔OD 590nm值,来判定淋巴细胞的增值情况。
1.2.1.2 MTT法测单核细胞活性 于96孔培养板中加入100μL单核细胞悬液,使每孔细胞为1×105个,每头做5个重复,同时设无细胞孔为调零孔。用完全RPMI1640培养基将没孔补至200μL,在37℃、体积分数为5%CO2培养箱中培养4h使单核细胞贴壁,从每孔吸出100μL上清,每孔加入15μL MTT,继续培养4h后,将上清完全弃去,加150μL DMSO溶解细胞,10min内用酶标仪测定各孔OD 590nm值,来判定单核细胞的增殖情况。
所有测定数据结果用SPSS16.0统计学软件处理,对结果进行因果方差分析Duncan′s多重比较。结果用平均数±标准差(±SD)表示。
1.2.2 IL-6含量检测 将采取的非抗凝血,3 000 r/min离心20min,吸出上清,按照ELISA试剂盒说明书进行操作,检测上清中IL-6的含量。ELISA试验数据用CurveExpert 1.3分析得出,所有试验数据应用SPSS16.0统计软件进行单因素方差(One-Way ANVOA)分析,进行t检验,所有试验数据都以平均数±标准差(±SD)表示。
1.2.3 骨髓PG-1mRNA表达水平的测定
1.2.3.1 骨髓总RNA的提取与引物设计 根据Trizol试剂盒说明书提供的步骤,提取骨髓总RNA,电泳检测完整性,使用ND-1000微量核酸蛋白测定仪测定其浓度。根据NCBI公布的猪PG-1和β-actin基因序列,借助Primer5.0plus软件设计特异性引物(表1),由北京华大基因研究中心合成。
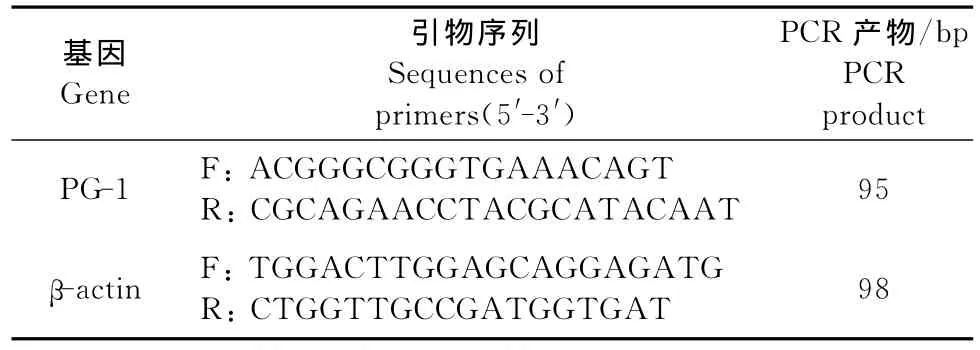
表1 目的基因和内参基因的引物序列Table 1 Sequences of primers of target and house-keeping gene
1.2.3.2 实时荧光定量PCR 将提取的各样本RNA浓度归为同一浓度,按照宝生物工程(大连)有限公司反转录试剂盒方法,以Oligo(dT)为反转录引物,合成cDNA。反转录条件为37℃15min,85℃5s。
取反转录后的cDNA为模板,以特异性引物进行PCR扩增。反应体系物为25μL:cDNA 2μL,dNTPs 2μL,10×buffer 2.5μL,特异上下游引物0.5μL,TaqE 0.25μL,无菌水17.75μL。反应条件:95℃10s;95℃5s,58℃20s,72℃20s,40个循环;72℃10min。PCR产物用20g/L的琼脂糖凝胶电泳检测。将目的条带切割回收后送交宝生物工程(大连)有限公司双引物测序。
取反转录合成的cDNA,按照2倍梯度稀释5个浓度标准做标准曲线。每个样品分别使用PG-1基因和β-actin基因进行实时荧光定量RT-PCR扩增,反应分别在密闭的定量PCR管中进行。反应体系:SYBR®Premix ExTaqTM (2×)12.5μL、PCR Forward Primer 0.5μL、PCR Reverse Primer 0.5 μL、cDNA溶液1μL、ROX Reference DyeⅡ(50×)0.5μL、加dH2O至25μL。反应条件:95℃预变性10s;95℃10s,58℃ 15s,72℃ 20s,45个循环;95℃1min,55℃30s,95℃30s。每个样本、PG-1基因、β-actin基因重复3次。反应结束,由熔解曲线判定PCR反应的特异性,根据标准曲线以及荧光曲线的CT值计算定量结果(结果用平均值±标准差表示)。通过2-△△CT法计算PG-1在不同剂量组和对照组中的基因相对表达水平,△CT目的基因=CT目的基因-CT内参基因,△△CT=△CT剂量组-△CT对照组,PG-1mRNA表达差别倍数以2-△△CT表示。
2 结果
2.1 黄芪多糖对T淋巴细胞和单核细胞增殖活性的影响
在注射AHPS同一时间段内,不同剂量下,MTT法检测T淋巴细胞增殖的统计分析结果显示,注射后第3天与对照组相比,高剂量组和中剂量组的T淋巴细胞增殖活性差异极显著(P<0.01),而低剂量组差异不显著(P>0.05);注射后第5天与对照组相比,高、中剂量组均差异极显著(P<0.01),低剂量组差异显著(P<0.05);注射后第7天与对照组相比,高、中剂量组均差异极显著(P<0.01),低剂量组差异显著(P<0.05)(图1A)。检测单核细胞增殖结果的统计分析显示,在注射APS后的第3、5、7天的时候,高、中、低剂量组的单核细胞增殖活性与对照组相比,均差异极显著(P<0.01)(图1B)。

图1 黄芪杂多糖对仔猪外周血中的T淋巴细胞和单核细胞增值活性的影响Fig.1 Effect of AHPS on proliferation of T lymphocytes and monocytes in the peripheral blood of piglets
2.2 IL-6含量的检测
ELISA检测血清中IL-6含量的统计分析显示,在注射AHPS后的第3、5、7天,AHPS处理的各组的IL-6含量均显著高于空白对照组(P<0.01),IL-6含量随着注射天数的增加逐渐增加。除第1天外,在注射的相同时间内,IL-6含量变化呈剂量依赖性增加(图2)。
2.3 骨髓中PG-1mRNA的表达水平
通过2-△△CT法计算PG-1在注射不同剂量的AHPS后的基因相对表达水平。结果显示,PG-1基因在低、中、高剂量组的表达水平分别是对照组的1.6174、2.0556和2.7132倍,且呈剂量依赖性增加(图3)。
3 讨论
黄芪药理作用广泛,能调节机体免疫功能,增强细胞代谢,调节DNA复制及RNA和蛋白质的合成[14],黄芪多糖提取于黄芪,大量研究证明APS作为免疫调节剂在免疫调节过程中发挥着重要的作用。Chen H L等[15]通过体外和体内试验均已证明APS通过促进外周淋巴细胞增殖、增肌血清抗体、增加一氧化氮(NO)和白介素-2(interleukin-2)的产生来发挥潜在的免疫刺激活性。APS还可激活小鼠的B细胞和巨噬细胞[16-17]。T淋巴细胞和单核细胞在机体免疫中发挥着重要的作用,其中T淋巴细胞主要来源于骨髓的多能干细胞,参与机体的细胞免疫。而单核细胞代表机体总的细胞免疫水平[18],抗体的产生、细胞因子的释放、细胞杀伤作用的变化等都是以此为基础的。激活的单核细胞能产生并释放大量的多种的细胞毒素、干扰素和白介素,参与机体的防卫机制,而活化的T淋巴细胞和外周血单核细胞是主要产生IL-6的免疫细胞。IL-6可促进多种细胞的增值和分化,它的这种多能性是由广泛表达于多种细胞表面的IL-6受体介导的,可以通过其受体活化胞内的一系列信号蛋白分子从而实现反应基因的诱导表达[19]。研究表明IL-6主要有Jak/STAT和 Ras/NF-IL-6这两条信号转导通路,转录因子STAT3(signal transducer and activator of transcription,STATs)和 NF-IL-6分别参与这两条通路。当作用细胞受到IL-6的刺激后,其受体活化激活这两条通路中的JAK激酶和MAPK激酶,进而使转录因子Stat3和NF-IL-6磷酸化,活化了的Stat3和NF-IL-6可与反应蛋白基因中启动子区域的IL-6反应成分结合,从而实现对反应基因的诱导表达[20]。

图2 血清中IL-6含量Fig.2 IL-6contents in serum
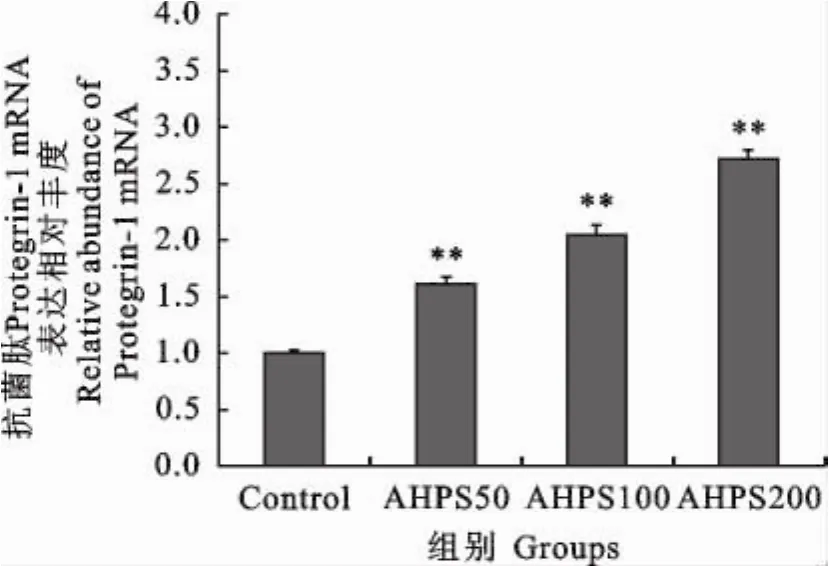
图3 不同黄芪多糖注射剂量对骨髓PG-1mRNA表达量的影响Fig.3 Effects of APS on the expression level of PG-1mRNA in marrow
目前已经确认在抗菌肽Protegrins中,其前3个外显子编码的前导肽序列的5′端的调控区域中存在几个潜在的调控模块,在这个区域中存在着与动物免疫密切相关的NF(nuclesr factors)因子结合位点,如 NF-κB、NF-IL-6、IL-6反应因子、APRE(急性炎性反应因子)、γ干扰素反应因子和细菌LPS(脂多糖)[21]。根据大量研究结果可以推测一些免疫调节剂是通过IL-6调控PG-1的表达。以此为出发点,本试验通过对比不同剂量AHPS注射组与空白对照组的仔猪血液内的T淋巴细胞和单核细胞的增殖活性、IL-6含量,骨髓中PG-1基因的表达水平,并将它们之间的相关性进行分析表明,AHPS肌肉注射于猪体内后,机体内生成IL-6的T淋巴细胞和单核细胞的活性增强,IL-6的含量增加,使抗菌肽PG-1的表达量升高,证实了体内注射黄芪多糖所产生这样的结果的机理是和体外试验的结果一致,AHPS 诱 导IL-6 的 产 生,IL-6刺 激 Stat3 和NF-IL-6活化,从而上调PG-1表达。具体的作用机制需进一步的研究。
[1]Tzianabos A O.Polysaccharide immunomodulators as therapeutic agents:Structural aspects and biologic function[J].Clini Microbiol Rev,2000,13:523-533.
[2]谢燕霞,安利国,杨桂文.植物多糖对巨噬细胞的免疫调节作用[J].中国生物化学与分子生物学报,2008,24(4):307-314.
[3]Cui R,He J C,Wang B,et al.Suppressive effect ofAstragalusmembranaceusBunge on chemical hepatocarcinogenesis in rats[J].Cancer Chemother Pharmacol,2003,51:75-80.
[4]Li R J,Qiu S D,Chen H X,et al.The immunotherapeutic effects ofAstragaluspolysaccharide in type 1diabetic mice[J].Biol Pharm Bull,2007,30(3):470-476.
[5]Kong X,Hu Y,Rui R,et al.Effects of Chinese herbal medic-inal ingredients on peripheral lymphocyte proliferation and serum antibody titer after vaccination in chicken[J].Inter Immunopharmacol,2004,4:975-982.
[6]Miyasaki K T,Iofel R,Lehrer R I.Sensitivity of periodontal pathogens to the bactericidal activity of synthetic protegrins[J].J Dental Res,1997,76(8):1453-1459.
[7]Cheung Q C,Turner P V,Song C,et al.Enhanced resistance to bacterial infection in protegrin-1transgenic mice[J].Antimicrob Agents Chemother,2008,52(5):1812-1819.
[8]Gudmundsson G H,Agerberth B,Odeberg J,et al.The human gene FALL39and processing of the cathelin precursor to the antibacterial peptide LL-37in granulocytes[J].Eur J Biochem,1996,238:325-332.
[9]Zhao C Q,Ganz T,Lehrer R.Structures of genes for two cathelin-associated antimicrobial peptides:prophenin-2and PR-39[J].FEBS Lett,1995,376:130-134.
[10]Wu H,Zhang G,Minton J E,et al.Regulation of cathelieidin gene expressin:induction by lipopolysaccharide,interleukin-6,retinoicacid,and salmonella enterica serovar typhimurium infection[J].Infec Immun,2000,68:5552-5558.
[11]Li H Q,Zhao M C.Optimizing microwave-assisted extraction technology ofAstragaluspolysaccharides with response surface methodology[J].J Tradit Chin Vet Med,2007,26:10-14.
[12]Li H Q,Zhao W G,LüX H.Analysis of chemical components and structure and bioactivity on immunopotentiatorAstragaluspolysaccharides[J].J Tradit Chin Vet Med,2008,27:5-8.
[13]杨丽华,邱建东,李宏全.黄芪杂多糖调节AA小鼠红细胞免疫黏附功能的研究[J].药学学报,2009,44(12):1364-1370.
[14]Su L,Mao J C,Gu J H,et al.Effect of intravenous drip infusion of cyclophosphamide with high-doseAstragalusinjection in treating lupus nephritis[J].Zhong Xi Yi Jie He Xue Bao,2007,5(3):272-275.
[15]Chen H L,Li D F,Chang B Y,et al.Effects of Chinese herbal polysaccharides on the immunity and growth performance of young broilers[J].Poult Sci,2003,82:364-370.
[16]Shao B M,Xu W,Dai H,et al.A study on the immune receptors for polysaccharides from the roots ofAstragalus membranaceus,a Chinese medicinal herb[J].Biochem Biophysi Res Communica,2004,320:1103-1111.
[17]Lee K Y,Jeon Y J.Macrophage activation by polysaccharide isolated fromAstragalusmembranaceus[J].Internat Immunopharmacol,2005,5:1225-1233.
[18]Frederic G,Markus G,Manz M H,et al.Development of monocytes,macrophages,and dendritic cells[J].Science,2010,327(5966):656-661
[19]宋 伦,沈倍奋.IL-6信号转导机制[J].国外医学:免疫学分册,1999,22(2):79-83.
[20]Dimitrios T,Theodoros V.Molecular mechanisms of action of interleukin-6(IL-6)[J].Pneumon,2007,20:154-166.
[21]Hua W,Christopher R,Frank B.Characterization of an upstream open reading frame in the 5-untranslated region of PR-39,a cathelicidin antimicrobial peptide[J].Mol Immunol,2002(39):9-18.

