个体化诊治时代的乳腺癌病理诊断
杨文涛
复旦大学附属肿瘤医院病理科,上海 200032
乳腺癌是危害女性健康最常见、发病率最高的恶性肿瘤。在过去的几十年里,乳腺癌的发病率逐年升高,全世界乳腺癌发病率每年上升0.2%~8%,每年新增病例约120万。中国乳腺癌的总体发病率也在不断上升,且与不同地区的经济发展程度相关。与此同时,乳腺癌的致死率却在逐年下降,这主要得益于乳腺癌早期诊断率的提高和有效的治疗方法的普遍采用。
乳腺癌是一种高度异质性的肿瘤,形态学、免疫表型、分子遗传学上的差异导致了乳腺癌对临床治疗的不同反应及预后[1]。目前乳腺癌的治疗已经进入了个体化治疗的阶段,为治疗提供依据的很多指标都来源于病理学诊断,如肿瘤大小、淋巴结转移情况、组织学分型和分级、脉管侵犯、激素受体及HER-2/neu的表达水平等。这些病理指标不仅是治疗方案的选择依据,对预测乳腺癌的生物学行为也非常重要。病理学在乳腺癌个体化治疗中的作用不只局限于明确诊断,而且在治疗方案的选择和预后中也扮演着越来越重要的角色。
1 乳腺癌诊断模式的改变对病理学诊断的影响
目前粗针穿刺活检在乳腺癌诊断中的应用越来越广泛,影像学引导下的粗针穿刺活检已逐渐取代了手术活检。粗针穿刺活检具有一定的优势,如耗时少、花费低、创伤小以及并发症少。对于部分良性病变患者,可以避免手术之苦。对于多发病变患者,可提示多灶癌和多中心癌。粗针穿刺明确病理性质显著减少了乳腺癌的术中冰冻诊断,使病理医生在乳腺诊断中面临的诊断压力明显降低。
但粗针穿刺也对病理医生提出了新的要求。由于粗针穿刺标本较为局限,且可能伴有组织挤压伤,因此需要对各种乳腺病变的病理诊断及鉴别非常熟悉。由于粗针穿刺活检的广泛应用,也需要熟悉粗针穿刺可能导致的一些继发性改变,尤其是上皮移位等现象,避免误诊为浸润性癌。某些病变虽然粗针穿刺未提示恶性,但仍建议重复活检或手术切除,包括病理与临床和(或)影像不符合的病例,还包括平坦上皮非典型性、导管上皮不典型增生、乳头状瘤、黏液囊肿性病变、放射状瘢痕、复杂性硬化性病变及间质丰富的纤维上皮性病变。因此,对于粗针穿刺活检的病理诊断,需要与临床病理密切联系。
2 乳腺癌治疗方式改变对病理的影响
随着乳腺癌手术治疗方式的不断发展,保乳手术和前哨淋巴结活检在临床中的运用越来越广泛。因此对保乳标本切缘的评估以及对前哨淋巴结活检标本的准确评价已成为乳腺癌病理诊断的重要部分。局部进展期乳腺癌经过新辅助化疗可以提高切除率和增加保乳机会,因此新辅助化疗已成为乳腺癌多学科综合治疗的重要部分。
2.1 保乳标本的处理和切缘评价
保乳标本的切缘状态是目前影响乳腺癌患者局部复发的重要因素,因此准确的切缘评价是病理医生面对的新课题。保乳手术需要报告6个手术切面(前、后、上、下、内、外侧)的切缘状态。对于切缘的评定标准目前尚未达成共识,在NCCN乳腺癌临床实践指南(以下简称为NCCN指南)中,切缘处见肿瘤为阳性,切缘距肿瘤>10 mm为阴性,切缘距肿瘤<1 mm为“距切缘较近”,切缘在1~10 mm之间时,肿瘤距切缘的距离越远,则局部复发率越低[2]。在病理报告中,对于切缘的评价应包括以下内容:大体检查时各切缘距肿瘤的距离、镜下各切缘距肿瘤的距离、距切缘最近处肿瘤的类型(原位癌或浸润性癌)。保乳标本切缘的术中评估能在短时间内明确切缘情况,以便及时采取进一步的手术方案,避免二次手术的不便和风险。但若对保乳标本的所有切缘均行冰冻切片检查,则在实际操作中会碰到很多问题。首先,切缘取材的局限性,术中由于时间限制,只能在6处手术切面抽样取6块组织做冰冻切片检查,因而并不能代表所有切缘的情况。其次,由于切缘组织常含有较多的脂肪组织,冰冻制片有一定难度,可能会影响诊断的准确性。再次,多块组织的取材、制片和报告耗时较长,从而影响手术进度。鉴于这一系列问题,笔者所在病理科通过与乳腺外科的沟通和交流,形成了一套行之有效的保乳标本术中处理流程,根据手术医生的定位将标本的前、后、上、下、内、外侧切缘涂上6种不同颜色的染料;将标本切成薄片并仔细观察每个切面的情况,若大体上切缘均在安全范围,则不需要做冰冻切片。但若肿瘤距切缘较近,则需与手术医生沟通是否需要在最近切缘处行冰冻切片或补送切缘。术后大体检查应保证切缘的充分取材。镜下观察时应根据不同颜色对切缘进行准确的定位,并通过显微镜下标尺,准确测量切缘与肿瘤的距离。
2.2 前哨淋巴结状态的评估
淋巴结状态是决定乳腺癌患者治疗和预后的重要因素。目前国际权威乳腺癌诊疗指南均达成共识,在临床腋窝淋巴结阴性的Ⅰ、Ⅱ期患者中,传统的腋窝淋巴结清扫术(axillary lymph node dissection,ALND)可以被前哨淋巴结活检(sentinel lymph node biopsy,SLNB)所取代[3-4]。SLNB可用于大多数临床腋淋巴结阴性乳腺癌的腋窝淋巴结分期;该方法所造成的损伤和不良反应小,可以避免ALND带来的并发症。AJCC乳腺癌分期将乳腺癌腋窝淋巴结中的肿瘤细胞分为孤立肿瘤细胞(isolated tumor cell,ITC)、微转移(micrometastasis)和宏转移(macrometastasis)3种不同的病理形态[5]。①ITC:淋巴结中的肿瘤细胞最大径≤0.2 mm;或淋巴结1个组织学切面上非融合或近乎融合的肿瘤细胞团含有的细胞总量不超过200个。AJCC将ITC视为pN0(i+),ITC可以通过HE染色或免疫组化检测(IHC)证实。②微转移:肿瘤转移灶最大径>0.2 mm但≤2.0 mm。AJCC定义其为pN1mi。因此ITC和微转移两者的分期有本质的区别,前者为pN0,后者为pN1。③宏转移:肿瘤转移灶的最大径>2.0 mm。上述淋巴结不同状态的分类要求病理医生在观察SLN时,不是简单地报告阳性、阴性,而需仔细区别ITC、微转移和宏转移,因为这可能会影响到患者治疗方案的选择。SLN的病理检测方法主要有3种:细胞学(术中细胞印片)、组织学(术中冰冻切片、术后石蜡切片和免疫组化)和分子生物学(逆转录聚合酶链反应检测相关标志物)。St.Gallen国际乳腺癌治疗共识(以下简称St.Gallen共识)推荐在术中对SLN进行印片细胞学或快速冰冻病理检查。NCCN指南明确指出,SLN转移情况需通过术后连续切片的HE染色确定,细胞角蛋白的IHC可用于HE染色无法确定的病例。
2.3 新辅助化疗后手术标本的病理检查
新辅助化疗对于增加手术切除与保乳机会、延长生存期和预测预后无疑起到重要的作用,已经被广泛应用。新辅助化疗后手术标本的评估对病理医生提出了新的要求:①如何准确而充分地取材,以获得准确可靠的组织用于评估新辅助化疗疗效。对新辅助化疗敏感的病例,化疗后肿瘤会变得不明显,肉眼难以判定残余癌组织,此时应根据新辅助化疗前的体检和影像学评估,以及临床定位(如金属夹或皮肤纹身)确定瘤床的位置,而在病理报告中需报告瘤床大小、残留肿瘤灶大小(多少灶及最大灶的直径)。②如何评估新辅助化疗的疗效。病理报告中需要明确是否出现肿瘤对化疗的反应,如坏死、细胞核或细胞质的空泡化、纤维母细胞增生及纤维化、组织细胞及淋巴浆细胞浸润等。目前评估化疗反应的标准有很多,常用的包括Miller-Payne分级、残留肿瘤细胞量等。新辅助化疗后腋下淋巴结常有纤维化或萎缩变小,有时寻找淋巴结有一定困难,应尽可能寻找。
3 传统的病理学指标
传统的病理学指标仍是乳腺癌个体化治疗和预后评估的重要依据,包括肿瘤大小、切缘状态、淋巴结状况、组织学分型和分级及脉管侵犯等[6]。但传统病理指标的判断需要准确细化。
3.1 肿瘤大小
第7版AJCC乳腺癌分期对肿瘤大小的测量做了详尽规定。肿瘤大小测量包括临床体检、影像学评估、病理大体测量和显微镜下测量。需要强调的是,在乳腺癌分期中涉及到的肿瘤大小是指浸润癌的大小,如果肿瘤组织中有浸润性癌和原位癌两种成分,肿瘤的大小应该以浸润性成分的测量值为准。由于体检、影像学及大体检查均无法区分浸润性癌和导管原位癌,因此显微镜下测量应该是最准确的测量方式。若浸润性癌病灶局限,位于一个包埋蜡块内,则肿瘤大小以显微镜下测量的大小为准;但若浸润性癌范围较大,则以巨检时的肿瘤大小为准。对于肉眼能确定的2个以上的多个肿瘤病灶,应在病理报告中注明为多灶性肿瘤,并分别测量大小。
3.2 浸润性癌组织学分型及分级
2003版WHO乳腺肿瘤分类中浸润性癌共有19个组织学类型,不同组织学类型的乳腺浸润性癌生物学行为有所不同[7]。预后较好的组织学类型有小管癌、黏液腺癌、浸润性筛状癌、腺样囊性癌、腺泡细胞癌等,预后较差的包括浸润性微乳头状癌、化生性癌等。对乳腺浸润性癌进行准确的组织学分型对患者的个体化治疗具有非常重要的临床意义。在NCCN指南有关浸润性乳腺癌的术后辅助治疗方案中,针对小管癌、黏液腺癌这两类预后较好的乳腺癌,制定了其特有的内分泌治疗及放化疗方案。2009版St.Gallen共识中,专家小组制定的乳腺癌危险分级定义了3个危险度:低危、中危和高危。乳腺浸润性癌的危险评估体系中,组织学分级中的低级别是低度危险指标,中级别和高级别是中度危险指标。目前采用最广泛的浸润性癌病理分级系统是改良Scarff-Bloom-Richardson分级系统,根据腺管形成的比例、细胞的异型性和核分裂象计数,将浸润性癌划分为高、中、低3个级别[8-9]。腺管形成比例是对整个肿瘤的评估,而细胞异型性和核分裂象计数应评估最严重的区域,一般位于肿瘤的边缘。最近有文献报道加用免疫组化标记如MIB-1,更有助于正确的组织学分级[10]。
3.3 脉管侵犯
在广泛的脉管内癌栓指在≥2个肿瘤组织蜡块中看到脉管内癌栓。在淋巴结阴性患者中,广泛的脉管内癌栓被认为是中度危险的指标。有助于诊断脉管侵犯的病理特征是在远离主肿瘤灶的组织中发现腔隙内的小灶肿瘤细胞,其周围缺乏促纤维增生性反应。免疫组化染色有助于脉管侵犯的识别。
4 分子分型在乳腺癌个体化治疗中的作用
4.1 分子分型
乳腺癌是一类分子水平上具有高度异质性的疾病,即使组织形态相同,其分子遗传学改变也可能不尽相同,从而导致肿瘤治疗和预后的差别。2000年,Perou等[11]通过DNA微阵列的分析,提出了5种乳腺癌的分子分型,即腔面A型、腔面B型、HER-2阳性型、基底样型和正常乳腺样型。各亚型除具有独特的分子表型和免疫表型外,其预后、对治疗的反应以及转移途径都各不相同[12-13]。由于基因表达谱检测需要新鲜组织,且价格昂贵,因此常规应用受到局限。通过免疫组化的检测能大致反映基因表达谱确定的亚组[14],在日常工作中被用于与分子分型大致对应,以利于临床治疗和预后判断。
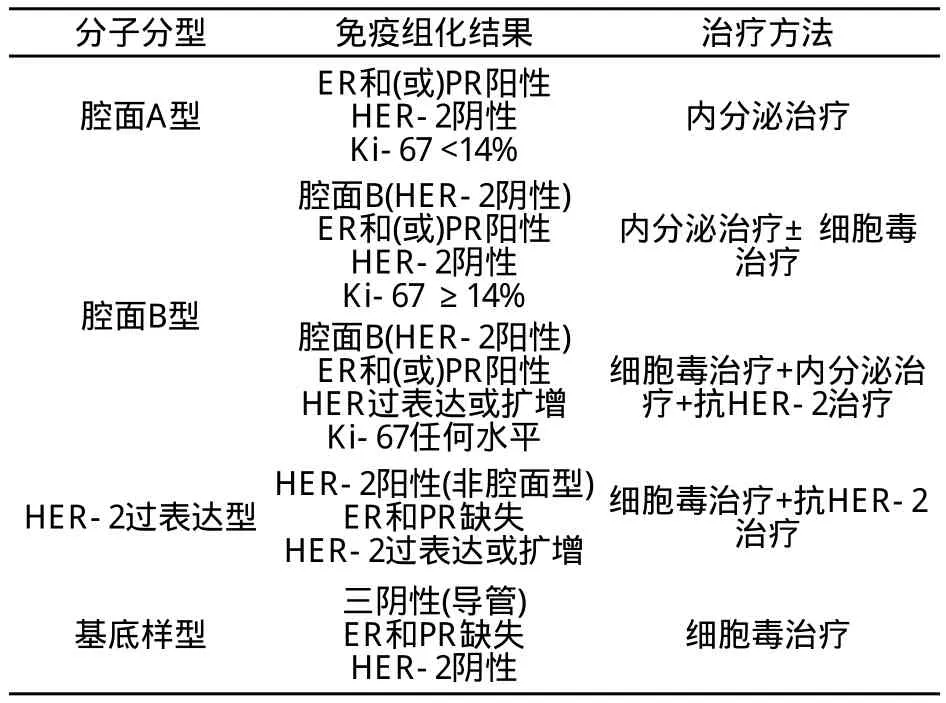
表 1 2011年St.Gallen共识中定义的乳腺癌亚型及其治疗[15]
4.2 ER/PR、HER-2/neu和Ki-67的检测
ER、PR和HER-2/neu的准确检测对患者的分子分型、治疗方案的选择和预后判断都十分重要。目前检测ER、PR状态的方法主要是免疫组化,且在各病理实验室中广泛开展,而HER-2检测推荐免疫组化与荧光原位杂交(fluorescentin situhybridization,FISH)和(或)显色原位杂交(chromogenicin situhybridization,CISH)相结合的检测策略。ER、PR、HER-2免疫组化检测结果受诸多检测前、检测中和检测后因素干扰,检测可靠性在不同实验室之间差异很大,这可能是由于不统一的检测方法及检测结果判断标准而造成的。2007年,美国临床肿瘤协会(ASCO)/美国病理医师学院(CAP)联合发布了乳腺癌HER-2检测指南[16],2010年ASCO/ CAP又颁布了ER、PR免疫组化检测指南[17]。对乳腺癌ER、PR、HER-2检测的技术路线、组织处理、结果判读标准、质量控制等诸方面提出了新的要求。中国病理专家也于2009年提出了乳腺癌HER-2检测指南(2009版)[18]。目前国内病理学界尚未推出针对ER和PR的检测指南,我们也期待国内的的指导性共识尽早问世。免疫组化和基因扩增的检测均应在内、外部质量控制良好的病理实验室进行,必须严格按照指南要求的程序操作,以保证结果可靠。乳腺癌各项标志物检测的基础在于标本的及时、良好固定,这就需要病理医生与外科医生、手术室各部门等通力协作。
近年来研究者针对Ki-67在新辅助治疗、内分泌治疗疗效预测方面的价值进行了诸多尝试,而在St.Gallen共识中Ki-67被纳入了新分型的判定标准。Ki-67的积极意义无可厚非,但目前这一指标的实际应用仍面临诸多问题。首先,为何选择14%作为Ki-67的截断值,目前除了Cheang等[19]的研究外,尚缺乏其他有力的循证医学依据。其次,虽然通过免疫组化方法可进行Ki-67的检测,但即使在国际上Ki-67检测方法及结果判断标准目前仍未形成统一共识。再次,不同的病理医生对Ki-67的认知程度也可能存在差异,这些都对Ki-67的标准检测造成了一定限制。
4.3 多基因分析和个体化治疗
随着分子生物学技术的迅速发展,多基因分析模型已被用来更准确地预测患者的预后[20]。Oncotype DX是一个获得美国FDA认证的包含21个基因的多基因检测系统,其对ER阳性、淋巴结阴性肿瘤复发可能性的预测已被纳入NCCN指南和2009版St.Gallen共识,为ER阳性、淋巴结阴性的临床Ⅰ、Ⅱ期乳腺癌患者提供了术后是否需要辅助治疗的重要参考[21]。除Oncotype DX外,其它多基因预测系统还有包含70个基因的MammaPrint系统[22]、基因组分级(Genomic Grading)[23]和创伤信号(Wound Signature)[24]等。这些研究无疑会提高我们对乳腺癌异质性的认识,并在个体化治疗中发挥积极作用,但由于其价格昂贵、缺乏前瞻性证据等因素,目前这些模型的实际应用仍受到一定局限。
综上所述,病理在临床个体化治疗方案的选择和预后预测中起着至关重要的作用。病理医生需要了解乳腺治疗中的新进展,特别重要的是需要加强与临床医生的沟通和交流,充分发挥病理诊断在乳腺癌个体化诊治中的作用。
[1]SIMPSON P T, REIS-FILHO J S, LAKHANI S R.Breast pathology: beyond morphology[M].Semin Diagn Pathol,2010, 27: 91-96.
[2]BEVERS T B, ANDERSON B O, BONACCIO E.NCCN clinical practice guidelines in oncology: breast Cancer screening and diagnosis [J].J Natl Compr Cancer Netw,2009, 7(10): 1060-1096.
[3]MANSEL R E, FALLOWFIELD L, KISSIN M, et al.Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC Trial[J].J Natl Cancer Inst, 2006, 98: 599-609.
[4]GOLDHIRSCH A, INGLE J N, GELBER R D, et al.Thresholds for therapies: highlights of the St.Gallen International Expert Consensus on the primary therapy of early breast cancer 2009[J].Ann Oncol, 2009, 20: 1319-1329.
[5]American Joint Committee on Cancer.AJCC Cancer Staging Handbook[M].7th ed.Chicago: Springer, 2010.
[6]CARTER C L, ALLEN C, HENSON D E.Relation of tumor size, lymph node status, and survival in 24 740 breast cancer cases[J].CancerI, 1989, 63: 181-187.
[7]TAVASSOLI F A, DEVILEE P.World Health Organization Classification of Tumours//[M].Pathology and genetics of tumours of the breast and female genital organs.IARC Press:Lyon, 2003.
[8]ELSTON C W, ELLIS I O.Pathological prognostic factors in breast cancer.Ⅰ.The value of histological grade in breast cancer: experience from a large study with long-term followup[J].Histopathology, 1991, 19: 403-410.
[9]FRIERSON H J JR, WOLBER R A, BEREAN K W, et al.Interobserver reproducibility of the Nottingham modification of the Bloom and Richardson histologic grading scheme for infiltrating ductal carcinoma[J].Am J Clin Pathol, 1995,103: 195-198.
[10]KWOK T C, TAKHA E A, LEE A H, et al.Histological grading of breast cancer on needle core biopsy: the role of immunohistochemical assessment of proliferation[J].Histopathology, 2010, 57: 212-219.
[11]PEROU C M, SORLIE T, EISEN M B, et al.Molecular portraits of human breast tumours[J].Nature, 2000, 406:747-752.
[12]SORLIE T, PEROU C M, TIBSHIRANI R, et al.Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications[J].Proc Natl Acad Sci, 2001, 98: 10869-10874.
[13]SORLIE T, TIBSHIRANI R, PARKER J, et al.Repeated observation of breast tumor subtypes in independent gene expression data sets[J].Proc Natl Acad Sci, 2003, 100:8418-8423.
[14]NIELSEN T O, HSU F D, JENSEN K, et al.Immunohistochemical and clinical characterization of the basal-like subtype of invasive breast carcinoma[J].Clin Cancer Res, 2004, 10: 5367-5374.
[15]GNANT M, HARBECK N, THOMSSEN C.St.Gallen 2011:Summary of the Consensus Discussion[C].Breast Care(Basel).2011, 6(2): 136-141 [Epub 2011 Apr 29].
[16]HAMMOND M E, HAYES D F, DOWSETT M, et al.American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer[J].Arch Pathol Lab Med, 2010, 134: 907-922.
[17]WOLFF A C, HAMMOND M E, SCHWARTZ J N, et al.American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer[J].Arch Pathol Lab Med, 2007, 131: 18-43.
[18]《乳腺癌HER-2检测指南(2009版)》编写组.乳腺癌HER-2检测指南(2009版) [J].中华病理学杂志, 2009,38: 836-840.
[19]CHEANG M C, CHIA S K, VODUC D, et al.Ki-67 index,HER-2 status, and prognosis of patients with luminal B breast cancer[J].J Natl Cancer Inst, 2009, 101(10): 736-750.
[20]VAN DER VEGT B, DE BOCK G H, HOLLEMA H, et al.Microarray methods to identify factors determining breast cancer progression: potentials, limitations, and challenges[J].Crit Rev Oncol Hematol, 2009, 70:1-11.
[21]A multigene assay to predict recurrence of tamoxifen-treated,node-negative breast cancer[J].N Engl J Med, 2004, 351:2817-2826.
[22]BUENO-DE-MESQUITA J M, VAN HARTEN W H, RETEL V P, et al.Use of 70-gene signature to predict prognosis of patients with node-negative breast cancer: a prospective community-based feasibility study (RASTER) [J].Lancet Oncol, 2007, 8: 1079-1087.
[23]IVSHINA A V, GEORGE J, SENKO O, Et al.Genetic reclassification of histologic grade delineates new clinical subtypes of breast cancer[J].Cancer Res, 2006, 66:10292-10301.
[24]CHANG H Y, NUYTEN D S, SNEDDON J B, et al.Robustness, scalability, and integration of a wound-response gene expression signature in predicting breast cancer survival[J].Proc Natl Acad Sci USA, 2005, 102: 3738-3743.

