轻度认知损害和阿尔茨海默病的大脑灰质体积及其与记忆功能的关系☆
阿尔茨海默病(Alzheimer’s disease,AD)是一种中枢神经系统原发性退行性变性疾病,主要临床相为痴呆综合征[1]。轻度认知障碍(mild cognitive impairment,MCI)是介于正常衰老和痴呆之间的一种认知功能损害状态。随着神经影像学的发展,相对于感兴趣区法(region of interest,ROI)的研究,目前使用的基于体素的脑形态学分析(voxelbased morphometry,VBM)技术可更有效地探测到全脑范围内存在萎缩的脑区[2],但是VBM的研究,AD和MCI患者的记忆功能缺陷与大脑灰质体积间关系的研究结论却并不一致[3],考虑主要与使用不同的记忆测查方法,以及仅在AD或MCI单独的样本中研究其与记忆功能的关联有关。所以本研究使用统一的记忆测查工具同时考查记忆功能与AD和MCI的大脑灰质体积间的关系,探索与记忆功能缺陷所相关的脑区体积萎缩基础。
1 对象和方法
1.1 研究对象 选取2007年7月至2008年6月北京大学精神卫生研究所记忆中心研究患者及正常老人库。该中心所有研究对象均接受系统的临床检查和全面的神经认知评估,部分研究对象接受标准化MRI影像学检查。本研究仅选取其中MRI T2加权像白质目测正常者为研究被试,进行基于体素的脑灰质形态学分析。
1.1.1 MCI组 符合 Petersen 等[4]关于 MCI的诊断标准,其操作标准为:①有记忆障碍的主诉,并有知情者证实;②可查出与年龄和文化程度不相符的记忆损害,临床记忆量表指向记忆测验成绩低于同年龄和文化程度常模1.5标准差;③总体认知功能基本正常,简易智能状态检查量表(MMSE)≥24分,临床痴呆评定量表(CDR)=0.5分;④日常生活能力保持正常(基本能完成乘交通工具外出和购物算帐等),日常生活活动能力量表(activities of daily living scale,ADL)≤26分;⑤不符合国际疾病分类第10版(ICD-10)痴呆诊断标准(研究用)[5]。所有研究对象经2007年美国国立神经疾病及交流障碍与脑卒中研究所,AD及相关疾病学会(NINCDS-ADRDA)制定的AD研究用诊断标准核实[6],均不符合AD诊断标准。排除意识障碍以及其他可能引起认知损害的原因,如脑血管疾病(包括脑出血、脑梗死),血清学检查除外叶酸水平低下、VitB12水平低下及甲状腺功能低下,头颅MRI平扫除外脑部梗死灶、软化灶及其他占位性病变等。共入组14例,其中男8例,女6例。年龄64~80岁,病程>6个月。
1.1.2 AD组 入组标准:①符合ICD-10痴呆诊断标准(研究用)[5];②符合 NINCDS-ADRDA 制订的很可能AD诊断标准(1984年版与2007年版)[6];③CDR 评分为 0.5~1 分;④Hachinski缺血指数≤4分。排除标准:①其他可能引起痴呆的原因,如脑血管疾病(包括脑出血、脑梗死),血清学检查除外叶酸水平低下、VitB12水平低下及甲状腺功能低下,头颅MRI平扫除外脑部梗死灶、软化灶及其他占位性病变等;②除外混合性痴呆。共入组56例,其中男14例,女42例,年龄52~95岁。
1.1.3 对照组 广告征集的正常老年志愿者16例,其中男6例,女10例,年龄52~81岁。无记忆障碍主诉、认知功能损害病史。排除可引起脑功能障碍的严重神经系统疾病、严重和不稳定的内科疾病、精神分裂症、情感障碍、药物或酒精滥用史、严重头部外伤、目前服用可以引起认知功能障碍的药物、色盲。3组性别、年龄、受教育年限具有可比性。
本研究获北京大学精神卫生研究所伦理委员会批准,所有研究被试均提供书面知情同意。
1.2 认知功能评估 使用以下三种量表评定:①简易智能精神状态检查量表(mini-mental state examination,MMSE)评估各组被试的总体认知功能[7];②跨文化常见物品记忆测验包括即刻记忆、5分钟延迟回忆和30分钟延迟回忆,分别反映瞬时记忆、短期记忆和延迟回忆;③韦氏逻辑记忆测验(WMS-IIIR)[8]由 3 个不同难度程度的小故事组成,反映被试的逻辑记忆能力。
所有测查由经系统培训的神经心理测查员完成,评定者间一致性良好。完成上述记忆测验时间为45~50分钟。
1.3 影像学检查 本研究采用Siemens 3T MR全身成像系统(德国Siemens TrioTim vision系统)。所有研究被试高分辨率3D颅脑T1加权像通过3D MPRAGE序列获得,扫描参数如下:TR=2530 ms,TE =3.44 ms,TI=1100 ms,层厚 1 mm,视野(FOV)256 mm × 256 mm,矩阵 256× 256,体素 1 mm×1 mm×1 mm,全脑共采集192层轴位图像。同时,本研究对所有研究对象进行常规的MR扫描(T1加权像和T2加权像)。采集图像由2名经验丰富的放射科医师阅读。所有纳入研究的研究对象MRI检查并未发现任何形态学异常,参照Teipel等[9]的方法,所有研究被试白质目测正常。
1.4 影像学数据采集与处理 本研究采用优化VBM分析。所有DICOM图像转换为NIFTI格式,采 用 SPM5(http://www.fil.ion.ucl.ac.uk/spm/software/spm5/)[10]进行偏倚校正后将颅脑高分辨率3D T1加权像分割提取优化的灰质、白质和脑脊液,优化VBM具体流程为:①校正后图像配准至标准T1模板;②)标准化;③分割提取灰质或白质;④按东亚人群大脑模板进行校准;⑤采用标准化参数对分割图像进行调制;⑥高斯平滑处理;⑦将调制参数应用至经处理的灰质图像,则可通过统计分析进行颅脑灰质体积比较。
1.5 统计学方法 采用SPSS 11.5软件进行统计分析。首先对数据进行正态性分布检验,使用适当的转换方法改善数据的正态性分布后再进行进一步的统计分析(如MMSE的分数经log10转换)。非连续变量采用Kruskal-Wallis H检验,连续变量采用方差分析(ANOVA)。VBM分析结果以国际通用的统计参数图表示,取多重比较以Bonferoni校正后以P<0.05为差异有统计学意义。采用SPM5软件的统计功能,将每项记忆测查分数及复合分数作为协变量,将其带入预测灰质体积的广义线性模型。正相关代表被试的体积最高灰质对应最高的记忆评分。
2 结果
2.1 被试人口学特征 本研究共纳入MCI被试14例,轻度AD 56例和正常对照16例进行分析。三组间年龄(F(2)=1.762,P =0.178)、性别分 布(χ2(2)=3.345,P =0.19)和受教育年限(F(2)=0.018,P =0.98)差异无显著性(表 1)。
2.2 记忆功能比较 与正常对照相比,AD患者的物品即刻回忆、5分钟延迟回忆、30分钟延迟回忆、逻辑记忆以及复合记忆评分显著下降(所有t>6.86,均 P<0.05);MCI组逻辑记忆和复合记忆评分显著下降(t分别为 7.29 和 8.62,P<0.05);MCI组各项记忆评分均介于AD与MCI之间,三组间记忆评分呈现AD<MCI<NC趋势(表2)。
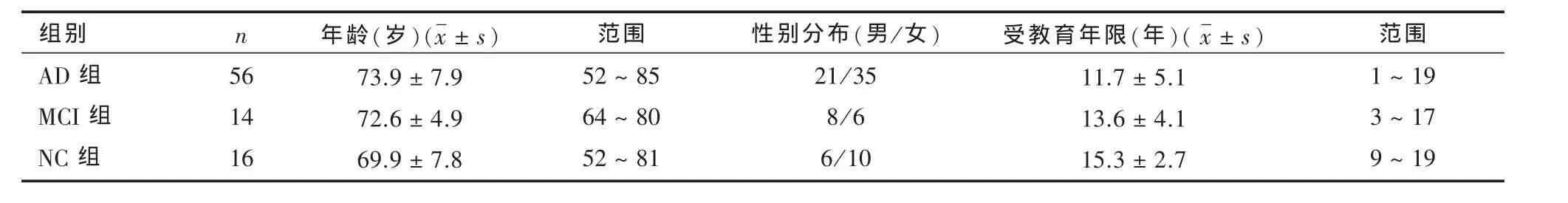
表1 三组被试人口学特征
表2 三组被试认知功能评分比较(±s)

表2 三组被试认知功能评分比较(±s)
1)与NC比较,方差分析后两两比较,P<0.052)与MCI比较,方差分析后两两比较,P<0.05注:均数和标准差均以原始数据表示。统计分析是在适当的数据转换后进行的
组别AD组MCI组NC组n 56 14 16 MMSE评分17.3±5.31,2)26.0±1.9 28.6±2.6物品即刻回忆评分4.0±1.71,2)7.6±1.4 8.1±0.8 5 min延迟回忆评分2.4±2.21,2)7.3±2.5 8.9±1.5 30 min延迟回忆评分1.8±2.31,2)6.9±3.4 8.6±1.4逻辑记忆评分2.2±1.81,2)6.3±3.51)10.6±3.4复合记忆评分10.4±6.91,2)28.1±8.91)36.2±5.7
2.3 三组被试大脑灰质体积比较 与正常对照相比,AD组颞叶、顶叶及额叶存在显著的大脑灰质萎缩(T =5.28~7.38,均 P<0.05);与 MCI 组相比,AD组额叶、顶叶、岛回的萎缩更为严重(T=5.17~7.02,P<0.05)。而 MCI组与正常对照组之间无显著差异,见表3。
2.4 AD组与MCI组灰质体积改变与记忆评分的关系 AD组,颞叶、额叶及顶叶等广泛皮层区域与瞬时物体记忆相关(T =5.23~6.81,均 P <0.01);30分钟物体延迟回忆分数与双侧额上回、丘脑,右侧前扣带回、颞中回、额内侧回、中央旁回灰质体积显著相关(T =4.87~7.37,均 P<0.01)。复合记忆分数与左侧海马旁回、颞中回、楔前叶、额上回、额中回、扣带回以及右侧海马旁回、额内侧回以及额下回的灰质体积密切相关(T =5.45~6.51,均P<0.01,见表4及图 1)而MCI组未发现显著的阈上簇团与这些记忆分数显著相关。(见图1)
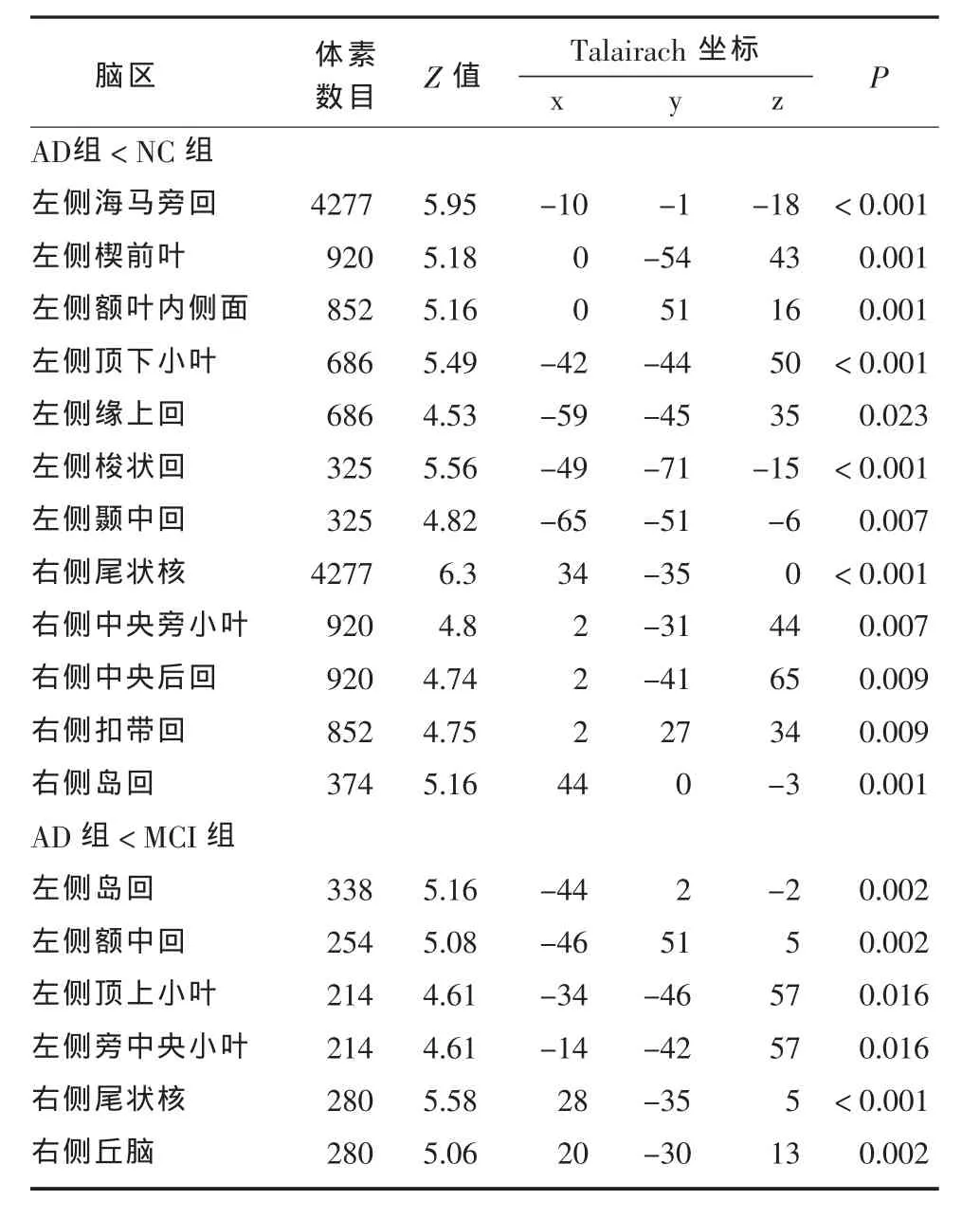
表3 三组被试大脑灰质体积显著差异的脑区(P<0.05,FWE 校正)
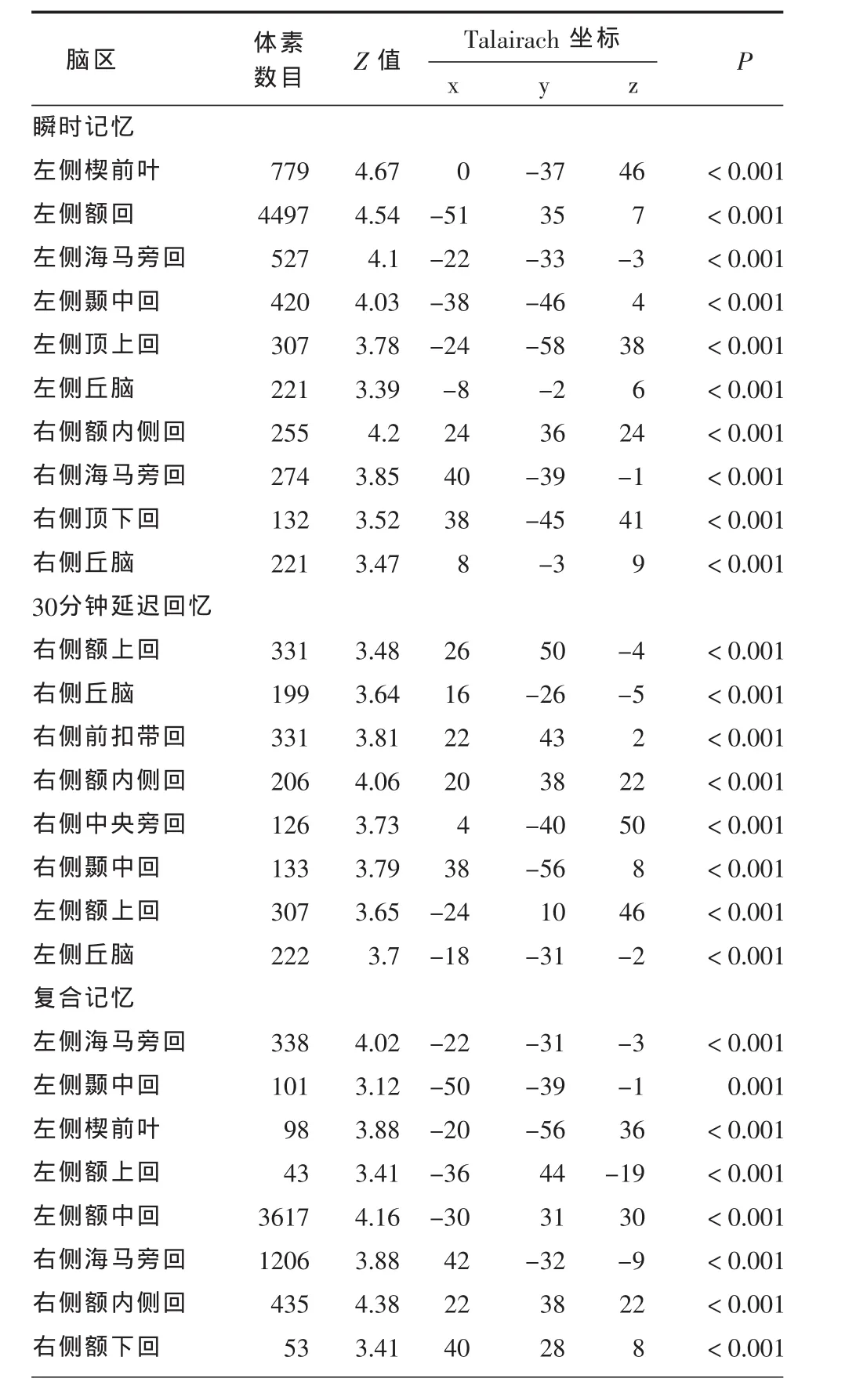
表4 AD组中与各记忆评分相关的脑区(n=56)
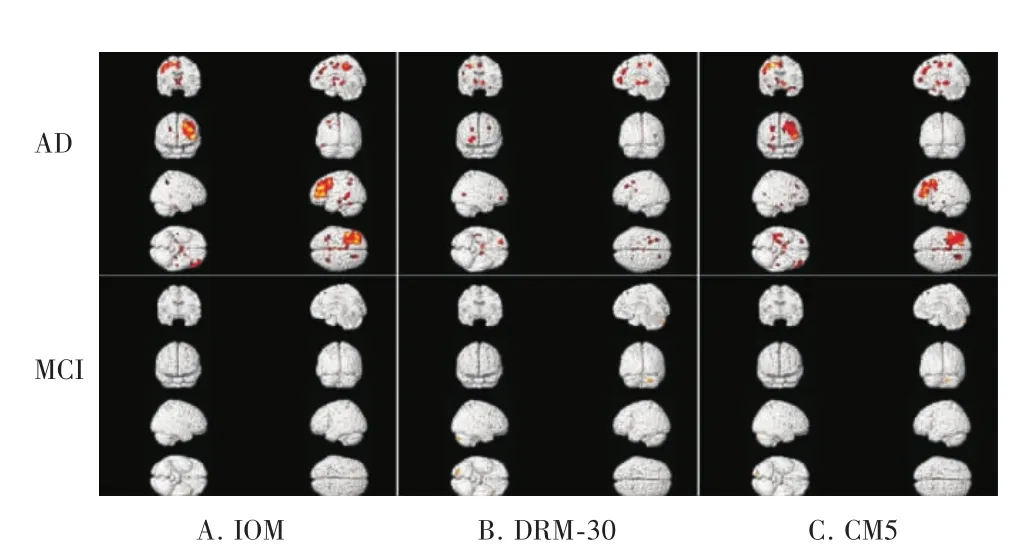
图1 VBM分析记忆功能评分与大脑灰质体积相关性的统计参数图。AD=阿尔茨海默病,MCI=轻度认知损害,IOM=瞬时物体记忆,DRM-30=30分钟延迟回忆,CMS=复合记忆分。
3 讨论
本研究中,MCI和AD患者表现出多个记忆领域受损,与之前的研究一致[11],本研究目的是为了探索这些记忆领域受损的体积基础。正如预测,AD患者在广泛的额、顶、颞叶等脑区均存在显著的大脑灰质体积萎缩,而MCI的脑体积则是介于正常老化和AD之间。在接下来的相关研究中,本研究发现仅在AD患者中,多个记忆领域,包括瞬时记忆、延迟回忆和复合记忆与大脑灰质体积存在正相关。而在MCI组中,并未发现任何记忆领域与大脑灰质体积存在线性相关。
首先,本研究发现在AD组中,瞬时记忆主要与弥漫的大脑皮层灰质体积正相关,这与之前的研究结果基本一致,如Baddeley等研究表明瞬时记忆术语工作记忆范畴,由语音环路、视空间功能和执行功能三大系统构成,而这些系统依赖于全脑多个脑区间的协调作用[12]。
同时,在AD组中,延迟回忆主要与集中于额叶、颞叶的脑区呈正相关,之前有关延迟回忆与脑区间相关的研究结果并不一致,如Di Paola等发现与AD患者延迟回忆相关的脑区主要集中于内嗅皮层[13],Berlingeri等则发现延迟回忆与海马后部和海马旁回脑区相关[14],而 Leube 等将 AD、MCI、NC 视为认知缺陷的连续过程,未发现与延迟回忆相关的脑区[15]。考虑造成差异的原因主要为所使用的延迟回忆的测量工具的差异(如图像回忆和单词回忆)以及分析方法的差异(如使用ROI法,即预先设置了感兴趣的脑区,而忽略了可能的潜在脑区)。
在MCI组,本研究并未发现任何记忆领域与大脑灰质体积存在线性相关。有研究发现,在正常成人中,认知功能与大脑灰质体积呈负相关,即体积越小,认知功能越好,并对此解释为:在大脑发育过程中存在突触删除机制,即在发育过程中删除无效的突触,导致大脑体积减小,认知功能改善,使得大脑体积与认知功能呈负相关,即在正常人群中,是由发育性突触删除机制支配二者间的相关;而在AD患者中,却正与此相反,即脑体积越小、认知功能越差,这种与正常人群的差异可归因于疾病的病理机制,即在AD患者中,病理性机制取代了突触删除机制来支配这二者间的关联。而MCI作为AD与正常老化间的中间状态,其大脑灰质体积与记忆功能间未发现任何相关,可解释为在MCI阶段,疾病的病理机制与突触删除机制处于平衡状态,正是由于这这两种相反的作用机制导致MCI大脑灰质体积与记忆功能间无相关[16]。
本研究仍存在一定局限性。本研究采用优化的VBM技术,进行了结构影像与记忆功能的相关分析,应进一步进行多模态及微结构或功能连接的研究。此外,本研究仅为横断面研究,值得进行追踪观察,从而进一步了解认知功能的演变与影像学特征的关联。
致谢:感谢北京大学第三医院赵强、廖晶协助影像学图像采集,美国加州大学尔湾分校Kevin Head和Daniel Chang协助影像学图像处理与VBM分析,以及北京大学第六医院赵学英、李微协助认知功能测查及研究协调工作。
[1]于欣,肖世富,王华丽,等.老年精神病学[M].第1版.北京:北京大学医学出版社,2008,129-130.
[2]刘洁琼,张新卿.影像学技术在阿尔茨海默病早期诊断中的应用[J].中国神经精神疾病杂志,2007,33(8):510-512.
[3]Ferreira LK,Diniz BS,Forlenza OV,et al.Neurostructural predictors of Alzheimer's disease:a meta-analysis of VBM studies[J].Neurobiol Aging,2011,32(10):1733-1741.
[4]Petersen RC,Smith GE,Waring SC,et al.Mild cognitive impairment: clinical characterization and outcome[J].Arch Neurol,1999,56(3):303-308.
[5]刘平,于欣,汪向东,等.ICD-10精神与行为障碍分类(研究用诊断标准)[M].北京: 人民卫生出版社,1993,31-47.
[6]Dubois B,Feldman HH,Jacova C,et al.Research criteria for the diagnosis of Alzheimer's disease:revising the NINCDSADRDA criteria[J].Lancet Neurol,2007,6(8):734-746.
[7]Folstein MF,Folstein SE,McHugh PR."Mini-mental state".A practical method for grading the cognitive state of patients for the clinician[J].J Psychiatr Res,1975,12(3):189-198.
[8]Wechsler D.Wechsler Memory Scale—Third Edition[M].3rd ed.TX: The Psychological Corporation,1997.
[9]Teipel SJ,Hampel H,Alexander GE,et al.Dissociation between corpus callosum atrophy and white matter pathology in Alzheimer's disease[J].Neurology,1998,51(5):1381-1385.
[10]Ashburner J,Friston KJ.Unified segmentation[J].Neuroimage,2005,26(3):839-851.
[11]布茂振,张聚斓.遗忘型轻度认知障碍和轻度阿尔茨海默病的认知损害特征研究[J].实用心脑肺血管病杂志,2011(9):1472-1474.
[12]Balthazar ML,Yasuda CL,Cendes F,et al.Learning,retrieval,and recognition are compromised in aMCI and mild AD:are distinct episodic memory processes mediated by the same anatomical structures[J].J Int Neuropsychol Soc,2010,16(1):205-209.
[13]Di Paola M,Macaluso E,Carlesimo GA,et al.Episodic memory impairment in patients with Alzheimer's disease is correlated with entorhinal cortex atrophy[J].A voxel-based morphometry study.J Neurol,2007,254(6):774-781.
[14]Berlingeri M,Bottini G,Basilico S,et al.Anatomy of the episodic buffer:a voxel-based morphometry study in patients with dementia[J].Behav Neurol,2008,19(1-2):29-34.
[15]Leube DT,Weis S,Freymann K,et al.Neural correlates of verbal episodic memory in patients with MCI and Alzheimer's disease—a VBM study[J].Int J Geriatr Psychiatry,2008,23(11):1114-1118.
[16]Duarte A,Hayasaka S,Du A,et al.Volumetric correlates of memory and executive function in normal elderly,mild cognitive impairment and Alzheimer's disease[J].Neurosci Lett,2006,406(1-2):60-65.

