猪圆环病毒2型多抗原表位串联在大肠杆菌中表达与反应原性分析
蒋 伟,袁远华,廖晓鸿,苏丹萍,贺东生
(华南农业大学兽医学院,广东 广州 510642)
猪圆环病毒(Porcine circovirus,PCV),无囊膜,直径约17 nm,是最小的动物病毒之一。PCV2感染以断奶仔猪多系统衰竭综合征(PMWS)最为常见。主要感染7周龄~15周龄仔猪,仅有一例感染3周龄新生仔猪的报道[1],临床症状表现为消瘦、呼吸困难、腹泻、可视黏膜苍白,也会伴发皮炎,剖检可见淋巴结肿胀,肾损伤,死亡率较高[2]。
PCV2基因组为一个单链环状DNA,全长为1768 bp或1767 bp。有3个主要的开放阅读框(ORF),ORF1最大,编码病毒的复制蛋白;ORF2是PCV2的重要抗原基因,编码病毒主要结构蛋白(Cap蛋白),与宿主免疫有关,是构建重组疫苗和建立检测方法的首选基因。近年来ORF3基因成为PCV2疫苗研究的热点,Anbu等对天然宿主猪接种了缺失ORF3基因的PCV2,结果表明该变异病毒株会导致温和的并且不出现病理损伤的病毒血症[3]。此研究提示ORF3基因在PCV2对宿主致病性方面的重要作用。
疫苗接种是预防和控制圆环病毒病最有效的办法,本实验将PCV2的抗原表位串联并在大肠杆菌表达,为PCV2基因工程亚单位苗研究奠定基础。
1 材料和方法
1.1 主要实验材料 pMD18-T载体、T4 DNA连接酶、限制性内切酶、IPTG、TaqDNA聚合酶、DNA Marker、DNA片段纯化试剂盒、感受态细胞BL21(DE3)均购自宝生物工程(大连)有限公司;原核表达载体pET32a(+)和兔抗PCV2阳性血清由本实验室保存;蛋白纯化试剂盒6×His-Tagged Protein Purification KitNi-Agarose His购自北京康为世纪生物科技有限公司;PCV2 ELISA试剂盒购自武汉科前动物生物制品有限公司;辣根过氧化物酶(HRP)标记羊抗兔IgG购自广州展晨生物科技有限公司。
1.2 重组表达质粒的构建 将PCV2的ORF2中aa 156~aa 162、aa 175~aa 192、aa 195~aa 202、aa 231~aa 233和ORF3中aa 31~aa 50串联构成一个连续的阅读框,人工合成编码该融合蛋白的DNA,基因密码子的选择兼顾大肠杆菌的偏爱性,并在DNA序列的两端加上EcoRⅤ和XhoⅠ酶切位点,DNA全长180 bp由上海Invitrogen有限公司合成,新基因命名为HJW,其DNA序列所编码的氨基酸序列见表1。将HJW连接至pMD18-T中,将重组质粒及pET32a(+)进行EcoRⅤ和XhoⅠ双酶切并连接,得到重组表达质粒pET-HJW(图1)。
1.3 重组蛋白诱导表达 将pET-HJW转化到大肠杆菌BL21感受态细胞,挑菌培养,经IPTG诱导4 h,取菌液进行SDS-PAGE检测重组蛋白的表达。
1.4 重组蛋白的纯化和浓度测定 一部分菌液用于分析总蛋白,另一部分用于提取包涵体蛋白。在纯化的包涵体中加入8 mol/L尿素,冰上1 h,使蛋白质充分溶解变性,5000 r/min离心后取上清液,上清采用Ni-NTA树脂化,具体方法按说明书进行。重组蛋白经纯化后,经分光光度计测定,确定纯化后重组蛋白的浓度,计算重组蛋白的表达量。
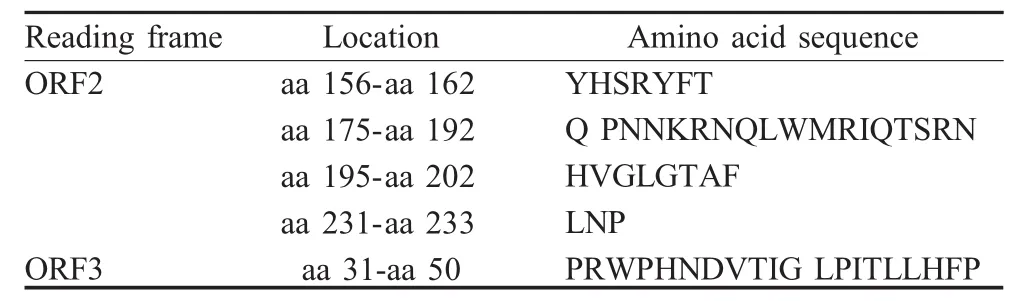
表1 HJW的氨基酸序列Table 1 The amino acids sequences of HJW

图1 pET32a(+)-HJW的构建Fig.1 Construction of pET32a(+)-HJW
1.5 重组蛋白反应原性分析
1.5.1 Western blot鉴定 表达产物经SDS-PAGE分离后,电转移至 PVDF膜,以 1∶2000倍稀释的PCV2阳性兔多抗血清为一抗,以1∶1500倍稀释的HRP标记羊抗兔IgG为二抗进行western blot,室温孵育30 min,DAB溶液显色。
1.5.2 间接ELISA 将重组蛋白稀释至工作浓度,4℃过夜,加入封闭液37℃封闭30 min。另取ELISA试剂盒抗原包被板4孔阴阳性对照各两孔,加入阴、阳性血清,37℃结合45 min。每孔加入100 μL工作浓度的酶标记抗体,37℃结合30 min。每孔先后加入底物A液和底物B液,密封37℃避光作用 10 min,加入终止液,10 min内测定OD630nm值。当阳性对照OD630nm值≥0.7、阴性对照OD630nm值<0.3时试验条件成立,此时如被检样品OD630nm值>0.42即判为阳性。
2 结果与讨论
2.1 pET-HJW的构建 从重组菌液提取质粒,经电泳、PCR、酶切、测序鉴定重组质粒,结果表明目的片段已插入载体中(图2),并且读码框正确。
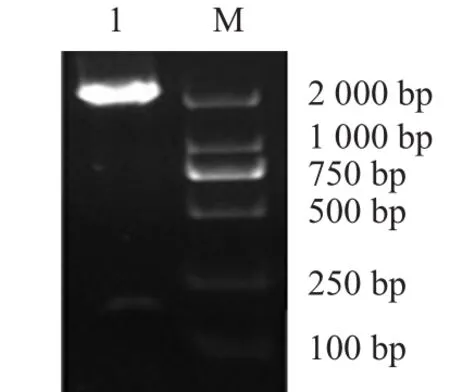
图2 pET-HJW基因双酶切电泳图Fig.2 Restriction enzyme digestion
2.2 重组蛋白表达、纯化及鉴定 SDS-PAGE结果显示,pET-HJW转化至大肠杆菌并经IPTG诱导后,重组蛋白获得表达,分子质量与预期相符(图3)。包涵体溶解液溶解后经Ni亲和柱纯化,分别用不同浓度咪唑洗脱后收集各组分,对纯化的包涵体透析复性后离心收集上清与沉淀。

图3 表达蛋白SDS-PAGE分析Fig.3 SDS-PAGE analysis of recombinant prtotein expression
2.3 重组蛋白浓度测定 PCV2 ORF2基因中存在大肠杆菌稀有密码子,尤其是在ORF2基因编码的N端有41个氨基酸为核定位信号,但不包含主要的抗原区域,而且N端存在大量大肠杆菌的稀有密码子(约占30%),并以串联形式存在,这将会严重影响外源蛋白的表达[4]。本实验通过密码子优化,经检测表达后的重组蛋白浓度达到206.2 mg/L,表明重组蛋白得到了高效的表达。
2.4 重组蛋白western blot检测 重组蛋白经western blot检测,出现一条特异性条带,约为27 ku(图4),表明该重组蛋白能够被PCV2灭活兔血清特异性识别。
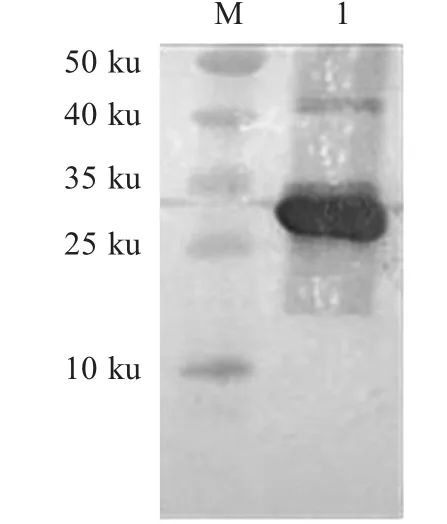
图4 重组蛋白western blot分析Fig.4 Western blot analysis of recombinant protein
2.5 间接ELISA鉴定 酶标仪读数显示实验组OD630nm值为0.465>0.42,表明重组蛋白具有反应原性。Shang等利用PCV2衣壳蛋白单克隆抗体(MAb)将PCV2的抗原表位精确地定位于ORF2基因所编码氨基酸的156~162位、175~192位、195~202位和231~233位[5]。Stevenson等采用MAb和抗原表位分析,证明T淋巴细胞与PCV2的免疫反应主要取决于ORF3(氨基酸残基31~50位)和ORF1(氨基酸残基81~100位和201~220位)非结构蛋白的抗原表位[6]。通过反应原性分析,实验所得结果与其相符。
国外针对PCV2疫苗的研究已取得重要进展,但因其价格昂贵而不能在集约化猪场普及使用。本实验利用大肠杆菌表达目的蛋白,不仅操作简单,而且其表达的重组蛋白具有良好的反应原性,表达量也比其他表达方式高,因此利用大肠杆菌表达PCV2抗原蛋白作为基因工程亚单位疫苗的可行性较高。这将为PCV2的疫苗研制、诊断抗原和防控提供有价值的参考。
[1]Hirai T,Tnunoya T,Ihara T,et al.Dual infection with PCV2 and porcine epidemic diarrhoea vi-rus in neonatal piglets[J].Vet Rec,2001,148(15):482-484.
[2]Madec F,Frose N.Postweaning multisystemic wasting syndrome and other PCV2 related problems in pigs:a 12-year experience[J].Transbound Emerg Dis,2008,55(7):273-283.
[3]Karuppannan A K,Jong M H,Lee S H,et al.Attenuation of porcine circovirus 2 in SPF piglets by abrogation of ORF3 function[J].Virology,2009,383(2):338-347.
[4]Mahé D,Blanchard P,Truong C,et al.Differential recognition of ORF2 protein from type 1 and type 2 porcine circoviruses and identification of immunorelevant epitopes[J].J Gen Virol,2000,81:1815-1824.
[5]Shang Shao-bin,Jin Yu-lan,Jiang Xue-tao,et al.Fine mapping of antigenic epitopes on capsid proteins of porcine circovirus,and antigenic phenotype of porcine circovirus Type 2[J].Mol Immunol,2009,46:327-334.
[6]Stevenson L S,Glipi D F,Douglas A,et at.T lymphocyte epitope mapping of porcine circovirus type 2[J].Viral Immunol,2007,20(3):386-397.

