芝麻素对C57BL/6小鼠Lewis肺癌的抑制作用及其机制
杨 慧,杨解人,唐丽娟,张俊秀,李文星,王宏婷,陈国祥
(皖南医学院 药理学教研室,安徽 芜湖 241002)
Ses为芝麻籽中的木酚素类成分,具有抗高血压、保护肝脏、抗氧化、抑制癌细胞、调节免疫功能、降低胆固醇等作用[1]。日本东京大学医学院首次研究证实Ses具有抗癌功效,对肝癌、皮肤癌有抑制作用,认为低浓度的Ses饮食可能作为肝癌形成的抑制剂[2]。国内文献报道Ses对S180荷瘤小鼠有显著的抑瘤作用,其机制可能与促进宿主免疫功能、抑制肿瘤细胞内增殖细胞核抗原表达有关[3];Ses有明显抑制肝癌H22细胞增殖的作用[4],但对Lewis的研究未见报道。因此本研究采用体内和体外血清药理学实验方法,观察Ses对C57BL/6小鼠Lewis肺癌的抑瘤作用,旨在进一步阐明Ses的抗肿瘤作用及其可能机制。
1 材料和方法
1.1 动物 雌性C57BL/6小鼠40只,体重(20±2)g,合格证号:SCXK20070001(购自南京青龙山实验动物中心)。普通饲料喂养,自由进食饮水,室温(22~24)℃。
1.2 药物与试剂 Ses,分子式:C20H18O6,分子量:354.36,纯度>94%,由芜湖天一绿宝科技有限公司提供,批号:04312;5-Fu:50 mg/片,100 片/瓶,批号:H37021326(齐鲁制药有限公司)。SABC免疫组化试剂盒(SA1022),购自武汉博士德生物工程有限公司;MMP-2一抗(ZA-0331)、MMP-9一抗(ZA-0336)购自北京中杉金桥生物技术有限公司。DMEM高糖培基(Hyclone公司)、优级胎牛血清(杭州四季青公司)、MTT(Amresco)。
1.3 仪器 CO2水套培养箱(Forma Scientific)、CBV-1500A高性能超净工作台(上海瑞仰净化装备公司)、酶标仪(DTX880 Multimode Detector,Beckman Coulter)、高速冷冻离心机(Heraeus)、-80℃冰箱(Forma Scientific)。
1.4 细胞培养 将Lewis肺腺癌细胞株(LLC,为C57BL/6小鼠源性肺腺癌细胞,上海生命科学研究院细胞库提供)培养于含10%胎牛血清、100 U/ml青霉素、100μg/ml链霉素的DMEM培养液中,在37℃ 5%CO2培养箱中传代培养。待细胞生长至80%~90%密度时,用0.25%胰蛋白酶消化,按1∶2传代。
1.5 体内实验
1.5.1 模型建立、分组及给药 将对数生长期的Lewis肺癌细胞(5×106/ml),按0.2 ml/只分别接种于40只雌性C57BL/6小鼠右前肢腋部皮下,复制小鼠Lewis肺癌模型。10日后待肉眼可见右腋部肿块视为造模成功。将成模小鼠40只,随机分为模型组[0.5%羧甲基纤维素10 ml/(kg·d)]、Ses低、中、高剂量组[30、60、120 mg/(kg·d)]和阳性对照组[5-Fu 128 mg/(kg·d)],共5 组,每组8 只。Ses用0.5%羧甲基纤维素制成混悬液,5-Fu溶于蒸馏水中,于每日上午9时灌胃给药[10 ml/(kg·d)]1次,连续给药28 d。
1.5.2 监测瘤体积、绘制肿瘤增殖曲线 称每日进食量及每周小鼠体重,每隔3 d用游标卡尺测肿瘤长、短径1次,并计算瘤体积,瘤体积=0.5ab2(a长径,b短径),根据瘤体积经时变化绘制肿瘤增殖曲线。
1.5.3 计算肿瘤抑制率及脏器系数 末次给药后称重并处死小鼠,完整剥离肿瘤称瘤重,称脾、胸腺湿重,计算肿瘤抑制率和脏器系数。

1.5.4 观察瘤组织病理学改变 剥取瘤组织,用10%甲醛固定24 h,常规石腊包埋、切片,HE染色,光镜下观察瘤组织病理学改变。
1.5.5 免疫组化法表达MMP-2、MMP-9 将肿瘤组织常规病理取材,石蜡包埋,4μm连续切片,二甲苯脱蜡,染色程序严格按照试剂盒步骤进行,DAB显色,苏木素复染,中性树胶封片观察。结果判断:MMP-2、MMP-9阳性表达均为肿瘤细胞胞膜或胞质呈棕黄色。所有染色切片在同一条件下采用ImageJ图像分析软件进行半定量分析,每张切片随机选取5个完整而不重叠的高倍镜视野(400×),测定每个视野下阳性反应的平均灰度值。阳性表达水平应用平均灰度值(±s)表示,最黑像素的灰度值为0,最白像素的灰度值为255,灰度值愈小其阳性表达水平愈高,反之则表达水平愈低。
1.5.6 ELISA法检测TNF-α水平 瘤组织匀浆、离心后,取其上清液,于96孔包被板中设置6个标准品孔,并设置空白对照孔和样本孔。严格按照试剂盒步骤进行,酶标仪检测450 nm波长处OD值,通过标准曲线查找待测样品TNF-α水平。
1.6 体外实验
1.6.1 含药血清的制备 运用血清药理学方法,收集动物含药血清。取Wistar大鼠20只,根据前期试验结果随机分成两组,即 Ses组[160 mg/(kg·d)]、空白对照组[生理盐水10 m l/(kg·d)],每组10只,连续灌胃给药14 d,于末次给药后2 h,腹主动脉取血,离心管中静置1 h,4℃、3 000 r/min离心10 min,无菌分离血清后,56℃恒温灭活30 min,于0.22μm微孔滤膜过滤除菌,置-20℃冰箱保存备用。
1.6.2 Ses含药血清组培养液制备 见表1。
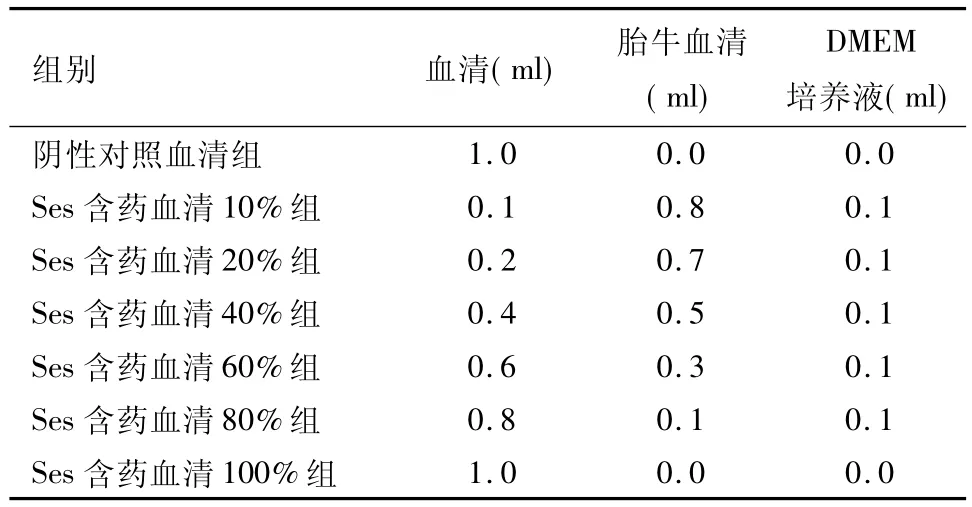
表1 各组含药血清培养液配置Tab1 Solution preparation of the serum containing Ses in each group
1.6.3 MTT法检测细胞抑瘤率 取对数生长期的Lewis肺癌细胞,用含10%胎牛血清(FBS)的DMEM培养液调整细胞数为2×105/ml~5×105/ml,加入96孔培养板,每孔200μl,37℃、5%CO2培养箱中过夜,待细胞贴壁约70%~80%时,弃去细胞培养液,分别加入 Ses 10%、20%、40%、60%、80%、100%含药血清各20μl,阴性对照组加入含生理盐水血清 20μl,每组设5个复孔,每孔终体积为200μl,不足部分加入含10%FBS的 DMEM培养液。于37℃、5%CO2培养箱孵育48 h后,每孔加入5 mg/ml的MTT 20μl继续培养4 h,吸去各孔中的上清液,每孔再加入DMSO 200μl,置摇床上低速振荡10~15 min,在492 nm处测定OD值,计算抑瘤率。

2 结果
2.1 体内实验
2.1.1 Ses对肿瘤增殖曲线的影响及对肿瘤体积经时变化影响 根据不同时期各组体积均数及标准差绘制肿瘤增殖曲线(图1)。从接种第14天开始,Lewis肺癌细胞进入快速增殖期。由图1可见,5-Fu组肿瘤细胞增殖受到明显抑制(P<0.05),Ses低、中、高剂量组也有一定的抑制肿瘤细胞增殖的趋势,但作用不明显(P>0.05)。接种后第38天小鼠肿瘤生长体积,与模型组相比,5-Fu组有统计学意义(P<0.05),Ses低、中、高剂量组虽无统计学差异(P>0.05),但随着剂量的加大,肿瘤体积有减小趋势;与5-Fu组相比,Ses低、中、高剂量组无差异(P>0.05)。提示Ses具有轻度的抑制小鼠肿瘤体积生长的作用。

图1 肿瘤增殖曲线Fig1 The curve for tumor proliferation
2.1.2 Ses对瘤重及肿瘤抑制率的影响 与模型组相比,小鼠给药28 d后,Ses低、中、高剂量组虽无统计学意义(P>0.05),但瘤重随着剂量的增加呈逐渐递减趋势,5-Fu组瘤重明显减轻,具有显著的统计学意义(P<0.01);Ses低、中、高剂量组肿瘤抑制率分别为11.16%、15.14%、18.66%。提示 Ses具有一定的减轻瘤重的作用(图2)。
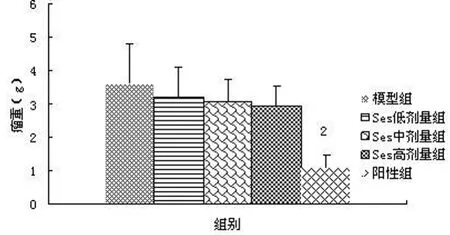
图2 Ses对小鼠瘤重的影响Fig2 Effects of Ses on the weight of tumors
2.1.3 Ses对脾脏及胸腺脏器系数的影响 由图3、4可见,模型组脾脏系数较高,考虑可能与肿瘤的刺激引起反应性增生有关[5]。与模型组相比,Ses低剂量组、5-Fu组小鼠的脾脏系数明显降低,有统计学意义(P<0.05或P<0.01),Ses中、高剂量组无统计学意义(P>0.05);与阳性组相比,Ses低、中、高剂量组脾脏系数明显升高(P<0.01或P<0.05),并且随着Ses剂量的增加,脾脏系数逐渐升高。模型组胸腺系数较低,可能与肿瘤产生的某种活性因子导致胸腺缩小有关[6]。与模型组相比,Ses低、中、高剂量组胸腺系数均有所升高,其中Ses高剂量组升高最为明显(P<0.05),5-Fu组胸腺系数无统计学意义(P>0.05)。提示Ses有免疫增强作用,而5-Fu有免疫抑制作用。
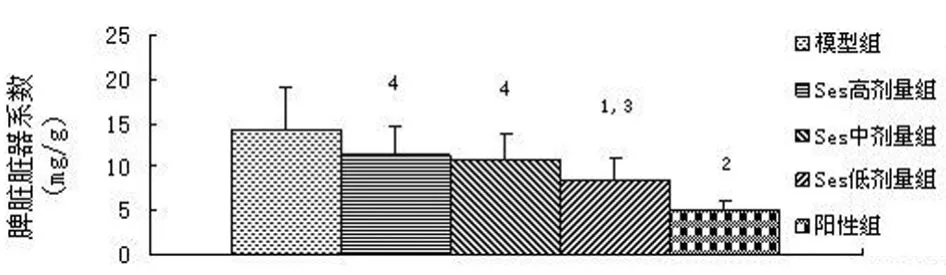
图3 Ses对小鼠脾脏脏器系数的影响Fig3 Effects of Ses on spleen coefficient

图4 Ses对小鼠胸腺脏器系数的影响Fig4 Effects of Ses on thymus coefficient
2.1.4 Ses对肿瘤组织形态学变化 模型组瘤体切面呈鱼肉状,易出血,与周围组织粘连紧密不易剥离,光镜下可见肿瘤细胞排列紧密,核大深染,核分裂像多见。Ses组肿瘤组织呈圆形或椭圆形,包膜大部分完整,表面光滑,血管较少,切面呈灰白与暗红相间,瘤体与周围组织较易剥离,光镜下可见Ses高剂量组瘤细胞排列较稀疏,小片状坏死区,有核固缩、溶解的现象。Ses中、低剂量组瘤细胞排列较松散,但坏死细胞较少;5-FU组瘤细胞生长不良,可见大片状完全性坏死,血管稀少,可见肿瘤异型性及淋巴细胞等炎细胞的浸润(图5)。
2.1.5 Ses对肿瘤组织中MMP-2、MMP-9表达的影响 免疫组化图像分析显示,MMP2、MMP9主要表达于肿瘤细胞胞浆内,呈棕黄色颗粒。与模型组相比,Ses高剂量组MMP-2、MMP-9灰度值表达有统计学意义(P<0.05),Ses低、中剂量组灰度值表达无统计学意义(P>0.05),但有逐渐升高趋势,表明阳性表达量是逐渐降低;与5-Fu组相比,Ses低、中剂量组MMP-2、MMP-9灰度值有统计学意义(P<0.05或P<0.01),而Ses高剂量组无统计学意义(P>0.05)。提示Ses具有一定的剂量依赖性降低肿瘤组织中MMP-2、MMP-9的表达(见图6~9)。
2.1.6 Ses对瘤组织中TNF-α含量的影响 与模型组相比,5-Fu组瘤组织中TNF-α含量降低,差异有显著统计学意义(P<0.01);Ses低、中、高剂量组TNF-α表达无统计学意义(P>0.05),但随着剂量的增加,瘤组织TNF-α含量呈逐渐递减趋势(图10)。
2.2 体外实验Ses含药血清对Lewis肺癌细胞增殖的影响 与阴性血清对照组相比,Ses含药血清80%、100%组OD值均有显著统计学意义(P<0.01或P<0.05),提示Ses含药血清呈浓度依赖性抑制Lewis肺癌细胞的生长,浓度越高,抑制率越高,Ses含药血清100%组增殖抑制率达到37.08%。表明Ses在体外对Lewis肺癌细胞有一定的抑制作用(图11、12)。
3 讨论
体内实验证明40只小鼠皮下接种Lewis肺癌细胞后第10日成瘤率达100%,同时外观小鼠整体状况较差,进食量和活动量均减少,皮毛无光泽,竖毛现象明显,肿瘤体积较大,14 d时增殖速度加快,脾脏系数较高,胸腺系数较低,瘤体切面呈鱼肉状,易出血,与周围组织粘连紧密不易剥离,光镜下可见肿瘤细胞排列紧密,核大深染,核分裂像多见,其结果与文献报道一致[7],表明造模成功。
模型小鼠经5-Fu治疗后,发现小鼠肿瘤体积和增殖速度明显减慢,抑瘤率达69.34%;瘤细胞生长不良,大片状完全性坏死,血管稀少,可见肿瘤异型性及淋巴细胞等炎细胞的浸润,说明5-Fu具有明显抗肿瘤作用。但随着给药时间的延长,动物消瘦加剧,进食量减少,皮毛缺乏光泽,伴有竖毛等现象,部分动物毛发脱落现象严重,甚至毛发变白,并出现胸腺萎缩,提示5-Fu在发挥抗肿瘤作用同时,具有免疫抑制和严重毒性作用。
与模型组相比,Ses组小鼠肿瘤生长体积、增长速度及抑瘤率疗效较弱。该结果与文献报道小剂量Ses对肝癌、皮肤癌、S180荷瘤小鼠及肝癌H22细胞有显著的抑制作用[2~4]不完全一致,分析其原因可能与Ses对Lewis肺癌细胞敏感性较低,或与Ses的剂量偏小或疗程偏短有关,值得进一步研究和探讨。
本研究新发现,随着剂量增加,Ses组小鼠肿瘤组织呈圆形或椭圆形,包膜大部分完整,表面光滑,血管较少,切面呈灰白与暗红相间,瘤体与周围组织较易剥离,光镜下可见瘤细胞排列较稀疏,小片状坏死区,有核固缩、溶解的现象。尤其在实验过程中发现,Ses组小鼠进食正常、活动自如、毛顺光滑有光泽,无脱毛、体重减轻等现象,而且小鼠脾脏系数、胸腺系数逐渐升高,提示Ses在发挥抗肿瘤作用同时,不仅毒性低,而且具有免疫增强的作用。其免疫增强机制可能与Ses促进宿主免疫功能、抑制肿瘤细胞内增殖细胞核抗原表达有关[3]。

图5 Ses对HE染色瘤组织的病理学影响(400×)Fig5 Effects of Ses on histol ogical specimens of tumor tissue(HE staining×400)

图6 Ses对肿瘤组织中MMP-2灰度值的影响Fig6 Effects of Ses on gray scale of MMP-2 in tumor tissue
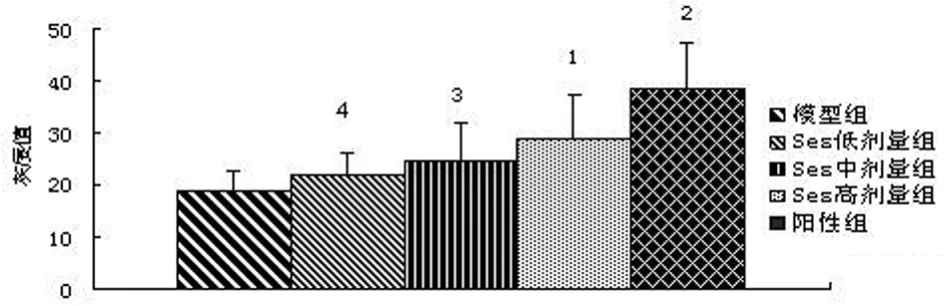
图7 Ses对肿瘤组织中MMP-9灰度值的影响Fig7 Effect of Ses on gray scale of MMP-9 in tumor tissue

图8 Ses对免疫组化表达肿瘤组织MMP-2含量的影响(400×)Fig8 Effect of Ses on content of MMP-2 in tumor tissue by immunohist ochemist r y(400×)

图9 Ses对免疫组化表达肿瘤组织MMP-9含量的影响(400×)Fig9 Effect of Ses on content of MMP-9 in tumor tissue by immunohist ochemi st r y(400×)
肿瘤细胞与细胞外基质的相互作用在肿瘤的侵袭和转移中也起到关键作用。文献报道,肿瘤细胞侵袭转移能力与其产生或诱导产生的降ECM的蛋白酶密切相关[8]。在肿瘤的侵袭过程中,肿瘤细胞与ECM表面的整合素受体及各种非整合素受体结合,如层粘连蛋白,纤连蛋白等,结合后的肿瘤细胞直接分泌基质金属蛋白酶(MMPs)或诱导宿主细胞产生MMPs。MMPs是一类Zn2+依赖的细胞外蛋白水解酶,几乎能降解ECM的所有成份,肿瘤细胞沿着降解破坏的ECM向周围组织侵袭,导致肿瘤的扩散和转移[9]。ECM和基底膜的主要结构蛋白是Ⅳ型胶原,而MMP-2和MMP-9是降解Ⅳ型胶原最主要的酶,故在肺癌的侵袭和转移中起着十分重要的作用[10]。本研究发现,模型组小鼠Lewis肺癌肿瘤组织中MMP-2及MMP-9呈高表达,而Ses高剂量组可明显抑制小鼠Lewis肺癌肿瘤组织中MMP-2及MMP-9的表达,提示Ses抑制肿瘤发展及转移可能与降低肿瘤组织中MMP-2及MMP-9的表达有关。进一步研究发现5-Fu组瘤组织中TNF-α含量明显低于模型组,而Ses各剂量组虽有下降趋势,但无统计学意义,其原因有待进一步研究和证实。

图10 Ses对瘤组织中TNF-α含量的影响Fig10 Effect of Ses on content of TNF-ɑin tumor tissue

图11 Ses含药血清对Lewis肺癌细胞增殖OD值的影响Fig11 Effects of serum containing Ses on value of OD in 2LL tumors

图12 Ses含药血清对Lewis肺癌细胞抑制率的影响Fig12 Effects of serum containing Ses on inhibition ratio of 3LL tumors
为了进一步证实Ses的抗肿瘤作用,本研究采用血清药理学方法,进行体外MTT比色法测定,观察对Lewis肺癌细胞株存活和生长情况,结果发现Ses含药血清对Lewis肺癌细胞的存活和生长具有明显的抑制作用,且呈浓度依赖性,该结果为Ses治疗肺腺癌提供了一定的理论依据,但关于Ses确切抗肺腺癌的疗效及机理有待于进一步研究和探讨。
[1]张世卿,张永城,魏艳静,等.芝麻素的研究进展[J].氨基酸和生物资源,2005,27(3):17-21.
[2]沈旭丽.芝麻的营养成分及保健价值[J].中国食物与营养,2006,(7):51-52.
[3]魏艳静,卞红磊,余文静,等.芝麻素对S180荷瘤小鼠抗肿瘤作用研究[J].时珍国医国药,2008,19(5):1075-1076.
[4]魏艳静,卞红磊,余文静,等.芝麻素对肝癌H22细胞增殖及H22荷瘤小鼠肿瘤生长的影响[J].中草药,2008,39(8):1222-1224.
[5]何胜利,陈四荣,高勇,等.肺癌患者血清 IL-12、IL-18、STNFRS水平及其与临床病理生理特征的关系[J].中国临床医学,2008,15(5):618-620.
[6]李秀娟,刘福英,张焕铃,等.复肝春6号对H22荷瘤小鼠的抑瘤及免疫调节作用[J].中国老年学杂志,2006,26(1):92-93.
[7]吴红英,王月英,李德冠,等.IRM-2小鼠移植性肿瘤模型的生物学行为[J].中国比较医学杂志,2008,18(12):42-44.
[8]任刚,李强.X线照射对Lewis肺癌小鼠 MMP-9、VEGF表达的影响[J].山东医药,2010,50(21):25-26.
[9]曹立明,彭瀚涛.基质金属蛋白酶MMP-2,MMP-9与肺癌的侵袭和转移[J].国外医学、生理、病理科学与临床分册,2002,22(5):467-469.
[10]J ROLLIN,S RÉGINA,P VOURC'H,et al.Influence of MMP-2 and MMP-9 promoter polymorphisms on gene expression and clinical outcome of non-small cell lung cancer[J].Lung Cancer(Amsterdam,Netherlands),2007,56(2):273-280.

