国产氟哌噻吨美利曲辛人体生物等效性研究
张钰哲,孟庆芳,程远国*
(1.大理学院基础医学院,云南大理 671000;2.军事医学科学院微生物流行病研究所,北京 100071)
国产氟哌噻吨美利曲辛人体生物等效性研究
张钰哲1,孟庆芳2,程远国2*
(1.大理学院基础医学院,云南大理 671000;2.军事医学科学院微生物流行病研究所,北京 100071)
目的:研究单剂量口服国产和进口氟哌噻吨美利曲辛片在健康受试者体内的药动学特征,评价其是否具有生物等效性。方法:采用随机、双交叉试验设计。22名健康男性受试者分别单次口服氟哌噻吨美利曲辛片10 mg(2片)后血浆中氟哌塞吨和美利曲辛的浓度采用LC-MS/MS法检测,药动学参数用SigmaPLot 2001和Orign 6.0软件程序计算。结果:国产和进口制剂中氟哌噻吨峰浓度Cmax分别为164.8±55.2和161.5±51.9 pg·mL-1;达峰时间Tmax分别为9.0±4.5和9.6±3.9 h,AUC0→t分别为5 622±2 243和5 412±1 677 pg·h-1;美利曲辛Cmax分别为10.9±6.2和9.6±4.4 ng·mL-1;Tmax分别为4.7±0.9和4.4±1.1 h。AUC0→t分别为312±155和291± 139 ng·h-1;国产及进口制剂的Cmax、AUC0→120h、AUC0→∞等药动学参数经对数转换后的统计学处理(方差分析及双单侧t检验),国产与进口制剂药物间差异均无统计学意义(P>0.05)。国产制剂的相对生物利用度氟哌噻吨为103.2±19.9%,美利曲辛为107.1± 14.5%(n=22)。结论:国产与进口氟哌噻吨美利曲辛片具有生物等效性。
氟哌塞吨;美利曲辛;LC-MS/MS法;药动学;生物等效性
氟哌噻吨美利曲辛是由两种非常有效的化合物组成的合剂。氟哌噻吨是一种神经阻滞剂,小剂量具有抗焦虑和抗抑郁作用;美利曲辛是一种双相抗抑郁剂,低剂量应用时具有兴奋性。两种成份的合剂具有抗抑郁、抗焦虑和兴奋性〔1〕。临床上主要用于治疗轻、中型焦虑、神经衰弱、心因性抑郁、抑郁性神经官能症、隐匿性抑郁、心身疾病伴焦虑和情感淡漠,更年期抑郁、嗜酒及药瘾者的焦躁不安及抑郁。与同类型的其他药物相比,该药具有毒副作用小、疗效好的特点。本试验研究了国产氟哌噻吨美利曲辛片与进口氟哌噻吨美利曲辛片的人体相对生物利用度,并评价两者的生物等效性,为国产药临床合理用药提供理论依据。
1 材料与方法
1.1 药品及试剂国产氟哌噻吨美利曲辛片,湖南华纳大药厂有限公司生产,批号20080411,规格:美利曲辛10 mg/片,氟哌噻吨0.5 mg/片。参比试剂:进口氟哌噻吨美利曲辛片,丹麦灵北制药公司生产,批号1056,规格:美利曲辛10 mg/片,氟哌噻吨0.5 mg/片。莫沙必利(内标),沈阳药科大学药物制剂教研室提供,含量99.5%。甲醇、乙腈为色谱纯,购自美国Sigma公司;甲酸为色谱纯,购自美国Tedia公司;其他试剂为分析纯。
1.2 仪器AgiLent 1100型高效液相色谱仪(美国安捷伦公司),API4000三重四级杆串联质谱仪,配有电喷雾离子源(ESI),AgiLentRXC8(2.1 mm×150 mm,5μm),TDL5M台式大容量冷冻离心机。
1.3 色谱条件液相条件:分析柱为AgiLent RXC8柱(2.1 mm×150 mm,5μm),流动相为乙腈-水-甲酸=60∶40∶0.1(V∶V∶V),流速为0.20 min-1;柱温25℃。进样体积20μL,分析时间4 min。质谱条件:离子源为电喷雾离子源,正离子扫描;碰撞气(coLLision gas)压力5 p.s.i.;气帘气(curtain gas)压力10 p.s.i.;源内气体1(GS1,N2)流速65 p.s.i.;源内气体2(GS2 N2)流速65 p.s.i.;离子源喷雾电压(ion spray voltage),4 500 V;离子源温度650℃。Q1、Q3分辨率均设置为unit。用于定量分析的离子通道分别为氟哌噻吨435.3/305.1,美利曲辛292.2/247.2,莫沙必利422.2/198.1。
1.4 试验设计本研究采用随机、开放、交叉的设计〔2〕。22名男性健康受试者,年龄(24.9±1.3)岁;身高(173.56±5.23)cm;体重(65.96±6.33)kg,体重偏差不超过中国人标准体重的10%,体质指数(BMI)为(21.9±1.3)kg·m-2。体格检查和实验室检查(ECG、临床血、尿常规和血生化)均属正常。所有受试者试验前在自愿的基础上签署知情同意书。受试者在试验前2周内未服用任何其他药物,试验期间禁烟、酒、茶及含咖啡因的饮料。
本研究为单次剂量给药试验,采用两制剂随机双交叉试验设计。受试者随机分为2组,第1周期I组服试验制剂1片(含美利曲辛10 mg,氟哌噻吨0.5 mg),II组服参比制剂1片(美利曲辛10 mg/片,氟哌噻吨0.5 mg);经14 d清洗期后,I、II两组交换服药品种进行第2周期试验。服药前(0 h)及服用后0.5、1、2、3、4、5、6、8、11、15、24、36、48、72、96、120 h由肘静脉采血3 mL,血样置于肝素化试管中,立即离心(3 000 r·min-1,15 min)取血浆置于-70℃保存备测,采血和血浆分离时注意避光。
1.5 血样的预处理取被测血浆0.5 mL,加入内标工作液40μL,0.2 M的磷酸钠200μL,混匀,加入3 mL乙醚旋涡混合3 min,离心10 min(3000 rpm),转上清液入玻璃试管,重复提取一次,合并上清,氮气挥干,残渣用200μL流动相溶解,进LC-MS/MS,进样量为50μL,由药物峰面积与内标的峰面积比在各自的标准曲线上求得氟哌噻吨和美利曲辛浓度〔3〕(注:样品浓缩2.5倍)。
1.6 统计学处理Cmax和Tmax用实测值表示;AUC0→t用梯形法计算,AUC0→∞=AUC0→t+Ctn/λz,其中,tn是最后一次可测浓度的取样时间,Ctn是测定的最后一点的血药浓度,λz是末端消除速度常数。试验数据用表示,AUC0→t,AUC0→∞和Cmax经对数转换后进行方差分析(Sigma PLot 2001,Orign 6.0软件)和双单侧t检验,P<0.05为差异有统计学意义,评价2种制剂的生物等效性。经对数转换后的(122α)置信区间分析结果AUC0→t和Cmax的90%可信限如分别在80%~ 125%和70%~143%之内,则可认定受试制剂与参比制剂生物等效〔4〕。
2 结果
2.1 测定方法认证
2.1.1色谱系统适应性 上述色谱条件下测得的对照品、服药前空白血浆和受试者样品的色谱图见图1。本法分离良好,保留时间:氟哌噻吨约1.15 min,美利曲辛约1.59 min,内标约1.04 min,无内源性物质干扰〔5〕(见图1)。

图1 氟哌噻吨和美利曲辛色谱图(A:空白血浆;B:空白血浆加入标准品(1μg·L-1);C:血浆样品)
2.1.2标准曲线及线性范围 取空白血浆0.5 mL共10份,分别加入不同浓度的标准工作液,使氟哌噻吨和美利曲辛的血浆浓度分别为0.015 6和0.313 ng· mL-1,0.031 3和0.625 ng·mL-1,0.062 5和1.25 ng·mL-1,0.125和2.5 ng·mL-1,0.25和5 ng·mL-1,0.5和10 ng· mL-1,1和20 ng·mL-1,5和100 ng·mL-1,按“血浆样品的处理”项下同法操作,每一浓度进行双样本分析,进样20μL,记录色谱图;以氟哌噻吨和内标莫沙必利面积比(Y)与氟哌噻吨浓度和内标莫沙必利浓度比(X)进行线性回归,得回归方程为:Y=0.0211X+ 0.001 04(r=0.997 9),权重因子为1/x。血浆中氟哌噻吨线性范围在0.0156~5 ng·mL-1浓度范围内与峰面积比线性良好,所以血浆中氟哌噻吨最低定量浓度为15.6 pg·mL-1。以美利曲辛和莫沙必利内标面积比(Y)和内标莫沙必利浓度比(X)进行线性回归,得回归方程为:Y=0.925X+0.072 4(r=0.998 7),权重因子为1/x,本法测定血浆中美利曲辛线性范围在0.313~ 100 ng·mL-1浓度范围内与峰面积比线性良好,所以血浆中美利曲辛最低定量浓度为0.313 ng·mL-1。
2.1.3精密度和回收率 取空白血浆100μL,制备含氟哌噻吨浓度和美利曲辛低、中、高3个浓度(分别为0.031 3和0.625 ng·mL-1、0.25和5 ng·mL-1、5和100 ng·mL-1)的质量控制样品,按“1.5”项下操作,每一浓度进行6个平行样本分析,连续测定3 d,根据当天的标准曲线,计算QC样品的测得浓度,根据QC样品结果计算本法的准确度与精密度。同时,另配制含氟哌噻吨浓度和美利曲辛浓度分别为0.031 3和0.625 ng·mL-1、0.25和5 ng·mL-1、5和100 ng·mL-1的流动相溶解样品各6份,N2吹干,残渣用200μL流动相溶解,进样50μL,记录氟哌噻吨和内标峰面积,及美利曲辛和内标峰面积。以血浆样品峰面积与流动相溶解样品峰面积的比值计算提取回收率,结果见表1和表2。
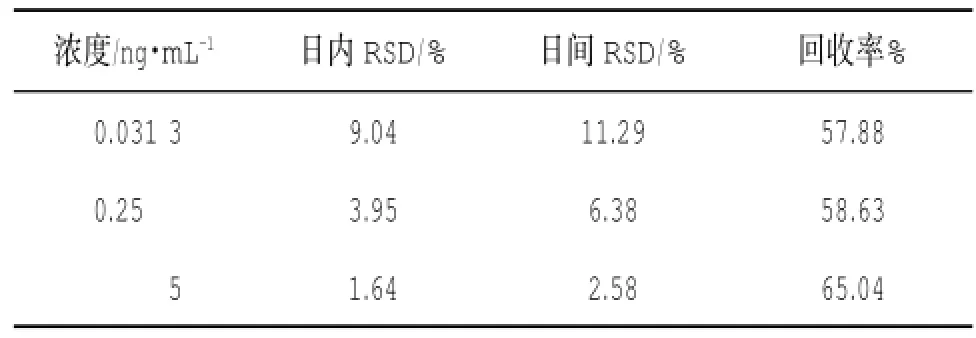
表1 氟哌噻吨的精密度和回收率(n=6)
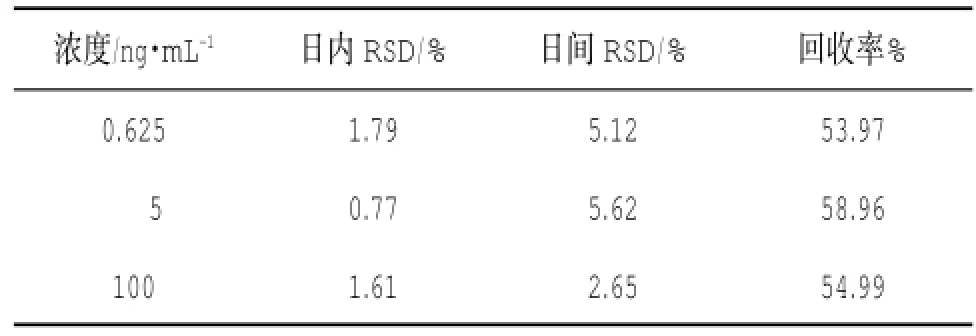
表2 美利曲辛的精密度和回收率(n=6)
2.2 血药浓度-时间曲线和药动学参数
2.2.1血药浓度-时间曲线 22名健康志愿者口服氟哌噻吨美利曲辛试验制剂和参比制剂后,平均血药浓度-时间曲线,见图2、3。
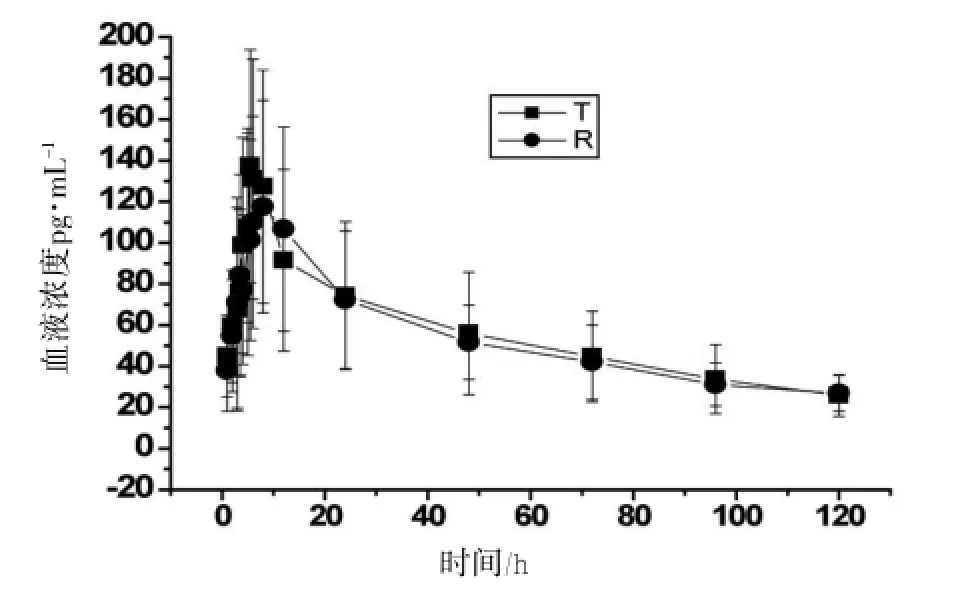
图2 单剂量给予氟哌噻吨2种制剂后的平均药-时曲线

图3 单剂量给予美利曲辛2种制剂后的平均药-时曲线
2.2.2药动学参数 22名健康志愿者口服氟哌噻吨美利曲辛试验制剂与参比制剂后主要药动学参数,见表3。
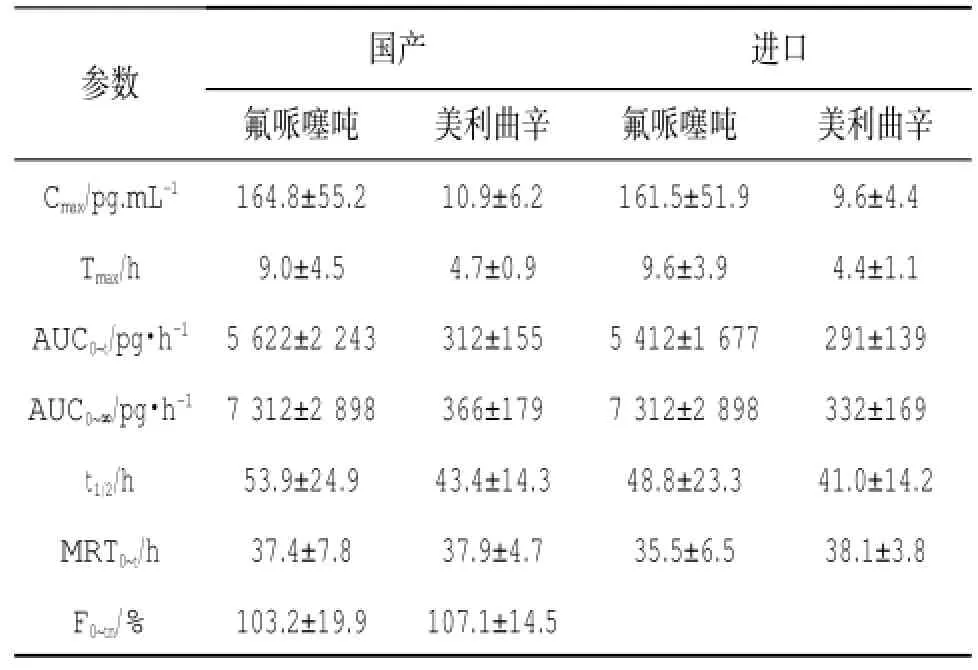
表3 22名健康受试者口服试验或参比氟哌噻吨美利曲辛片主要药动学参数
2.3 生物等效性评价将单次口服试验制剂和参比制剂氟哌噻吨美利曲辛(T)2片(氟哌噻吨0.5 mg/片,美利曲辛10 mg/片)后的AUC(0~120h)、AUC(0~∞)、Cmax等参数对数转换后进行方差分析,再采用双单侧t检验比较两种剂型的生物等效性。结果显示:AUC(0~120h)、AUC(0~∞)、Cmax在剂型间和周期间的F值均小于F(1-0.05)的临界值,即P>0.05,表明AUC(0~120h)、AUC(0~∞)、Cmax在剂型间和周期间无明显差异。其中氟哌噻吨AUC(0~120h)、AUC(0~∞)的90%置信区间分别为98.6%、105.4%和92.9%、112.8%,双单侧t检验二者的t1、t2均大于t(1-0.05);美利曲辛AUC(0~120h)、AUC(0~∞)的90%置信区间分别为88.4%、122.8%和90.7%、123.4%,双单侧t检验二者的t1、t2均大于t(1-0.05)。氟哌噻吨和美利曲辛的AUC(0~120h)、AUC(0~∞)、Cmax在个体间的F值均大于F(1-0.05)的临界值,表明AUC(0~120h)、AUC(0~∞)、Cmax在个体间差异有统计学意义(P<0.05)。两种剂型间的Tmax差异无统计学意义(P>0.05)。从以上结果统计分析表明:试验试剂与参比试剂在全身暴露水平(AUC与Cmax)上生物等效。
2.4 不良事件参加本实验的22名健康受试者在整个试验过程中未发现任何不良事件。
3 讨论
我们采用LC-MS/MS法测定氟哌噻吨和美利曲辛的血浆浓度,与传统研究方法〔6〕相比分析周期短、成本低、灵敏度高,能达到良好的分离效果,血浆中内源性杂质对氟哌噻吨、美利曲辛及内标均无干扰,适合于药动学和生物利用度研究。对氟哌噻吨和美利曲辛的药动学研究表明:氟哌噻吨美利曲辛片口服后吸收较慢,平均Tmax分别为9.0±4.5 h和9.6±3.9 h,Cmax分别为164.8±55.2 pg·mL-1和10.9± 6.2 ng·mL-1与文献〔7〕报道的差别较大,有待进一步研究。此外,对于此文中的国产和进口两种制剂从以上统计数据分析来看在全身暴露水平上生物等效。由于氟哌噻吨美利曲辛是两种成份的合剂,具有抗抑郁、抗焦虑和兴奋性,故建议临床使用该类药物时,应根据患者的具体情况调整给药剂量,以保障临床用药的安全性和有效性。
〔1〕张强.黛力新在临床应用中的注意事项〔J〕.中国实用医药,2010,5(19):225.
〔2〕国家食品药品监督管理局.化学药物临床药代动力学研究技术指导原则〔M〕.上海:上海科学技术出版社,2005:140-159.
〔3〕金春晖,鲍立曾,孙成春.国产与进口苯磺酸氨氯地平片的人体生物等效性研究〔J〕.中华实用医药杂志,2007,7(9):779-781.
〔4〕李雪宁,许剑安,陈伟力,等.国产和进口雷米普利片的药动学和生物等效性研究〔J〕.中国临床药学杂志,2009,18(1):9-13.
〔5〕Che J,Meng Q,Chen Z,et al.VaLidation of a sensitive LC/ MS/MS method forsimultaneous quantitation of flupentixol and melitracene in human plasma〔J〕.J.Pharmbiomed Anal.2007,45(5):785-792.
〔6〕宋一,刘艳.HPLC测定氟哌噻吨美利曲辛片的含量及有关物质〔J〕.中国药事,2007,21(11):894-896.
〔7〕王凯.仿制氟哌噻吨美利曲辛片与原研制剂人体内药动学比较研究〔D〕.长沙:中南大学,2010:140-159.
(责任编辑 毛本勇)
Human Bioequivalence Study of Domestic and Imported Flupentixol and Melitracen Tablets
ZHANG Yuzhe1,MENG Qingfang2,CHENG Yuanguo2*
(1.Pre-clinical College,Dali University,Dali,Yunnan 671000,China; 2.Institute of Microbiology and Epidemiology,Academy of Military Medical Sciences,Beijing 100071,China)
Objective:To study the pharmacokinetics and bioequivalence of domestic and imported Flupentixol and Melitracen tablets in healthy subjects.Methods:Twenty-two healthy male subjects in a randomized crossover design were given a single oral dose of 10 mg domestic and imported Flupentixol and Melitracen tablets.Plasma concentrations of the subjects were determined by liquid chromatography-tandem mass spectrometry(LC-MS/MS).The pharmacokinetic parameters were calculated applied SigmaPLot 2001 and Origin 6.0 software.Results:The main pharmacokinetic parameters of domestic and imported Flupentixol and Melitracen were as follows.Flupentixol:Cmaxwere 164.8±55.2 and 161.5±51.9 pg·mL-1;Tmaxwere 9.0±4.5 and 9.6±3.9 h;AUC0→t were 5 622±2 243 and 5 412±1 677 pg·h-1,respectively.Melitracen:Cmaxwere 10.9±6.2 and 9.6±4.4 ng·mL-1;Tmaxwere 4.7±0.9 and 4.4±1.1 h;AUC0→t were 312±155 and 291±139 ng·h-1,respectively.The statistic analysis of two formulations was conducted by analysis of variance,two one-sided tests and confidence intervals,which demonstrated that there were no significant differences between domestic and imported formulations in main pharmacokinetic parameters(P>0.05).The mean relative bioavailability of domestic formulation of Flupentixol was 105.42±22.23%,and Melitracen was 107.29±20.40% (n=24).Conclusion:The domestic Flupentixol and Melitracen are bioequivalent to the imported formulation.
Flupentixol;melitracen;LC-MS/MS;pharmacokinetics;bioequivalence
R977.3
A
1672-2345(2012)06-0001-04
2012-01-19
2012-03-20
张钰哲,助教.主要从事临床前药代动力学研究. *通信作者:程远国,博士生导师、研究员.

