黑曲霉对黄曲霉毒素B 1的降解与应用研究
李 冰,董征英,常维山
(山东农业大学动物科技学院,山东 泰安 271018)
黄曲霉毒素(AF)是由黄曲霉、寄生曲霉等几种真菌产生的次生代谢产物,是一类结构和理化性质相似的分子真菌毒素,是一种毒物和强致癌物质,AFB1是迄今发现的各种真菌毒素中最稳定的一种[1-2]。黄曲霉毒素存在广泛、危害巨大,畜禽食入被污染的饲料会降低动物的生产性能、引发一系列疾病,可间接通过食物链进入人体并具有极强的致癌作用,严重威胁人类健康[3]。
目前在粮食和饲料的贮藏过程中不可避免产生霉菌毒素,解决霉毒素尤其是AFB1对粮食和饲料的污染是一个世界性难题。传统去除AFB1的方法主要有吸附、萃取、热处理、射线处理、酸碱处理、氧化还原处理,但是有费时费力、去毒率不高、易造成营养物质流失的缺点。目前发现自然界中有多种微生物能吸附或降解饲料或食品中的黄曲霉毒素,这些微生物包括细菌、酵母菌′、霉菌、放线菌和藻类等。采用微生物或其产生酶进行脱毒不仅条件相对温和,不会破坏产品的品质,而且有些还能增加产品的营养价值[4]。其中黑曲霉在降解AFB1方面不仅表现出了高效、经济、安全等优点,还会抑制饲料中黄曲霉的生长和提高饲料利用率的优势。因此,研究开发利用黑曲霉来进行AFB1的生物脱毒具有重要意义。
1 材料与方法
1.1 试验菌株
黑曲霉购自中国微生物菌种保藏中心。
1.2 培养基
PDA培养基:马铃薯200 g·L-1,葡萄糖20 g·L-1,琼脂20 g·L-1;PDB培养基:马铃薯200 g·L-1,葡萄糖20 g·L-1。
1.3 试验试剂与设备
AFB1标准品(以色列Fermentek公司生产)用乙腈配制成1 mg·mL-1备用。试验设备包括高效液相色谱仪、恒温振荡培养箱、超净工作台、冷冻离心机等。
2 试验方法
2.1 黑曲霉对AFB1的降解作用
将黑曲霉接入50 mL PDB培养基中,于37℃、150 rpm,摇床培养2 d,然后加入1 mg·mL-1AFB15μL,3 d后检测AFB1含量;用只含AFB1的PDB培养基作为对照组。
2.2 降解曲线的测定
将黑曲霉和1 mg·mL-1AFB15μL接入100 mL PDB培养基中。每隔3 h测定1次毒素降解率,连续测定15 h。
2.3 黑曲霉降解AFB1活性组分的确定
将黑曲霉接入100 mL PDB培养基中培养3 d。取发酵液50 mL,在4℃、8 000 rpm条件下冷冻离心20 min,分离上清液与菌体细胞,取上清液,即得胞外粗提液;将沉淀的菌体细胞用蒸馏水连续洗涤两次,用蒸馏水35 mL溶解备用;同上再制备1份菌体细胞,对菌体细胞溶液进行细胞超声波破碎后冷冻离心,将离心后的上清液用孔径为0.2μm的过滤膜过滤,然后溶于蒸馏水35 mL制成胞内液,备用。分别在等量的黑曲霉菌体细胞溶液、胞内物质、胞外粗提液中加入AFB12μm,在37℃的培养箱中反应2 d;以等量的蒸馏水加AFB1为对照组。
2.4 黄曲霉毒素降解菌株的应用
2.4.1 急性毒理学试验
将黑曲霉接入100 mL PDB培养基中培养3 d。发酵液对5只小鼠(雌雄各半)进行最大耐受试验,每次最大给药量为0.2 mL·只-1·10 g-1,灌胃给药3次·d-1,24 h后观察小鼠表现;对5只小鼠经口灌胃蒸馏水作为对照组。
2.4.2 发霉饲料中黄曲霉毒素降解试验
取饲料500 g和蒸馏水200 mL充分混匀,在37℃的恒温箱中放置21 d制得发霉饲料。取黑曲霉发酵液50 mL和发霉饲料混匀,在37℃的培养箱中培养3 d,每隔12 h充分混匀1次。检测对比发霉饲料中发酵前后AFB1的含量。
2.5 AFB1的提取与检测
AFB1的提取参照GB/T8381-2008/ISO6651:2001。AFB1的检测采用三氟乙酸柱前衍生后HPLC检测方法。
HPLC检测条件为流动相乙腈∶水=3∶7;流速1 mL·min-1;色谱柱C18 4.6 mm×250 mm,0.5 μL;柱温为室温;激发波长360 nm,检测波长440 nm;进样量20μL。AFB1降解率的计算公式见式1。

3 结果与分析
3.1 AFB1标准品的液相色谱图
AFB1标准品的液相色谱图见图1。
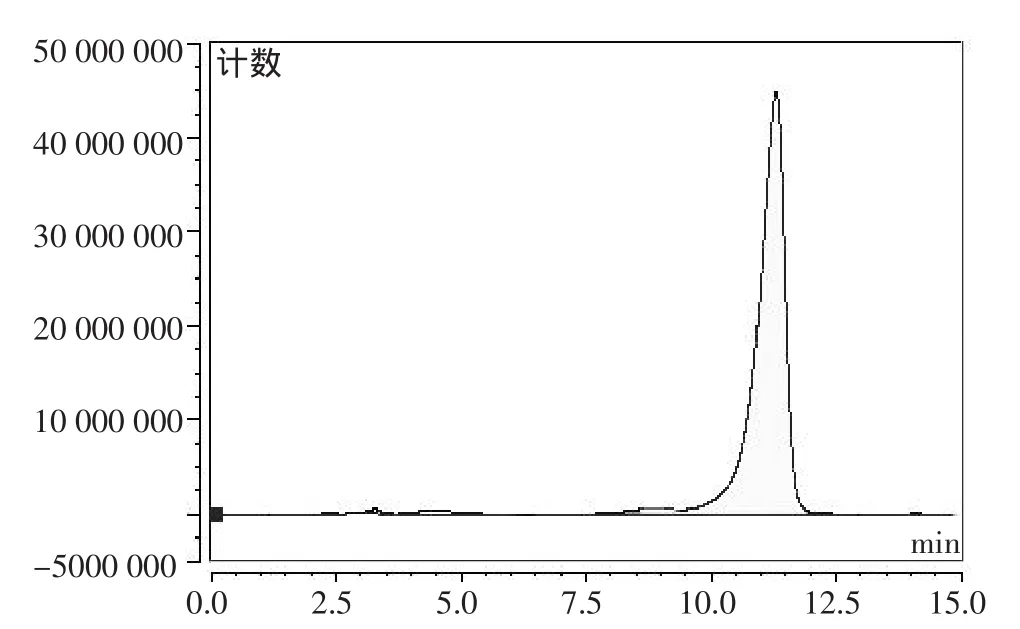
图1 AFB1标准品的色谱
由图1可以看出,AFB1的保留时间为11.30 min。
3.2 黑曲霉对AFB1的降解:
黑曲霉对AFB1的降解见图2~3。
由图2~3可以看出,代表AFB1的色谱峰显著减小(P<0.05)。HPLC检测计算得出黑曲霉对AFB1降解率达93.28%。在相同培养基中有无黑曲霉对AFB1含量的变化表明,该降解完全是由黑曲霉的生长引起的,与PDB培养基的吸附作用无关。

图2 对照组色谱图

图3 试验组色谱图
3.3 降解曲线的测定
黑曲霉不同时间对菌株毒素降解率的影响结果见图4。由图4可见,在前12 h内,AFB1的降解率升高很快,可能与菌体吸附有关,随着时间的延长,AFB1的降解率升高幅度减慢,可能主要由黑曲霉产生的活性物质作用所致。

图4 黑曲霉对AFB1的降解曲线
3.4 黑曲霉降解AFB1活性组分的确定
对照组(含AFB1的蒸馏水)的色谱图、胞内物质对AFB1降解后的色谱图、菌体细胞对AFB1降解后的色谱图、胞外粗提液对AFB1降解后的色谱图分别见图5~9。
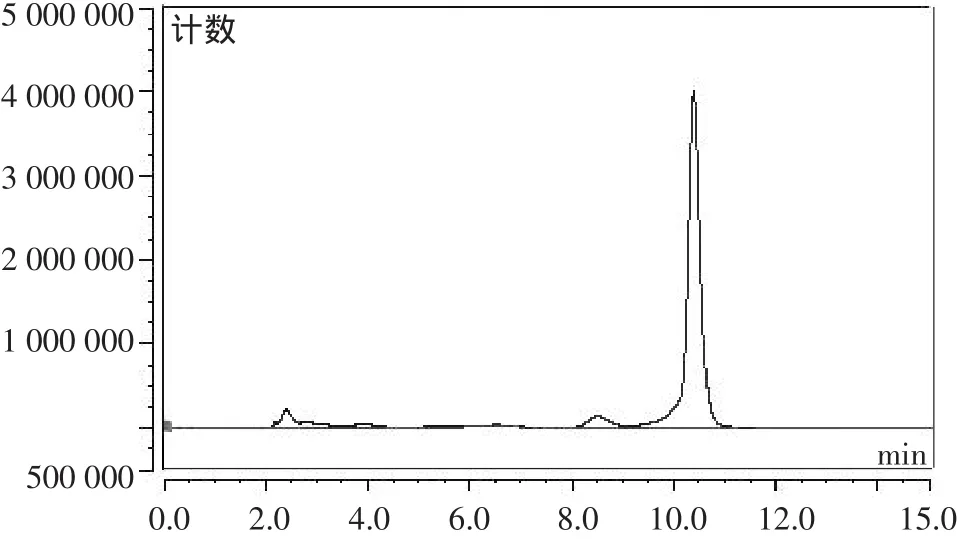
图5 对照组(含AFB1的蒸馏水)色谱图

图6 胞内物质对AFB1降解后色谱图
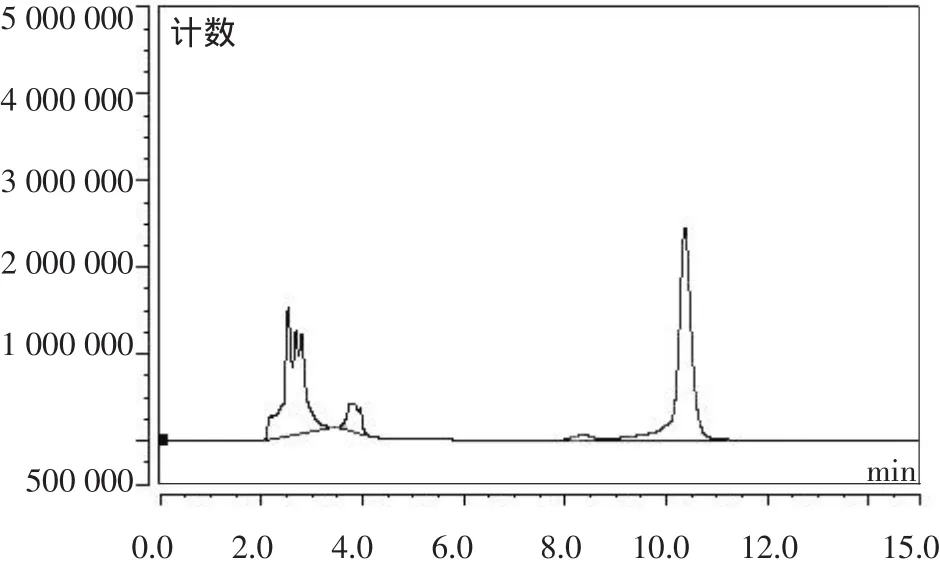
图7 菌体细胞对AFB1降解后色谱图

图8 胞外粗提液对AFB1降解后色谱图

图9 黑曲霉的不同处理对降解AFB1的结果
由图5~9可以看出,胞外粗提液AFB1降解能力最强,降解率达到84.20%,菌体细胞的降解能力次之,降解率达到38.40%,胞内物质的降解能力最差,降解率为3.33%,基本无降解能力。黑曲霉菌体细胞对样品中AFB1的消除可能是运用细胞壁的物理吸附作用,胞内物质、胞外粗提液是运用生物学方法来解毒,主要通过转化AFB1的结构来达到降解作用。从HPLC的结果来看,胞外粗提液降解AFB1后,其产物的特征荧光显著减弱,推测是一种酶裂解了内酯环。由此可以认为,黑曲霉降解AFB1起作用的主要是胞外粗提液中的一种生物活性酶,黑曲霉对AFB1的降解过程实质上应是降解酶的酶促反应。
3.5 黑曲霉发酵液对发霉饲料的作用
黑曲霉发酵液对发霉饲料的作用见图10~11。

图10 霉变饲料处理前的色谱
由图10可以看出,霉变饲料中有大量荧光物质,包括AFB1。由图11可以看出,霉变饲料中的很多荧光物质被降解,AFB1已接近0。经过黑曲霉发酵液对发霉饲料的处理,其中AFB1的含量远低于国家标准中饲料AFB1的超标量(≤10 μg·kg-1)[5]。黑曲霉及其产生的活性物质降解其中AFB1作用效果温和,安全性高,不影响原有品质,而且具有操作简单、成本低等优点,适合在饲料方面规模应用。

图11 霉变饲料处理后的色谱
3.6 急性毒性试验
经观察,灌服小鼠无死亡现象,也未出现任何中毒现象。3 d后处死小鼠,解剖观察其心、肝、脾、肺、肾,均无特殊改变。小鼠最大耐受量的测定主要考察小鼠在药物单次给药或24 h内多次给药后的急性毒性情况,可对黑曲霉发酵液的安全性进行初步评价[6]。可见此种黑曲霉对小鼠并无显著的急性毒副作用。黑曲霉在国际上公认安全性高,已在食品及饲料发酵的生产中广泛使用。因此,可以认为采用的微生物降解AFB1工艺在安全性方面无需担心。
4 讨论
黄曲霉毒素自从20世纪60年代被发现以来,人们对其危害越来越重视,虽然已研发、推广了一些脱毒或降解毒素的方法,但都有弊端。近年来,人们希望用简单、便捷、温和的方法来去除黄曲霉毒素,纷纷把研究重点向微生物降解方面发展。从国际上的报道来看,霉菌毒素的微生物降解研究有了很大进展,尤其是黄曲霉毒素去除的研究,但仍存在一些问题,例如微生物的降解过程缓慢,安全性不确定,有效组分解毒酶的复杂性,这些因素限制了在实际生产应用[7-14]。现在实际生产应用的多是菌体的吸附作用(啤酒酵母、乳酸菌等对毒素的吸附),研究证明,主要是菌体细胞壁与黄曲霉毒素通过非共价方式结合的,这种吸附作用没有达到真正去除AFB1的目的。微生物降解霉菌毒素不同于物理吸附,降解是霉菌毒素分子的毒性基团被微生物产生的次级代谢产物或者所分泌的胞内、胞外酶分解破坏,同时产生无毒的降解产物的过程[15]。孙丰芹等利用营养特异性方法进行去除AFB1菌株的初筛,之后将初筛的7株菌细胞和发酵上清液作用于质量浓度为200 μg·L-1的AFB1,结果表明,筛选得到的TRS-3菌株,其活细胞和死细胞对AFB1的去除率分别达到48.26%和53.56%,其发酵上清液降解AFB1的能力达到78.55%,均高于其他菌株,从花生土壤和花生粕中也筛选出能去除黄曲霉毒素B1(AFB1)的菌株[16]。
高效液相色谱法是当前国际上使用权威的检测AFB1方法,因此本研究采用高效液相色谱法对AFB1进行检测,为了加强荧光,通过强氧化剂三氟乙酸柱前进行衍生处理[17]。经过高效液相色谱的检测,表明黑曲霉及产生的活性物质能够很好的降解AFB1,而且菌体能够吸附一定量的AFB1。另外,徐丹等还发现黑曲霉能有效抑制黄曲霉的生长与繁殖,从而达到抑制黄曲霉产毒的作用[18]。由此可见,黑曲霉不仅能够产生活性物质降解AFB1,同时也会产生抑制黄曲霉生长和繁殖的物质,这在防霉去霉过程中有很大的作用,也对以后开发研制高效、广谱、无毒的天然防霉剂和生物降解剂提供理论基础。
5 结论
本试验通过对有益菌株的筛选,得到降解AFB1效果最佳的一种黑曲霉,其对AFB1的降解率达93.28%,起降解作用的主要是一种生物活性酶,且菌体细胞对AFB1也有一定的吸附作用,从小鼠的急性毒性试验和发霉饲料中霉菌毒素的降解来看,黑曲霉及其产生的活性物质对AFB1生物降解作用效果温和,安全性高,不影响原有品质,而且具有操作简单、成本低等优点,运用在饲料中降解霉菌毒素有很大的开发潜力。
[1] Alberts J F,Engelbrecht Y,Steyn P S,et al.Biological degrada⁃tion of aflatoxin B1by Rhodococcus erythropolis cultures[J].Inter⁃national Journal of Food Microbiology,2006,109(1):121-126.
[2] Kabak B,Dobson A D W,Var I.Strategies to prevent mycotoxin contamination of food and animal feed:a review[J].Critical Re⁃views in Food Science and Nutrition,2006,46(8):593-619.
[3] 计成,赵丽红.黄曲霉毒素生物降解的研究及前景展望[J].动物营养学报,2010,22(2):241-245.
[4] 程茂基,计峰,夏伦志,等.黑曲霉益生菌对断奶仔猪生长及日粮养分消化的影响[J].中国饲料,2005(7):11-19.
[5] 中华人民共和国国家质量监督检验检疫总局.GB13078-2001.中华人民共和国国家标准——饲料卫生标准[S].北京:中国标准出版社,2004.
[6] 李清,牛天贵,郝华昆.马红球菌4-2胆固醇氧化酶的急性毒理学研究[J].肉品卫生,2005(4):27-30.
[7] 李俊霞,焦自好,王斐,等.降解黄曲霉毒素B1菌株发酵条件的研究[J].食品科学,2009,30(13):157-162.
[8] Teniola O D,Addo P A,Brost I M,et al.Degradation of aflatoxin B1by cell-free extracts of Rhodococcus erythropolis and Mycobac⁃terium fluoranthenivorans sp.nov.DSM44556(t)[J].International Journal of Food Microbiology,2005,105(2):111-117.
[9] Zhao L H,Guan S,Gao X,et al.Preparation,purification and characteristics of an aflatoxin degradation enzyme from Myxococ⁃cus fulvus ANSM068[J].Journal of Applied Microbiology,2011,110(1):147-155.
[10] 庄振宏,郑传琦,汪世华,等.黄曲霉培养条件的优化及黄曲霉毒素B1的提取[J].应用与环境生物学报,2010,16(5):724-729.
[11] 李梦云,陈代文.饲料中黄曲霉毒素的危害及几种脱毒剂的作用机理[J].饲料博览,2005(4)∶10-14.
[12] 田博,张慧,李杰,等.黄曲霉毒素B1对家禽的影响及防治措施[J].饲料博览,2012(3):45-47.
[13] Afzali N,Devegowda G.Ability of modified man-nanoligosaccha⁃ride to counteract aflatoxicosis in broiler breeder hens[J].Poulty Science,1999,78(1):228.
[14]Diaz D E,Hagler W M J,Hopkins B A,et al.Aflatoxin bindersⅠ:in vitro binding assay for aflatoxin B1by several protential seques⁃tering agents[J].Mycopathologia,2002,156(3):223-226.
[15] 计成,赵丽红,马秋刚,等.黄曲霉毒素生物降解的研究及前景展望[J].中国家禽,2009,31(21):6-9.
[16] 孙丰芹,金青哲,王兴国,等.去除黄曲霉毒素B1的菌株筛选[J].食品与生物技术学报,2011,30(2):1 673-1 689.
[17] 邱宏,钟汉怀,全德甫.高效液相色谱法同时测定食品中四种黄曲霉毒素的方法探讨[J].现代预防医学,2006,33(5):790-791.
[18] 徐丹,孙秀兰,李永仙,等.黑曲霉对黄曲霉生长、产毒及黄曲霉毒素B1的影响[J].中国微生态学杂志,2011,23(6):490-492,499.

