Nafion掺杂多壁碳纳米管固定的电致化学发光法检测壮观霉素的研究
童 颖,郑 洁,孙境翊,卫 伟
(东南大学医学院,江苏 南京 210019)
壮观霉素(Spectinomycin)又名奇霉素,属于氨基糖苷类抗生素,其结构式见图1。壮观霉素广泛应用于临床和畜牧业领域,但同时滥用问题也日益突出,残留的壮观霉素存在于动物性食品中通过食物链进入人体,不但使多种致病菌耐药性增强,而且长期低水平的接触,易引起各种慢性、蓄积性毒性,致使致癌、致畸、致突变、生态毒性、发育毒性和免疫毒性等危害的产生。 因此,建立简单、灵敏、可靠的壮观霉素检测方法十分重要[1]。
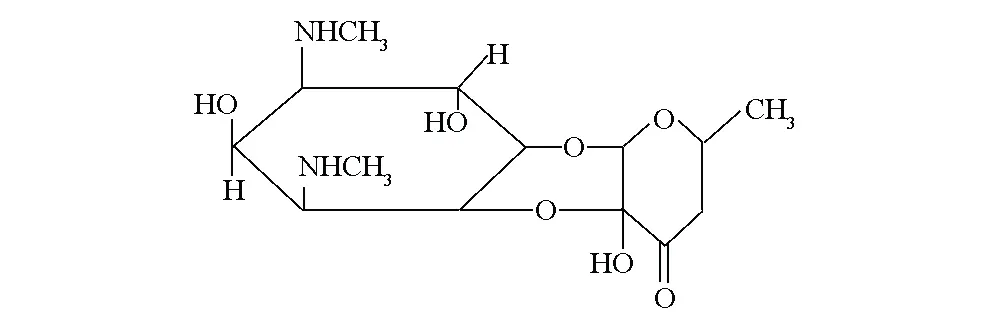
图1 壮观霉素的结构式
目前,国内外检测氨基糖苷类抗生素的方法主要有微生物法、薄层色谱法和液相色谱法。微生物法简单、成本低,但耗时长,总效价和特异性差,不能区分抗生素种类及相关组分。薄层色谱法耗时短、设备价廉,但影响因素较多,定量困难。化学检测法首先对壮观霉素进行衍生,再用液相色谱法-荧光或紫外法检测,衍生反应会带来副反应,影响检测[2~4]。

1 实验
1.1 试剂与仪器
MPI-B型多参数化学发光分析测试系统-多功能化学发光检测仪;CHI电化学分析仪。
三电极系统(玻碳电极为工作电极,铂丝为对电极,Ag-AgCl为参比电极)。
1.2 电极制备
玻碳电极在使用前用0.1 μm及0.05 μm的α-Al2O3粉在麂皮上作抛光处理,先用自来水冲洗,再用二次水冲洗,用氮气干燥,得到平滑光洁新鲜的电极表面。

2 结果与讨论


图1 电极(a)、N-C电极(b)在pH值7.0的0.1 mol·L-1磷酸盐缓冲溶液中的循环伏安曲线(扫描速度为100 mV·s-1)

2.2 扫描速度对-N-C电极响应的影响(图2)
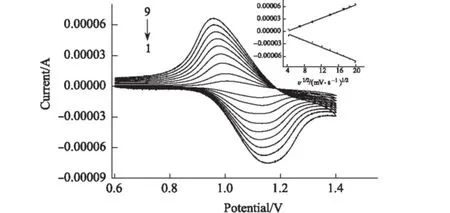
1~9,扫描速度(mV·s-1):20、50、100、150、200、250、300、350、400
由图2可见,随着扫描速度的加快,其氧化还原的峰电位有一定的位移,氧化峰与还原峰之间的峰电位差增大。处理数据发现,氧化峰电流与扫描速度的算术平方根成反比、还原峰电流与扫描速度的算术平方根成正比。在20~ 400 mV·s-1的范围内,氧化、还原峰的电流与扫描速度算术平方根的相关系数分别为0.9823和0.9931,说明修饰电极在溶液中的电化学过程为扩散控制过程。
2.3 壮观霉素对-N-C电极的电致化学发光影响

图3 电极在0.1 mol·L-1pH值7.0的磷酸盐缓冲溶液中不含壮观霉素(a)与含2.0×10-4mol·L-1壮观霉素(b)的电致化学发光图

C12H16O7(N+·HCH3)2


2.4 检测条件的优化
不同pH值的磷酸盐缓冲溶液对壮观霉素的测定有较大的影响。因此需要优化支持电解质溶液的pH值。2.0×10-5mol·L-1的壮观霉素在不同pH值的0.1 mol·L-1磷酸盐缓冲溶液中的电致化学发光强度见图4。
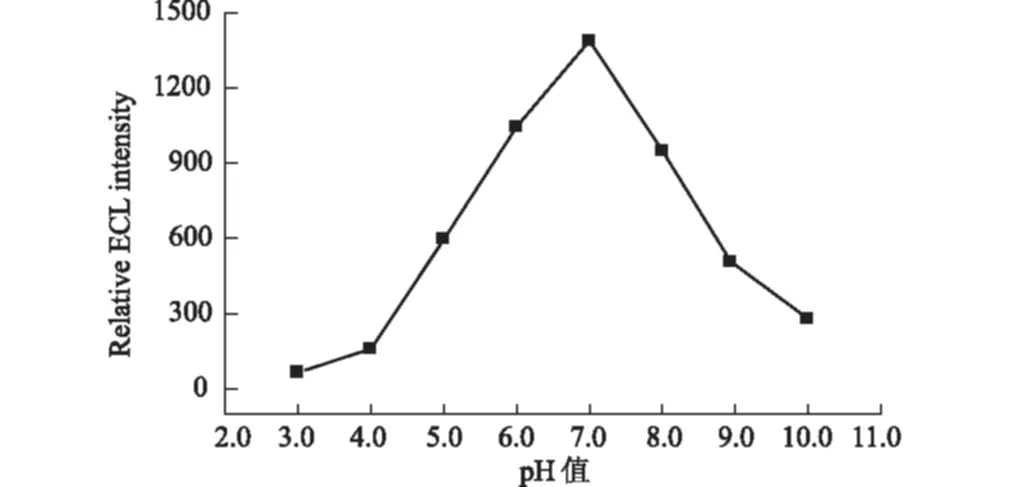
图4 pH值对壮观霉素电致化学发光强度的影响
由图4可知,pH=7.0时,电致化学发光信号最强,所以本实验的测定在pH=7.0磷酸盐缓冲溶液中进行。
2.5 壮观霉素的检测与标准曲线

与其它氨基糖甙类药物不同,壮观霉素大剂量(每日高达8 g)肌肉注射并不发生耳和肾脏毒性。临床上,壮观霉素给药途径为深部肌肉注射,其吸收良好,血液和尿液浓度较高。一次注射2 g剂量后血浆峰值浓度超过0.1 mg·mL-1,尿液峰值浓度约9 mg·mL-1,其血浆浓度可持续8 h或更久。因此,所建立的壮观霉素检测方法可用于临床样品的检测。
2.6 尿样本的测定
取新鲜尿液0.5 mL,添加浓度为50 μg·mL-1、200 μg·mL-1和600 μg·mL-1的壮观霉素,再依次加入高氯酸钾0.5 g、二次水4.5 mL,混匀静置10 min,在 100 000 r·min-1下离心15 min,取上清,在上述优化的条件下测定尿液中壮观霉素的含量,计算回收率,验证方法的准确度,结果见表1。

表1 尿液中壮观霉素的加标回收率实验结果(n=3)
由表1可知,回收率在87.1%~120.2%之间,相对标准偏差在3.4%~5.4%之间,说明该方法是准确可靠的。
3 结论
参考文献:
[1] Wei W,Wei M,Cai Z Y,et al.Determination of spectinomycin in human urine using CE coupled with electrogenerated chemiluminescence[J].Chromatographia,2011,74(3-4):349-353.
[2] Stead D A.Current methodologies for the analysis of aminoglycosides[J].Journal of Chromatogr B,2000,747(1-2):69-93.
[3] Edder P,Cominoli A,Corvi C.Determination of streptomycin residues in food by solid-phase extraction and liquid chromatography with post-column derivatization and fluorometric detection[J].Journal of Chromatogr A,1999,830(2):345-351.

[5] Rubinstein I,Bard A J.Polymer-films on Electrodes.5.Electrochemistry and chemi-luminescence at nafion-coated electrodes[J].Journal of American Chemical Society,1981,103(17):5007-5013.
[6] Zhuang Y F,Ju H X.Determination of reduced nicotinamide aden-ine dinucleotide based on immobilization of tris(2,2′-bipyridyl) ruthenium(Ⅱ) in multiwall carbon nanotubes/nafion composite membrane[J].Analytical Letters,2005,38(13):2077-2088.

