NaCl胁迫对不同甘薯品种体内离子分配的影响
马箐 于立峰 孙宏丽 唐琪 王宝山 杜希华
摘要:以济薯21、济徐23、济薯04150、徐薯26、徐薯27和徐薯28共6个甘薯品种为试材,用1/5Hoag-land营养液附加不同浓度NaCl(0、0.2%、0.3%和0.5%)处理甘薯苗,观察其生长情况;100d后取样分别测定根、茎、叶中的Na+含量和K+含量。结果表明,随着NaCl浓度升高,不同甘薯品种的生长均受到抑制,其中徐薯26受抑制程度最大;根、茎、叶中的Na+含量及Na+/K+比值都有所增加,根中Na+含量最高,而叶中Na+含量最低。可见盐胁迫条件下甘薯将较多的Na+储存在根中从而减少对地上部叶片的伤害,这可能是其忍耐高盐环境的重要机制之一。
关键词:甘薯;盐胁迫;Na+含量;Na+/K+比值
中图分类号:S531文献标识号:A文章编号:1001-4942(2012)01-0043-04
甘薯是重要的粮食作物,也是重要的工业原料、饲料、新型能源及减灾作物,不但高产稳产、适应性广,而且营养价值高,是人们普遍认可的绿色食品、营养食品和保健食品。我国已有400多年的甘薯种植历史,面积占世界甘薯种植总面积的68.1%0,沿海一带盐渍地上有较大的种植区,但因土壤盐分偏高,大大限制了甘薯种植业的发展,因此选植耐盐甘薯品种、研究甘薯的耐盐机理对发展甘薯种植业、合理开发和利用盐碱地具有重要的实际意义。
研究表明,高浓度Na+对植物的毒害作用是盐碱土影响植物生长的重要原因之一。最明显一点就是高盐胁迫破坏植物质膜的选择透过性。质膜通透性改变,使胞内离子(如K+)大量外渗,而胞外离子(如Na+)大量内流,从而破坏细胞内的离子稳态,影响植物的生理代谢和生长发育,甚至引起植株死亡。
本试验选取济薯21等6个甘薯新品种进行不同浓度NaCl胁迫处理,通过观察各甘薯品种的生长情况和测定根、茎、叶中的离子浓度,比较6个品种的耐盐能力,并对甘薯耐盐生理机制进行初步探讨,为今后深入研究甘薯耐盐机理奠定基础,同时为甘薯的高产种植提供理论依据。
1.材料与方法
1.1材料
挑选采自苗床的长势和长度一致、生长良好的6个品种薯苗为试材,分别是:济薯21(J21)、济徐23(JX23)、济薯04150(J04150)、徐薯26(X26)、徐薯27(X27)和徐薯28(X28)。薯苗由山东省农业科学院作物研究所甘薯研究中心和江苏省徐州甘薯研究中心提供。
1.2方法
1.2.1试验设计采用室内沙培方式种植薯苗。试验设置对照组(1/5 Hoagland营养液)和试验组(1/5Hoagland营养液附加不同浓度NaCl)。薯苗扦插后第一周为缓苗期,早晚各浇1次1/5 Ho-agland营养液,量为细沙持水量的2倍;第二周开始盐处理,设置0.2%、0.3%和0.5%三个梯度,每12h递增0.1%盐浓度并使试验组于同一天达到终浓度,每天早晚各浇1次。每盆移栽3株薯苗,每个处理设3个重复,室温(25~35℃)下培养并观察不同甘薯品种在不同盐浓度条件下的生长情况。
1.2.2Na+、K+含量的测定薯苗培养100d后,从培养盆内完整取出试验组和对照组植株,清水快速洗净并吸干表面水分,将根、茎、叶三部分分开,放入预先准备好的纸袋中做好标记,在烘箱内105℃下杀青15min,80℃下烘干至恒重。取出材料放入干燥器中冷却,然后分别称取根、茎、叶各60mg置于用双蒸水洗净的坩埚中(各处理材料取相同的取材点),用马弗炉灰化24h。冷却后用1~2滴浓硝酸将坩埚内的灰分溶解,用去离子水充分冲洗坩埚,定容至25ml,摇匀。用火焰分光光度计(Flame Photometer 410,Sherwood)测定样品液中的Na+、K+含量,计算各部位的Na+/K+比值。
1.3数据分析
应用Excel和SPSS软件对数据进行综合分析。
2.结果与分析
2.1不同浓度盐处理对甘薯生长情况的影响
对照组甘薯生长茂盛,主蔓粗长,叶片翠绿。随盐浓度升高,供试甘薯品种受抑制程度均增大,都出现了主蔓短小、叶片黄化和落叶现象,以0.5%盐浓度的抑制情况最为明显。其中,JX23、J04150与对照相比差距较小,而X26受抑制情况最严重,甚至出现死苗现象。可见,JX23与J04150较易适应高盐环境,X26对盐浓度最敏感。
2.2不同浓度盐处理对甘薯根、茎、叶中Na+含量的影响
由图1、图2、图3可以看出,与对照相比,6个甘薯品种的根、茎、叶中的Na+含量均呈现不同程度的上升趋势,且当NaCl处理浓度为0.5%时离子含量达到最大。其中大部分甘薯品种在NaCl浓度为0.2%时,根、茎和叶中Na+含量与对照相比无显著性差异(P>0.05),在NaCl浓度为0.3%或0.5%时显著(P<0.05)或极显著(P<0.01)高于对照。甘薯植株中Na+含量由高到低的部位依次为根、茎和叶。可见,在盐胁迫条件下,甘薯根中积聚较多的盐离子,有效减少盐分向地上生长旺盛部分的运输。
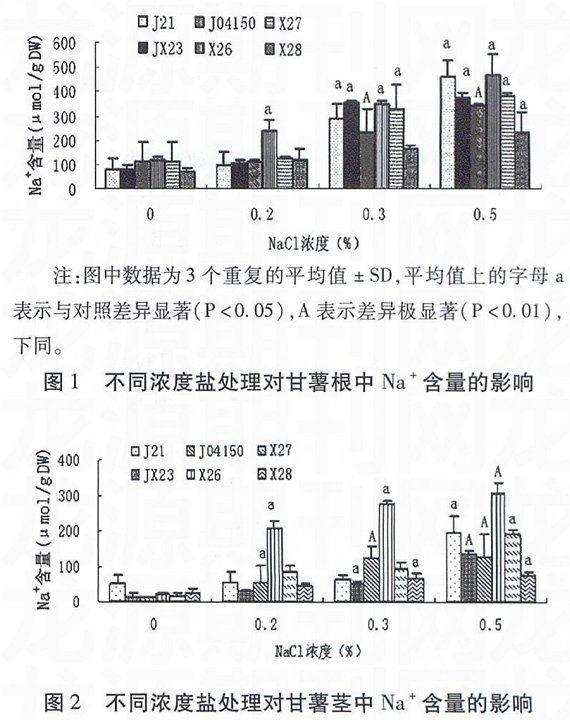
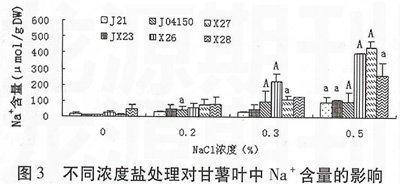
表1显示不同浓度NaCl处理对甘薯不同部位Na+/K+的影响。可见随着NaCl浓度的升高,甘薯各部位的Na+/K+均呈现逐步升高的趋势。
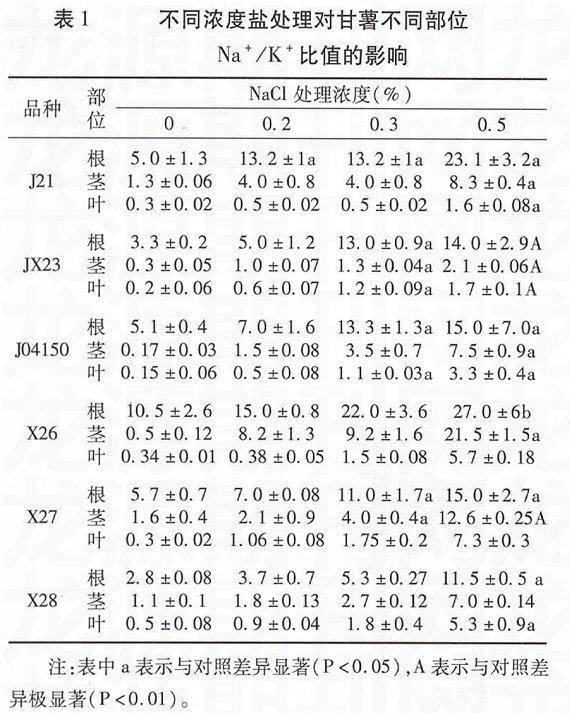
其中,根中的Na+/K+均>1且数值较大,始终处于最高水平,在NaCl浓度为0.3%或0.5%时Na+/K+显著(P<0.05)或极显著(P<0.01)高于对照;茎中的Na+/K+随NaCl浓度的加大也逐渐升高,除对照组最低<1以外其余均>1,且除X28与对照相比差异不显著(P>0.05)外,其余品种Na+/K+均存在显著(P<0.05)或极显著(P<0.01)高于对照的现象;叶中的Na+/K+仅对照组和0.2%NaCl处理组<1,其余处理组大多>1,且除X26、X27与对照相比差异不显著(P>0.05)外,其余品种Na+/K+均显著(P<0.05)
或极显著(P<0.01)高于对照。
从表1还可看出,在相同盐浓度下,根、茎、叶中的Na+/K+依次降低,这说明在外界高浓度NaCl环境下,甘薯的根部滞留了大量的Na+,以降低Na+向地上部的运输;而作为同化器官的茎和叶,Na+的分布也是有差别的,茎中Na+/K+始终较高,叶中Na+/K+始终最低,Na+更倾向于分布于茎中,进一步降低其向生长和代谢活跃的叶部运输。
另外,比较发现济薯品种根、茎、叶中的Na+含量和Na+/K+值的增加程度明显低于徐薯品种,说明济薯品种耐盐性较高。
3.讨论与结论
盐胁迫对植物造成的危害主要是离子毒害、渗透胁迫和营养不平衡。植物需维持体内水势低于外界土壤的水势,以维持膨压和水分的吸收,继而保证植物的持续生长。植物的耐盐性在很大程度上取决于体内的离子(特别是K+、Na+及Cl-)代谢。耐盐植物主要是通过降低体内Na+含量、提高K+含量来维持低的Na+/K+比,从而降低盐胁迫对其造成的伤害。在盐胁迫下,高浓度Na+渗入细胞,造成植物体内离子不平衡,破坏质膜的透性,使植物体内代谢紊乱。K+在各种类型植物细胞的生长及代谢中发挥重要作用,也是植物必需的唯一一种以相对高浓度存在的阳离子。高盐可以干扰植物细胞的离子平衡,使细胞丧失Ca2+和K+。Na+过多还对植物造成离子毒害,使其生长受抑制,因此,保持胞质K+浓度,对于植物的生长及耐盐性都是非常必要的。从甘薯离子含量的测定结果可以看出,耐盐性较强的济薯品种的Na+含量与Na+/K+值低于耐盐性较弱的徐薯品种。
甘薯是非盐生植物。非盐生植物多为拒盐型,盐分在体内分配取决于器官、组织和细胞层次上区域化分配的协同作用。在不同盐浓度处理下,甘薯根、茎和叶部的Na+含量显著增加,且根部和茎部的Na+含量明显高于叶片,可见甘薯植株主要将Na+储存在根部和茎部,使叶中的盐分浓度保持较低水平,限制了离子的向上运输,从而减轻Na+对叶片代谢的干扰作用,降低盐胁迫对地上部光合器官的毒害。这与在其它植物上得到的结果基本一致。
盐胁迫条件下,保持植物体内的离子平衡对植物正常生长至关重要。甘薯将较多的Na+储藏在根中很可能是其忍耐高盐环境的重要原因之一,但其具体的耐盐机理还有待于深入研究。
致谢:本试验所用薯苗由山东省农业科学院作物研究所甘薯研究中心和江苏省徐州甘薯研究中心提供,深表谢忱。
参考文献:
[1]江阳,孙成均.甘薯的营养成分及其保健功效研究进展[J].中国农业科技导报,2010,12(4):56-61.
[2]汪宝卿,解备涛,王庆美,等.甘薯内源激素和化学调控研究进展[J].山东农业科学,2010,1:51-56,62.
[3]胡鹏,蔡荣宝,邓鹏,等.甘薯膳食纤维的生理功能及提取工艺研究进展[J].中国食物与营养,2009,9:31-33.
[4]代红军,柯玉琴,潘廷国.NaCl胁迫下甘薯苗期叶片活性氧代谢与甘薯耐盐性的关系[J].宁夏农学院学报,2001,22(1):15-17.
[5]李志杰,孙文彦,马卫萍,等.盐碱土改良技术回顾与展望[J].山东农业科学,2010,2:73-77.
[6]潘瑞炽.植物生理学[M].北京:高等教育出版社,2004,299-301.
[7]Chowdhury M A M,MoseKi B,Bowling D J F.A method forscreening rice plants for salt tolerance[J].Plant and Soil,1995,171:317-322.
[8]Kingsbury R W,Epstein E.Salt sensitivty in wheat:a case forspecific ion toxicity[J].Plant Physiol,1986,80(3):651-654.
[9]叶尚红,字淑慧.植物单盐毒害实验的改进[J].植物生理学通讯,2007,43(3):542.
[10]Pitman M G.Transport across the root ndshoot/root interaction[A].In:Salinity tolerance in plant-strategies for crop im-provement[M].New York:John Wileyand Sons,1984,93-123.
[11]余叔文,汤章城.植物生理与分子生物学[M].北京:科学出版社,1998,752-769.
[12]James R A,von Caemmerer S,Condon A G,et al,Genetic var-iation in tolerance to the osmotic stress component of salinitystress in durum wheat[J].Function.Plant Biol.2008,35:111-123.
[13]刘艳.200mmol/LNaCl胁迫对盐芥Na+含量的影响[J].现代农业科技,2011,1:15.
[14]罗庆云,於丙军,刘友良.大豆苗期耐盐性鉴定指标的检验[J].大豆科学,2001,20(3):177-182.
[15]马建华,郑海雷,赵中秋,等.植物抗盐机理研究进展[J].生命科学研究,2001,5(S1):175—179.
[16]Flowers T J. The mechanism of salt tolerance in halophytes[J].Ann.Rev.Plant paysiol.1977,28:89-121.
[17]邵群,韩宁,丁同楼,等.高亲和K+转运载体SsHKTl的抗体制备及表达分析[J].武汉植物学研究,2006,24(4):292-297.
[18]Clapham D E.Calcium singaling[J].Cell,2007,131(6):1047-1058.
[19]Zhu J K,Liu J P,Xiong L M.Genetic analysis of salt toler-ance in Arabidopsis:Evidence for a critical role potassium nu-trition[J].The Plant Cell,1998,10:1181-1191.
[20]高叶,赵术珍,陈敏,等.NaCl胁迫对甘薯试管苗生长及离子含量影响[J].安徽农业科学,2008,36(35):15333-15335.
[21]王艳青,蒋湘宁,李悦.盐胁迫对刺槐不同组织及细胞离子吸收和分配的变化[J].北京林业大学学报,2001,23(1):18-23.
[22]石德成,盛艳敏,赵可夫.不同盐浓度的混合盐对羊草苗的胁迫效应[J].植物学报,1998,40(12):1136-1142.
[23]王素平,徐心诚.H2O2预处理对盐胁迫下黄瓜幼苗生长和
K+、Na+、Cl-分布的影响[J].河南农业科学,2008,5:88-92.

