MBP68-86与MBP87-99诱导实验性自身免疫性脑脊髓炎大鼠的轴突损伤修复及其机制研究
赵 晖 王义周 寇 爽 李 明 齐 放 张秋霞 王 蕾*
(1.首都医科大学中医药学院中药学系,北京 100069;2.首都医科大学中医药学院中医学系,北京 100069;3.泰和诚医疗集团医学部,北京 100013)
多发性硬化(multiple sclerosis,MS)是一种中枢神经系统(central nervous system,CNS)自身免疫反应介导的炎性神经退行性病变[1]。Vogt J等[2]研究发现,MS的主要病理特征是免疫炎性反应引起的脱髓鞘和轴突损伤等,特别是在MS早期就发生的轴突变性及神经元损伤是MS患者神经功能障碍的重要原因。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是研究MS公认的动物模型[3]。选择碱性髓鞘蛋白(myelin basic protein,MBP)68-86及 MBP87-99均能引起 EAE。本课题组前期的实验[4-6]也证实2种肽段MBP能够引起大鼠EAE。本研究内容则是进一步观察 MBP68-86及 MBP87-99在免疫诱导的EAE大鼠模型中APP及GAP-43 mRNA表达及其cAMP-PKA的变化,深入探讨EAE大鼠发病过程中轴突损伤、修复及其可能的分子机制。
1 材料与方法
1.1 实验动物
SPF级雌性Lewis大鼠,体质量150~180 g,由北京维通利华实验动物技术有限公司提供,实验动物许可证号为SCXK(京)2006-0009。动物饲养在首都医科大学实验动物部,实验动物许可证号:SYXK(京)2005-0022,所有实验均经首都医科大学伦理委员会批准。
1.2 实验药品和试剂
不完全福氏佐剂(incomplete freund's adjuvant,IFA)和结核分支杆菌病(mycobacterium tubercusis,H37Ra,MTB)由美国Difco公司生产。豚鼠MBP68-86(YGSLPQKSQRSQDENPV),HPLC>95%,由北京中科亚光生物科技有限公司合成。CAMP酶免试剂盒由美国Assay Designs公司生产。实时荧光定量RTPCR相关试剂由美国Takara及Invitrogen公司提供,引物由上海生工生物有限公司合成。DEPC H2O、Trizol试剂,由 Invitrogen公司提供。Fermentas K1622 RT逆转录试剂盒购自MBI公司。SYBR Green PCR Master Mix试剂盒购自美国应用生物公司。
1.3 EAE模型的诱导
将大鼠按数字表法随机分成5组,正常组(n=10)、大剂量 MBP68-86模型组(n=17)、中剂量 MBP68-86模型组、小剂量 MBP68-86组模型组(n=17)和 MBP87-99组(n=13)。按不同剂量 MBP68-86(每只分别 75、50、25 μg)和MBP87-99(每只150μg)制备 EAE 模型。各模型组大鼠用戊巴比妥钠(40 mg/kg)腹腔注射麻醉,双后足垫皮下多点一次性注射200 μL抗原(分别含75、50、25 μg MBP68-86或 150μg MBP87-99、100 μL IFA 及 2 mg结核杆菌的混合液)免疫诱导大鼠产生EAE。正常组只注射0.9%氯化钠注射液。
1.4 大鼠神经功能评分
造模后每天观察动物,发病后进行大鼠神经功能评分,其评分标准如下:未发病记为0分;鼠尾张力障碍记为1分;步态不稳记为2分;完全后肢瘫痪记为3分;完全肢体瘫痪记为4分;死亡记为5分[7]。
1.5 组织取材与病理学检查
大鼠造模后第14天和第28天,用10%水合氯醛10 mL/kg腹腔注射麻醉大鼠,打开胸腔,暴露心脏,经左心室灌注0.9%氯化钠注射液,然后用4%多聚甲醛心内灌注固定,取脑组织,常规处理,石蜡包埋,常规HE染色。光学显微镜下观察切片炎性细胞浸润情况。
1.6 各组大鼠脑组织APP、GAP-43及PKA mRNA的变化
取大鼠脑组织50~100 mg,根据Trizol reagent的说明提取总 RNA。提取 RNA溶于 20 μL的 1‰DEPC水,取1 μL稀释500倍,用核酸蛋白分析仪测RNA的浓度和纯度,取A260/A280在1.9-2.1(蛋白污染指标),A260/A230>2.0(试剂污染指标)的RNA样品做下一步实验,RNA的完整性通过凝胶电泳来确定。根据RT-PCR kit的说明合成cDNA(1 μg RNA)。PCR引物采用Gene Bank Accession公布的序列,通过primer primer 5.0计算机软件设计,由上海生工生物技术有限公司合成,引物序列见表1。PCR总体系12 μL,其组成为 RNA 样品量 2 μg,OligoDT 1μL,DEPC水补至12μL。Real time反应体系为:REAL SYBR Mixture(2×):10μL,上游引物(10μmol/L)和下游引物(10μmol/L)各 0.5μL,模板 1.5μL,加入 DEPC 水量至20μL。具体反应条件为:APP:95℃预变性5 min;95℃变性35 s,54℃退火35 s,每2个循环降1℃,72℃延伸60 s,循环40次,反应结束后,72℃延伸8 min,4℃保存;GAP-43、PKA和β-actin:95℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸90 s,循环40次;反应结束后,72℃延伸10 min,4℃保存。PCR产物1%的琼脂糖凝胶(0.5×TBE,每GelRed 0.8 μL 20 mL)电泳,实验数据处理后用△△Ct表示。
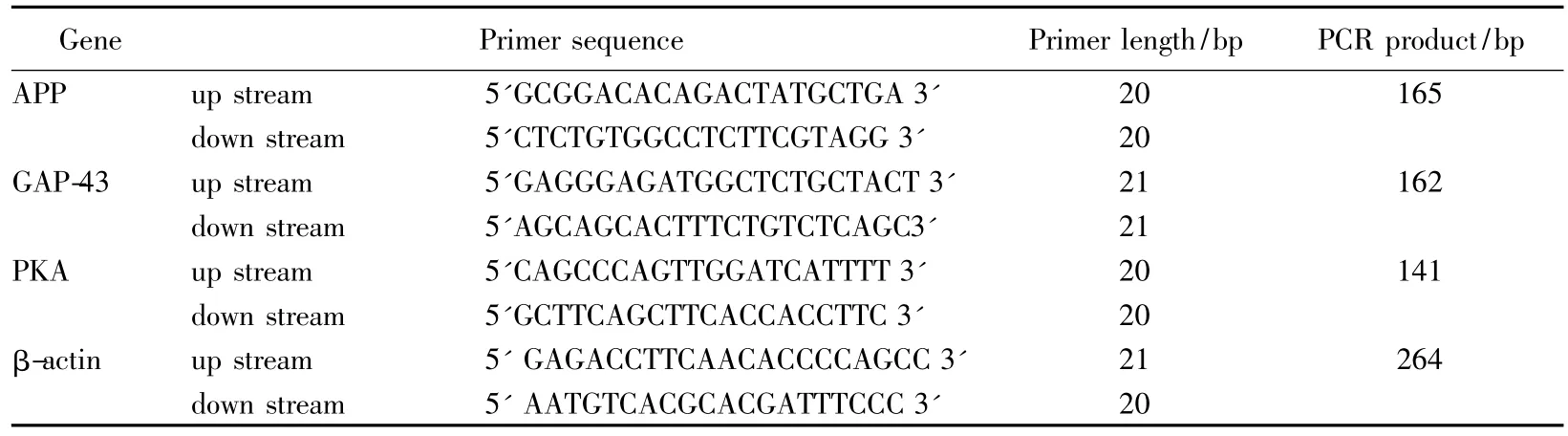
表1 各项检测指标引物序列Tab.1 Sequences of the primers of measured indicators
1.7 各组大鼠脑组织中cAMP的含量测定
称取50 mg大鼠脑组织,放入盛有2 mL冷的50 mmol/L,pH 4.75醋酸缓冲液的试管内,匀浆,加入2 mL无水乙醇,混匀,静止 5 min,3 500 r/min离心15 min,将上清液收集在青霉素小瓶内,再用75%乙醇2 mL洗沉淀,匀浆分散,混匀,3 500 r/min离心15 min。合并上清液,60℃烘箱中烘干,残渣放于4℃保存。测量时用1 mL醋酸缓冲液溶解,然后取0.1 mL测量,用酶免法按照说明书要求测定上述样品中cAMP含量。
1.8 统计学方法
运用SPSS 11.5进行统计学分析,所有数值均用均数±标准差表示,均采用单因素方差分析方法,用LSD检验比较两组间差异,对于非正态分布数据选用秩和检验,以P<0.05为差异具有统计学意义。
2 实验结果
2.1 EAE大鼠神经功能评分
各EAE模型组大鼠在造模第9天陆续发病,表现为体质量明显下降,尾部张力降低,双后肢无力,甚至瘫痪。第13天,MBP68-86不同剂量组大鼠的神经功能评分达到高峰,分别为3.4、3.1、3.3分,明显高于MBP87-99组的 2.3 分(P=0.018 和 P=0.004)。而MBP87-99组大鼠发病缓慢,在第16天达到高峰,为2.7分(表2)。随后评分逐渐下降,病情趋于平稳。
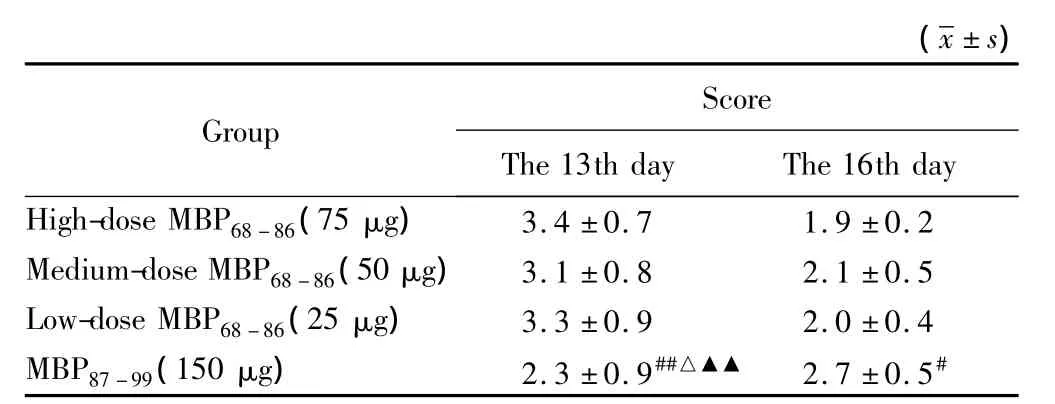
表2 EAE大鼠急性期神经功能评分Tab.2 Neurological score of EAE rats at acute stage
2.2 脑组织的病理学变化
HE染色光镜下显示,正常大鼠神经细胞胞质胞核分明,结构正常(见图1A)。各EAE模型组大鼠脑组织病理学改变类似,各模型组在急性期均可见小血管周围炎性细胞浸润和神经细胞核固缩,灰白质均可受累,炎性反应以脑室周围为主。MBP68-86各剂量组所致大鼠炎细胞浸润较重,有大量的淋巴细胞聚集在血管周围,并形成典型的袖套状改变(见图1B~D),MBP87-99所致大鼠炎细胞浸润较轻(见图1E)。
2.3 各组大鼠脑组织APP、GAP-43 mRNA的表达
免疫大鼠第14天,各组大鼠脑组织APP mRNA表达无明显变化。第 28天,中剂量 MBP68-86和MBP87-99大鼠 APP mRNA表达较正常组明显升高(P=0.028和 0.046),并且 MBP87-99组较小剂量MBP68-86组升高明显(P=0.036<0.05)。免疫后第14天,中剂量MBP68-86组大鼠脑组织 GAP-43 mRNA表达明显降低(P=0.042)。第 28天,中剂量MBP68-86和 MBP87-99组的表达较前升高,与正常组比较无明显统计学意义,MBP87-99组较大剂量 MBP68-86和小剂量MBP68-86升高明显(P=0.013和0.040)详见表3。

图1 各组大鼠急性期脑组织的病理学改变Fig.1 Pathological changes of rats brain tissues in each group at acute stage(HE,200×)
表3 各组大鼠脑组织APP mRNA、GAP-43 mRNA的表达Tab.3 mRNA expressions of APP and GAP-43 of rats brain tissues in each group )

表3 各组大鼠脑组织APP mRNA、GAP-43 mRNA的表达Tab.3 mRNA expressions of APP and GAP-43 of rats brain tissues in each group )
*P <0.05 vs normal group;#P <0.05 vs high-dose MBP68-86 group;▲P <0.05 vs low-dose MBP68-86 group;MBP:myelin basic protein;APP:amyloid precursor protein;GAP:growth-associated protein.
Group___________APP mRNA__The 14th day The 28th day_____________GAP-43 mRNA__The 14th day The 28th day__Normal Group 0.97 ±0.26 0.97 ±0.26 0.91 ±0.23 0.91 ±0.23 High-dose MBP68-86(75 μg) 0.84 ±0.38 1.09 ±0.10 1.09 ±0.30 0.67 ±0.33 Middle-dose MBP68-86(50 μg) 1.02 ±0.39 1.44 ±0.28* 0.79 ±0.11* 1.24 ±0.12 Low-dose MBP68-86(25 μg) 0.58 ±0.11 0.81 ±0.15 0.88 ±0.60 0.89 ±0.05_MBP87-99(150 μg) 0.84 ±0.51 2.38 ±0.89*▲ 1.13 ±0.52 1.61 ±0.42#▲
2.4 各组大鼠脑组织cAMP/PKA的变化
免疫大鼠后第14天,各组大鼠脑组织cAMP蛋白表达量及PKA mRNA相对表达量无明显变化。第28 天,大、小剂量 MBP68-86及 MBP87-99组 cAMP 水平均明显增高(P=0.008、P=0.049、P=0.010)。中剂量 MBP68-86与 MBP87-99组 PKA mRNA 表达明显高于正常组(P=0.017或 P=0.009),尤其是 MBP87-99组大鼠PKA mRNA表达还明显高于大剂量MBP68-86组(P=0.022),详见表 4。
3 讨论
MBP68-86或 MBP87-99与不完全福氏佐剂及结核杆菌混匀制成油包水的乳剂皮下注射均可制备Lewis大鼠 EAE 模型。Liu J Q 等[8-9]发现,MBP68-86是主要的抗原决定簇,而MBP87-99是很小的一个表位,给予高剂量的MBP87-99才能诱发EAE病理模型。本实验的研究结果也是如此,病理学发现大鼠脑组织有典型的炎性细胞浸润、脱髓鞘及轴突损伤等改变,但诱导的抗原剂量和EAE病变的程度不同。本实验又进一步研究了 MBP68-86及 MBP87-99对 EAE 大鼠轴突损伤、修复及其可能的分子机制。
表4 各组大鼠脑组织cAMP、PKA mRNA变化Tab.4 Changes of cAMP and the expression of PKA mRNA of rats brain tissue in each group ()
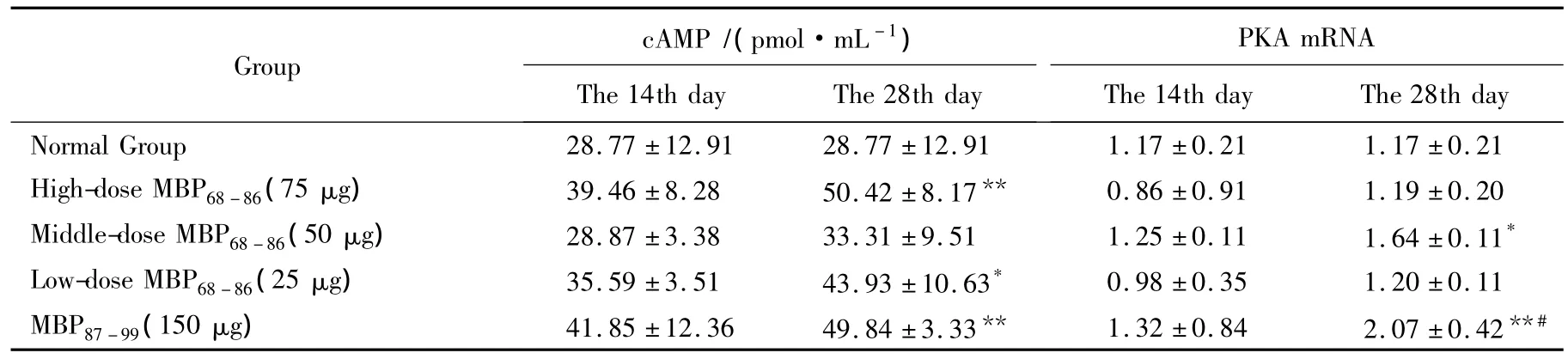
表4 各组大鼠脑组织cAMP、PKA mRNA变化Tab.4 Changes of cAMP and the expression of PKA mRNA of rats brain tissue in each group ()
*P <0.05,**P <0.01 vs normal group;#P <0.05 vs high-dose MBP68-86 group;PKA:protein kinase;MBP:myelin basic protein.
Group ________cAMP/(pmol·mL -1)____________________The 14th day The 28th day PKA mRNA________________The 14th day The 28th day___Normal Group 28.77 ±12.91 28.77 ±12.91 1.17 ±0.21 1.17 ±0.21 High-dose MBP68-86(75 μg) 39.46 ±8.28 50.42 ±8.17** 0.86 ±0.91 1.19 ±0.20 Middle-dose MBP68-86(50 μg) 28.87 ±3.38 33.31 ±9.51 1.25 ±0.11 1.64 ±0.11*Low-dose MBP68-86(25 μg) 35.59 ±3.51 43.93 ±10.63* 0.98 ±0.35 1.20 ±0.11_MBP87-99(150 μg)____________________________41.85 ±12.36 49.84 ±3.33** 1.32 ±0.84 2.07 ±0.42**#
Vogt J等[2]的发现显示,在MS和EAE的早期就有广泛的轴突损害,且在一定程度上与炎性反应有关,随着病程的进展,轴突的损伤逐渐加重,并导致不可逆性神经功能障碍。APP是正常神经元跨膜糖蛋白,由快速轴突运输转运,它的蓄积标志着急性活动性病灶内部及慢性活动性病灶边缘轴突功能障碍及损伤[10]。GAP-43为快速转运胞膜磷酸蛋白,只存在于已分化定型并开始轴突生长的神经元中,为神经损伤和修复的标志物[11]。本次实验选择这2个标志性蛋白,从转录水平上评价 MBP68-86与 MBP87-99诱导Lewis大鼠脑组织轴突损伤的作用。结果表明,中剂量MBP68-86免疫大鼠14天后,脑组织GAP-43 mRNA表达较正常大鼠明显降低,28天后APP mRNA表达较正常大鼠显著提高。中剂量MBP68-86免疫大鼠可导致神经元物质代谢和蛋白质合成能力下降,轴突终末GAP-43 mRNA表达减少,轴浆运输障碍,免疫反应性APP物质堆积。可作为探索多发性硬化轴突损伤的病理特点及药物干预的实验模型。
MS病变内广泛轴突缺失的确切机制尚未明确。环磷酸腺苷(cAMP)是细胞内重要的第2信使,Mizrachi K等[12]研究发现,EAE大鼠细胞内cAMP水平提高,可抑制EAE大鼠Th1细胞,并且降低IFN-γ和TNF-α水平,阻止EAE的发生。cAMP可通过激活PKA系统促进神经生长或阻止抑制信号的传递[13]。本研究通过观察脑组织cAMP含量及PKA mRNA表达的变化,以了解不同肽段MBP致EAE大鼠脑组织cAMP-PKA信号途径的变化。MBP87-99免疫28 d,大鼠脑组织 cAMP与 PKA mRNA均明显增高,而MBP68-86免疫大鼠脑组织 cAMP含量与 PKA mRNA的表达水平并不完全对应。中剂量免疫大鼠第28天后,脑组织PKA mRNA表达虽明显高于正常组,但cAMP蛋白水平较正常组没有明显变化,而大剂量和小剂量免疫大鼠cAMP蛋白水平明显增高,但PKA mRNA表达与正常组相比,差异无统计学意义。结合动物发病情况和病理变化,MBP87-99组大鼠发病进展缓慢、病程长、神经功能评分较低、病死率低、炎细胞浸润较轻,而MBP68-86所致EAE模型疾病进展较快、动物神经功能评分较高,急性期常导致动物偏瘫乃至部分死亡,炎细胞浸润较重。MBP87-99免疫大鼠病情较轻,可能通过上调cAMP水平,激活PKA转录水平的表达,促进了轴突损伤后的自我修复。MBP68-86免疫后可能通过如ATP、腺苷酸环化酶和磷酸二酯酶活性,影响cAMP含量。深入了解cAMP-PKA信号途径促进轴突再生以及cAMP-PKA与其他因子或信号之间的相互影响等问题,将为监测MS发病情况及MS的预防和治疗提供了新的途径和希望。
[1]Herz J,Zipp F,Siffrin V.Neurodegeneration in autoimmune CNS inflammation[J].Exp Neurol,2010,225(S1):9-17.
[2]Vogt J,Paul F,Aktas O,et al.Lower motor neuron loss in multiple sclerosis and experimental autoimmune encephalomyelitis[J].Ann Neurol,2009,66(3):310-322.
[3]Mix E,Meyer-Rienecker H,Hartung H P,et al.Animal models of multiple sclerosis-Potentials and limitations[J].Prog Neurobiol,2010,92(3):386-404.
[4]王蕾,樊永平,龚慕辛,等.二黄胶囊对大鼠实验性变态反应性脑脊髓炎淋巴细胞亚群和自然杀伤细胞的影响[J].中药新药与临床药理,2008,19(3):165-169.
[5]周莉,樊永平,王蕾,等.二黄方对EAE大鼠细胞因子及Th1/Th2平衡的影响[J].首都医科大学学报,2009,30(1):20-23.
[6]Wang Y Z,Kou S,Tang J C,et al.Amyloid precursor protein and growth-associated protein-43 expression in brain white matter and spinal cord tissues in a rat model of experimental autoimmune encephalomyelitis[J].Neural Regen Res,2011,6(2):101-106.
[7]Mao Y S,Lu C Z,Wang X,et al.Induction of experimental autoimmune encephalomyelitis in Lewis rats by a viral peptide with limited homology to myelin basic protein[J].Exp Neurol,2007,206(2):231-239.
[8]Liu J Q,Bai X F,Shi F D,et al.Inhibition of experimental autoimmune encephalomyelitis in Lewis rats by nasal administration of encephalitogenic MBP peptides:synergistic effects of MBP68 -86 and MBP87 -99[J].Int Immunol,1998,10(8):1139-1148.
[9]尹琳琳,林丽莉,王蕾,等.实验性自身免疫性脑脊髓炎大鼠模型建立及病理特征[J].首都医科大学学报,2011,32(1):84-89.
[10]Coleman M.Axon degeneration mechanisms:commonality amid diversity[J].Nat rev neurosci,2005,6(11):889-898.
[11]Casoli T,Stefano G D,Fattoretti P,et al.GAP-43 mRNA detection by in situ hybridization,direct and indirect in situ RT-PCR in hippocampal and cerebellar tissue sections of adult rat brain[J].Micron,2003,34(8):415-422.
[12]Mizrachi K,Aricha R,Feferman T,et al.Involvement of phosphodiesterases in autoimmune diseases[J].J Neuroimmunol,2010,220(1-2):43-51.
[13]Neumann S,Bradke F,Tessier-Lavigne M,et al.Regeneration of sensory axons within the injured spinal cord induced by intraganglionic cAMP elevation[J].Neuron,2002,34(6):885-893.

