RNAi干扰电压门控钠通道scn8a基因对人宫颈癌SiHa细胞侵袭转移的影响
潘惠艳 赵 群 詹 阳 赵丽红 张卫华 吴玉梅
(1.首都医科大学附属北京妇产医院中心实验室,北京 100026;2.首都医科大学附属北京妇产医院妇瘤科,北京 100026;3.首都医科大学附属北京妇产医院病理科,北京 100026)
宫颈癌是女性常见的恶性肿瘤之一,侵袭和转移是影响宫颈癌患者预后的关键因素。电压门控钠通道(voltage-gated sodium channels,VGSC)蛋白家族由九个成员组成,分别命名为Nav1.1~Nav1.9,其主要分布于神经、肌肉和神经内分泌细胞,负责细胞膜的兴奋和传播动作电位[1]。近年来,研究显示[2-3]VGSC在一些转移的癌细胞中表达,如Nav1.5亚型在乳腺癌、卵巢癌和结肠癌细胞中表达,Nav1.7亚型主要在前列腺癌细胞中表达,其与癌细胞的迁移和侵袭呈正相关。目前,国内外对VGSC在宫颈癌细胞中的研究较少,已发现在宫颈癌原代培养细胞中检测到VGSC电流,scn8a基因编码的产物Nav1.6亚型特异性阻止剂可抑制其电流,亦抑制细胞的侵袭[4]。首都医科大学附属北京妇产医院的前期研究[5]提示宫颈癌SiHa细胞株表达VGSC蛋白,但其表达亚型和作用仍不清楚。本研究采用RNA干扰(RNA interference,RNAi)技术,使用针对scn8a基因小干扰RNA(small interference RNA,siRNA)转染宫颈癌SiHa细胞,观察其对细胞增生、迁移和侵袭的影响,探讨VGSC在宫颈癌细胞中的作用。
1 材料与方法
1.1 材料
1)细胞株:人宫颈癌细胞株SiHa细胞购自中国医学科学院基础医学研究所。
2)试剂:10%胎牛血清和DMEM培养液(美国Gibico公司);5'-荧光素氨基磷酸酯-siRNA(6-FAM-siRNA,上海吉玛制药技术有限公司合成);Trizol和转染试剂Lipofectamine 2000(美国Invitrogen公司);RTPCR试剂盒(美国Promega公司);兔抗人Nav1.6多克隆抗体(以色列Alomone labs公司);抗β-肌动蛋白(β-actin)抗体(美国Sigma公司);Matrigel胶(美国BD公司)。
3)仪器和耗材:M450酶标仪(美国 Bio-Rad公司);FS-919PCR扩增仪(中国上海复生生物研究所产);细胞培养皿(美国Coring Costar公司);细胞培养箱(美国Thermo公司);Transwell小室(美国 Coring Costar公司)。
1.2 细胞培养及转染
人宫颈癌SiHa细胞孵育于37℃、5%CO2、饱和湿度的培养箱及含有10%胎牛血清的DMEM培养液中,经0.25%胰蛋白酶消化传代。将SiHa细胞以5×105个/孔接种于6孔板培养48 h后,利用脂质体LipofectamineTM2000将体外合成的siRNA转染细胞。每次实验分为4个组:空白对照组(未转染组)、脂质体组(Lipo对照组)、转染阴性对照(negative control,NC)组和scn8a RNAi转染组。参考来自GenBank的scn8a基因序列(序列号:374429548),由上海吉玛公司设计合成siRNA寡聚核苷酸片段序列为5'-CCCAGUUCAUUGAGUACUGUA-3'(靶点为721~739 bp)。合成的阴性对照siRNA序列的有意义链分别为5'-UUCUCCGAACGUGUCACGUAA-3',此顺序与人类基因无同源性。
1.3 总RNA提取及RT-PCR
采用半定量RT-PCR法检测scn8a mRNA的表达水平。SiHa细胞转染48 h后,用Trizol试剂提取细胞中总RNA,取总RNA 1μg,反转录获得cDNA,再进行半定量RT-PCR反应。目的基因scn8a的引物序列:上游引物5'-AGACCATCCGCACCATCCTG-3',下游引物 5'-GGTCAACGGTATGTAGTGC-3',扩增片段为517 bp。以 β-actin为内对照,扩增片段为268 bp。PCR反应条件为:95℃ 3 min后,94℃ 30 s,60℃30 s,72 ℃ 30 s,设定36 个循环。在扩增24、28、32 和36个循环时,取3μL PCR产物在1.5%琼脂糖凝胶中电泳,结果用溴化乙锭染色后紫外照相并进行扫描分析,以scn8a和 β-actin条带的吸光度值进行 scn8a mRNA表达水平定量分析,scn8a mRNA的相对含量=scn8a条带光密度吸光度值/β-actin条带的吸光度。
1.4 Western blotting
SiHa细胞转染48 h后,提取各实验组细胞总蛋白,BCA法测定蛋白浓度后,每泳道以50 μg蛋白质样品进行6%SDS-PAGE凝胶电泳,恒压100 mV电泳2 h后,恒流250 mA转膜4 h,5%脱脂奶粉封闭2 h,用兔抗鼠Nav1.6多克隆抗体(1:500)于4℃培育过夜,TBST漂洗3次后加入辣根过氧化物酶标记的羊抗兔二抗(1∶5 000),37℃摇床温育2 h,经ECL系统曝光显影,通过凝胶分析系统分析蛋白的表达。β-actin为内对照。Nav1.6蛋白的相对含量=Nav1.6蛋白条带吸光度值/β-actin(内对照)条带吸光度值。
1.5 MTT法测定细胞增生实验
转染SiHa细胞48 h,收集各组细胞。用PBS洗涤细胞后,以每孔1×105/mL的密度接种于96孔板中,再培养48 h后,每孔加入MTT(5 mg/mL)试剂,37℃孵育4 h,加入150 μL/孔的二甲基亚砜溶液,在酶标仪测定492 nm波长处各孔的吸光度值。各组细胞增生抑制率=[(对照组吸光值-实验组吸光值)/对照组吸光值]×100%。
1.6 划痕实验检测细胞的迁移能力
SiHa细胞转染48 h,收集各组细胞。PBS洗涤细胞后,用含10%胎牛血清DMEM培养基制成细胞悬液,按8×105个/孔的密度接种到6孔板培养24 h后,吸掉培养液,用10 μL洗液尖(Tip头)沿着培养板底部划“一”字形划痕,PBS洗去未贴壁细胞,拍照记录,并在划痕每侧边缘均匀选取30个点后取其中线代表划痕边缘,在带有标尺的倒置显微镜下测量细胞划痕间距,记录间距(0 h)。划痕后24 h,细胞换液,在48 h,同法在每侧边缘均匀选取30个点后取其中线代表划痕边缘,记录间距(48 h)。细胞迁移距离=间距(0 h)-间距(48 h)。
1.7 Matrigel侵袭实验
在12孔板Transwell上室加入1 g/L的Matrigel胶50 μL,置于37 ℃、5%CO2、饱和湿度培养箱中过夜。胶凝固后,下室加入含10%胎牛血清的DMEM培养液500 μL。SiHa细胞转染48 h,每组细胞以2 ×105个/孔置于200 μL悬液(含1%胎牛血清的DMEM)加入Transwell上室,置37℃、5%CO2饱和湿度培养箱中培养48 h后,取出上室,下室以95%乙醇固定15 min,HE法染色,计数侵入下室的细胞。计数时取中央和四周各5个视野,计算平均值。细胞的侵袭指数/%=(下室细胞数/上室接种细胞数)×100%。
1.8 统计学方法
应用SPSS11.5软件进行统计学分析。数据以均数 ±标准差()表示,用单因素方差分析及均数多重比较。两样本均数间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 siRNA的转染率及对scn8a mRNA和Nav1.6蛋白表达水平的影响
以6-FAM荧光标记的阴性对照RNA及特异siRNA转染SiHa细胞6 h后,在荧光显微镜下观察转染效率,均可见达90%左右,详见图1A。
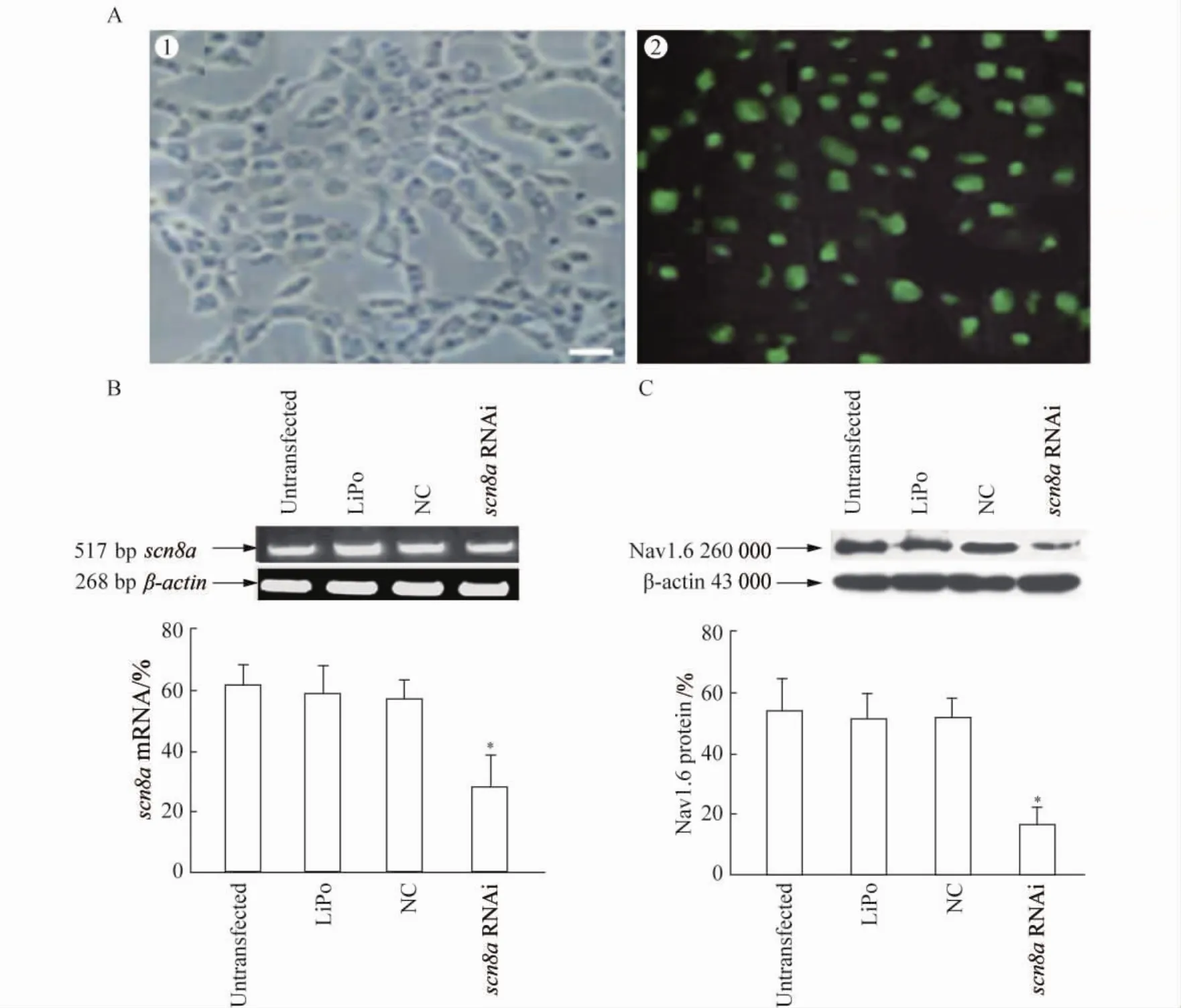
图1 siRNA转染效率及其对scn8a mRNA和Nav1.6蛋白表达水平的影响Fig.1 Transfection efficiency and the expression of mRNA and Nav1.6 protein after RNAi targeting scn8a
为了解siRNA对SiHa细胞scn8a mRNA水平的影响,转染细胞48 h后,提取各组细胞RNA,半定量RTPCR结果显示(图1B),RNAi组scn8a mRNA相对值为(23.3±4.2)%,明显低于未转染组(62.5±3.6)%、Li-Po组(59.6±5.0)%和阴性 RNAi转染组(58.0±3.5)%,与3者比较差异有统计学意义(P<0.05)。RNAi组较未转染组scn8a mRNA水平降低(62.7±5.8)%(P<0.05),而LiPo组和阴性RNAi转染组与未转染组比较,差异无统计学意义(P=0.291)。
在SiHa细胞转染48 h后,使用Western blotting检测各组Nav1.6蛋白水平(图1C),结果显示RNAi组Nav1.6蛋白相对值为(18.6±3.8)%,表达水平明显低于未转染组(54.3±6.4)%、LiPo组(50.7±5.1)%和阴性RNAi转染组(52.5±4.6)%。RNAi组较未转染组Nav1.6蛋白表达降低(65.8±5.8)%(t=3.17,P <0.05),LiPo组和阴性 RNAi转染组分别与未转染组比较,差异无统计学意义(P>0.05)。
2.2 scn8a的 RNAi对宫颈癌 SiHa细胞的增生无影响
MTT法检测结果显示(表1),SiHa细胞在siRNA转染48 h后细胞吸光度值(0.556±0.038)与未转染组(0.545±0.043)、LiPo对照组(0.560±0.048)和阴性RNAi转染组(0.549±0.036)吸光值比较,差异无统计学意义(P>0.05),提示Nav1.6活性未影响SiHa细胞的增生。
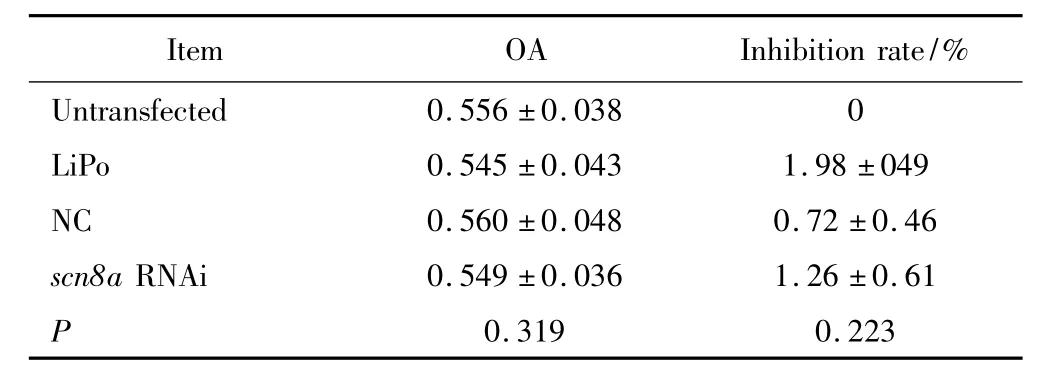
表1 siRNA抑制scn8a表达对SiHa细胞增生无影响Tab.1 siRNA targeting scn8a had no effect on proliferation of cervical cancer SiHa cells
2.3 scn8a的RNAi降低宫颈癌 SiHa细胞的迁移能力
划痕实验结果显示(图2),RNAi组24 h细胞的迁移距离(0.28±0.04)mm明显小于未转染组(0.63±0.06)mm、LiPo组(0.58±0.05)mm和阴性RNAi转染组(0.61±0.04)mm,与3者分别进行比较,差异有统计学意义(P<0.05)。RNAi组较未转染组迁移距离降低55.6%(t=3.68,P<0.05),而LiPo组和阴性RNAi转染组与未转染组比较,差异无统计学意义(P=0.213)。
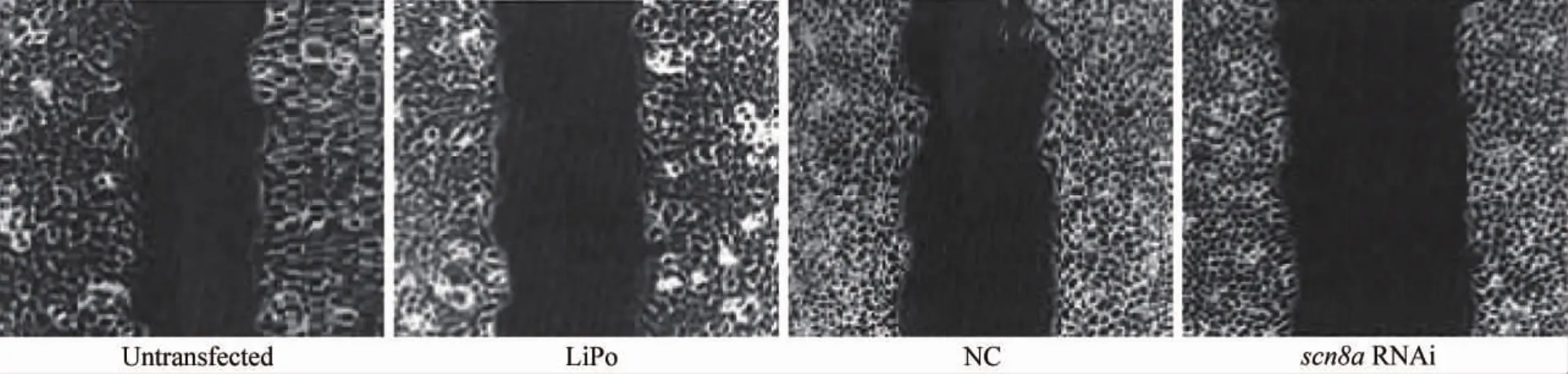
图2 划痕48 h后,SiHa细胞的迁移结果Fig.2 The‘wound’images at 48 h after initial‘wound’(100 ×)
2.4 scn8a的 RNAi抑制宫颈癌 SiHa细胞的侵袭能力
Magrigel侵袭实验结果表明(图3),RNAi组SiHa细胞的侵袭指数(8.2±2.4)%明显低于未转染组(13.0±1.8)%、LiPo组(13.3±2.0)%和阴性RNAi转染组(13.6±1.6)%,RNAi组与其余3者进行统计学比较,差异有统计学意义(t=2.98,P<0.05)。RNAi组细胞侵袭较空白对照组降低36.9%(t=2.98,P<0.05),LiPo组和阴性 RNAi转染组分别与未转染组比较,差异无统计学意义(P>0.05)。
3 讨论

图3 针对scn8a基因siRNA降低SiHa细胞的侵袭能力Fig.3 Transfection of siRNA targeting scn8a gene supressed the Matrigel invasion of cervical cancer SiHa cells.
VGSC是“可兴奋”细胞膜上的跨膜糖蛋白,依赖细胞膜上电压变化而激活。VGSC家族由九个成员组成,其中Nav1.6和Nav1.7主要表达于外周神经,Nav1.5主要表达于心肌,Nav1.4主要表达于骨骼肌,其他亚型分别表达于外周和中枢神经细胞[6]。有报道[7],scn8a基因突变常会导致肌张力障碍、震颤、共济失调等异常,其他亚型的异常可引起癫痫、慢性疼痛综合征、阿尔茨海默病(Alzheimer)等疾病。随着近年来对肿瘤研究的深入,有报道[2-3]显示VGSC在乳腺癌、卵巢癌、结肠癌、前列腺癌、小细胞肺癌等细胞中表达,其涉及肿瘤细胞的侵袭转移。RNAi技术是mRNA水平上沉默特定基因的一种较新方法,能够抑制内源性或外源性基因的表达,具有稳定性高、快捷、高效特异等优点,已成为肿瘤研究中的理想工具。
本研究采用RNAi技术沉默宫颈癌SiHa细胞scn8a基因表达,观察到细胞可有效转染并明显抑制scn8a mRNA及其蛋白Nav1.6水平,表明实验所用的RNAi干扰序列特异性地抑制scn8a表达。在观察RNAi沉默scn8a基因表达后细胞的增生变化时,未观察到其对SiHa细胞增生有显著影响。此结果与本课题组前期在宫颈癌ME180细胞的研究结果[5]相一致,VGSC阻滞剂海豚毒素(tetrodotoxin,TTX)对ME180细胞的增生无明显影响,这亦提示Nav1.6活性未涉及宫颈癌细胞的增生。目前对VGSC涉及肿瘤细胞增生有不同报道,有报道[8]显示Na+内流促进癌细胞的增生,如瞬间Na+内流发生于增生早期,控制外在Na+浓度可有效抑制细胞增生[8]。在人脐静脉内皮细胞检测到 Nav1.5和 Nav1.7亚型,其中RNAi抑制Nav1.5表达可抑制细胞增生[9]。然而,在高转移潜能的前列腺癌Mat-Lylu细胞和乳腺癌MDAMB-231细胞,TTX对细胞增生无作用,即VGSC活性不涉及癌细胞的增生[10-11]。这些差异可能是由于细胞类型不同所导致。
本研究显示,RNAi沉默宫颈癌SiHa细胞scn8a基因表达后,细胞的迁移和Matrigel侵袭明显下降,这说明Nav1.6表达参与宫颈癌细胞的侵袭转移。有报道[12-13]显示小鼠前列腺癌Mat-Lylu细胞和人前列腺癌PC-3细胞主要表达Nav1.7亚型,VGSC阻断剂TTX分别抑制细胞迁移达47%和61%,抑制细胞Matrigel侵袭达33%和42%。乳腺癌高转移潜能的MDA-MB-231细胞表达Nav1.5亚型,TTX抑制细胞的迁移Matrigel侵袭分别为52%和49%[11]。House C D等[3]报道在结肠癌 HT29、SW620和 SW480细胞中检测到Nav1.5亚型,针对scn5a基因RNAi和钠离子通道阻滞剂TTX均抑制细胞Matrigel侵袭超过50%。在人脐静脉内皮细胞中,RNAi阻止Nav1.7表达可抑制细胞的趋向运动[9]。这些结果支持目前在宫颈癌SiHa细胞中的发现,即VGSC Nav1.6亚型涉及细胞的迁移和侵袭。
目前对VGSC参与肿瘤细胞侵袭转移的机制仍不清楚,考虑有以下两个方面[14-15]:①VGSC表达可引起细胞内Na+浓度增加,进而使细胞内环境改变,其中包括 Ca2+浓度增加[16](Na+/Ca2+交换增多)、pH发生变化[17](Na+/H+交换增多,H+-ATP酶活性增加)以及Na+依赖的酶(蛋白激酶A、组织蛋白酶等)激活[18],其可引起癌细胞迁移、侵袭和分泌等细胞行为的改变,涉及到癌细胞侵袭转移。②VGSC由α或β亚单位组成,其均可与细胞膜/或细胞质内蛋白结合[19],其中包括细胞骨架蛋白锚蛋白(ankyrin),黏附分子等[20],最终影响细胞的转移。
综上所述,本研究结果提示,VGSC Nav1.6亚型在宫颈癌SiHa细胞中表达,利用siRNA可有效抑制scn8a表达,进而抑制SiHa细胞的迁移和侵袭能力,这对于开发和利用scn8a基因作为治疗宫颈癌转移的靶点提供了新的思路。
[1]毛青,江基尧.电压门控钠通道α亚单位在中枢神经系统中的表达及其病理生理意义[J].中华神经医学杂志,2009,8(3):310-312.
[2]潘惠艳,黄秉仁.电压门控钠离子通道与恶性肿瘤的转移[J].生理科学进展,2011,42(3):217-220.
[3]House C D,Vaske C J,Schwartz A M,et al.Voltage-gated Na+channel SCN5A is a key regulator of a gene transcriptional network that controls colon cancer invasion [J].Cancer Res,2010,70(17):6957-6967.
[4]Hernandez-Plata E,Ortiz C S,Marquina-Castillo B,et al.Over expression of Nav1.6 channels is associated with the invasion capacity of human cervical cancer[J].Int J Cancer,2012,130(9):2013-2023.
[5]潘惠艳,赵群,詹阳,等.电压门控钠离子通道表达对宫颈癌细胞增殖、侵袭转移作用的研究[J].中国肿瘤临床,2012,39(4):189-193.
[6]于耀清,陈军.电压门控性钾、钙、钠离子通道的结构及分类[J].中华神经医学杂志,2005,4(5):515-520.
[7]Andavan G S,Lemmens-Gruber R.Voltage-gated sodium channels:mutations,channelopathies and targets[J].Curr Med Chem,2011,18(3):377-397.
[8]Abdul M,Hoosein N.Voltage-gated potassium ion channels in colon cancer[J].Oncol Rep,2002,9(5):961-964.
[9]Andrikopoulos P,Fraser S P,Patterson L,et al.Angiogenic functions of voltage-gated Na+channels in human endothelial cells:modulation of vascular endothelial growth factor(VEGF)signaling[J].J Biol Chem,2011,286(19):16846-16860.
[10]Fraser S P,Grimes J A,Djamgoz M B.Effects of voltagegated ion channel modulators on rat prostatic cancer cell proliferation:comparison of strongly and weakly metastatic cell lines[J].Prostate,2000,44(1):61-76.
[11]Fraser S P,Diss J K,Chioni A M,et al.Voltage-gated sodium channel expression and potentiation of human breast cancer metastasis[J].Clin Cancer Res,2005,11(15):5381-5389.
[12]Brackenbury W J,Djamgoz M B.Activity-dependent regulation of voltage-gated Na+channels expression in Mat-lylu rat prostate cancer cell line [J].J Physiol,2006,573(Pt2):343-356.
[13]Fraser S P,Salvador V,Manning E A,et al.Contribution of functional voltage-gated Na+channel expression to cell behaviours involved in the metastatic cascade in rat prostate cancer:I.Lateral motility[J].J Cell Physiol,2003,195(3):479-487.
[14]Onkal R,Djamgoz M B.Molecular pharmacology of voltage-gated sodium expression in metastatic disease:clinical potential of neonatal Nav1.5 in breast cancer[J].Eur J Pharmacol,2009,625(1-3):206-219.
[15]Brackenbury W J,Djamgoz M B,Isom L L.An emerging role for voltage-gated Na+channels in cellular migration:regulation of central nervous system development and potentiation of invasive cancers[J].Neuroscientist,2008,14(6):571-583.
[16]Roger S,Potier M,Vandier C,et al.Voltage-gated sodium channels:new targets in cancer therapy?[J].Curr Pharm Des,2006,12(28):3681-3695.
[17]Brisson L,Gillet L,Calaghan S,et al.Nav1.5 enhances breast cancer cell invasiveness by increasing NHE1-dependent H(+)efflux in caveolae[J].Oncogene,2011,30(17):2070-2076.
[18]Chioni A M,Shao D,Grose R,et al.Protein kinase A and regulation of neonatal Nav1.5 expression in human breast cancer cells:activity-dependent positive feedback and cellular migration[J].Int J Biochem Cell Biol,2010,42(2):346-358.
[19]Shao D,Okuse K,Djamgoz M B.Protein-protein interactions involving voltage-gated sodium channels:post-translational regulation,intracellular trafficking and functional expression[J].Int J Biochem Cell Biol,2009,41(7):1471-1481.
[20]Jenkins S M,Bennett V.Ankyrin-G coordinates assembly of the spectrin-based membrane skeleton,voltage-gated sodium channels,and L1 CAMs at Purkinje neuron initial segments[J].J Cell Biol,2001,155(5):739-746.

