富铁酵母发酵条件的优化
山东宝来利来生物工程股份有限公司 徐海燕 张志焱 谷巍
目前,在国内饲料中铁元素主要以无机制剂形态添加,由于这些制剂在储存或消化过程中会被酸化,从而使Fe2+变成难吸收的Fe3+(王利伟等,2002)。无机铁与有机铁相比具有不易吸收,对黏膜有刺激性,胃肠道副作用较大和不具有生物活性的特点(Gaudreau等,2001)。研究证实,酵母是一种较为理想的微量元素载体(李志东等,2006)。对于富铁酵母而言,其主要是利用酵母细胞吸收多、转化快的特性,使其作为微量元素的载体,在细胞内将无机铁转化成有机形式,提高铁的利用率,还可为动物机体提供大量的菌体蛋白、多肽、小肽、消化酶、氨基酸、丰富的B族维生素以及其他生物活性物质(许祯莹等,2010)。本试验拟研究酵母菌富集微量元素铁的影响因素,并确定富铁酵母的最佳培养条件,为富铁酵母的发酵生产提供试验依据。
1 材料与方法
1.1 菌种 5株产朊假丝酵母 (Candida utilis),编号为 CRJ1、CRJ2、CRJ3、CRJ4、CRJ5;2 株啤酒酵母,编号为PJ1、PJ2。均由山东宝来利来生物产业集团生物研究院菌种保藏中心提供。
1.2 培养基 斜面培养基:PDA培养基;种子培养基:10°Bx的麦芽汁培养基,取1份麦芽粉加5份水,65℃水浴中保温4 h,使其糖化,直至糖化完全 (检查方法是取0.5 mL的糖化液,加2~3滴碘液,如无蓝色出现,即表示糖化完全);发酵培养基:采用YPD培养基,葡萄糖40 g/L、蛋白胨10 g/L、酵母浸膏5 g/L、磷酸氢二钾2 g/L,pH 6.0。
1.3 主要试剂 硫酸亚铁、硫酸铁铵、硝酸铁、邻二氮菲、盐酸羟胺等均为分析纯。
1.4 主要仪器 高压灭菌锅、超净工作台、酸度计、超声波破碎仪、恒温培养箱、摇床、UV-2000紫外可见分光光度计、电子天平、高速离心机、电热板等。
1.5 方法
1.5.1 培养方法
1.5.1.1 液体种子将活化好的斜面菌种接种于种子培养基 (50 mL/250 mL三角瓶)中,28℃培养16 h左右。
1.5.1.2 酵母细胞培养 将培养好的种子以5%的接种量接种到含有Fe2+的发酵培养基中,28℃,180 r/min培养。其他培养条件由具体的试验确定。
1.5.2 分析方法
1.5.2.1 菌体生物量的测定 取一定体积发酵液5000 r/min离心20 min,弃上清液,蒸馏水洗涤3次,最后收集菌体,60~70℃干燥后称重即得。
1.5.2.2 酵母细胞铁含量的测定 将富铁酵母细胞发培养液5000 r/min离心20 min,弃上清液,沉淀用蒸馏水冲洗3次后,收获菌体,干燥至恒重后,采用邻二氮菲比色法测定铁的含量(成都科学技术大学与浙江大学化学教研室,1993)。
1.5.2.3 富铁酵母中有机铁和无机铁的测定 收集培养后的酵母菌液,5000 r/min离心20 min后弃上清液,然后用蒸馏水冲洗沉淀,再离心,重复3次,最后收集菌体4℃冷藏备用。准确称取一定量冷藏备用的菌体配制为25 mL悬浮液(加入相当于6倍菌体重的含10%甘油,20 mmol/L Mg-Cl2·6H2O,pH 为 8.6 的 0.1 mol/L Tris-HCl缓冲液),破碎细胞后得到上清液(包括无机铁和铁蛋白)。在上清液中加入60%固体硫酸铵粉末,轻微振荡5 min后静置2 h,5000 r/min离心20 min以沉降含铁蛋白。取上清液测定无机铁含量。沉降的细胞残片和含铁蛋白65℃烘干后,混匀,取样测定有机铁含量。
1.5.3 试验设计
1.5.3.1 菌种筛选 将7株试验菌株接入种子培养基中,28℃,180 r/min振荡培养16 h。以5%的接种量接种到含硫酸亚铁量为 600 μg/mL的YPD培养基中,28℃,180 r/min振荡培养24 h。收集菌体测定生物量和铁含量。
1.5.3.2 不同铁盐对铁富集的影响 选用几种常用的铁盐作为铁源,铁离子浓度均为400 μg/mL。28℃,180 r/min振荡培养36 h后,测定生物量、酵母细胞内的铁含量、总铁含量及转化率。
1.5.3.3 铁离子浓度对富铁酵母的影响 将酵母依次接种到铁含量为 0、200、400、600、800、1200、1600、2000 μg/mL 的发酵培养基中,28 ℃振荡培养36 h,测定其生物量、酵母细胞内的铁含量、总铁含量及转化率。
1.5.3.4 起始pH对富铁酵母的影响 将发酵培养 基 的 初 始 pH 分 别 调 为 4.0、4.5、5.0、5.5、6.0、6.5、7.0,每 500 mL三角瓶装液量 50 mL,接种量2%,28℃振荡培养36 h,测定其生物量、酵母细胞内的铁含量、总铁含量及转化率。
1.5.3.5 接种量对富铁酵母的影响 在500 mL三角瓶装入50 mL发酵培养基,将液体种子按2%、4%、6%、8%、10%的量接入到上述培养基中,28℃振荡培养36 h,测定其生物量、酵母细胞内的铁含量、总铁含量及转化率。
1.5.3.6 装液量对富铁酵母的影响 在500 mL三角瓶中分别装入不同体积的发酵培养基,其他条件相同,28℃振荡培养36 h,测定其生物量、酵母细胞内的铁含量、总铁含量及转化率。
1.5.3.7 不同加铁时间对富铁酵母的影响 在其他条件相同的情况下,分别在发酵0、12、18、24 h向培养基中加入硫酸亚铁至浓度为800 μg/mL来Fe2+,培养36 h结束,测定生物量、酵母细胞中铁的含量、总铁含量及转化率。
1.5.3.8 实验室发酵罐培养 富铁酵母菌株生长曲线的测定:在装有5.0 L发酵培养基的7.0 L机械搅拌发酵罐中,根据实验室三角瓶筛选出的最佳培养条件进行恒定pH培养。
2 结果与分析
2.1 菌种筛选 由表1可知,7株酵母菌对铁的耐受能力均较强,产朊假丝酵母的生物量较高,均在1.20 g/100mL以上,啤酒酵母的稍低,但也均在1.00 g/100 mL以上。铁的转化率均在50%以上,酵母细胞中的铁含量均比较高,在24000 μg/g以上,其中CRJ3的转化率最高,达70.2%,酵母细胞中的铁含量达到31200 μg/g,且总铁含量也最高,达到421.2 mg/L。综合考虑,以CRJ3作为试验用菌株。
2.2 不同铁盐对铁富集的影响 由表2可知,在相同的培养条件下,菌株CRJ3细胞与各种铁化合物均能产生结合。试验所用的5种铁盐对其生物量的影响较小,但对铁的富集有较大的影响,其中硫酸亚铁作为铁源时,酵母细胞中的铁及总铁含量均最高,达到21124 μg/g和293.6 mg/L,转化率为73.4%,因此,在后续的试验中采用硫酸亚铁作为铁源。
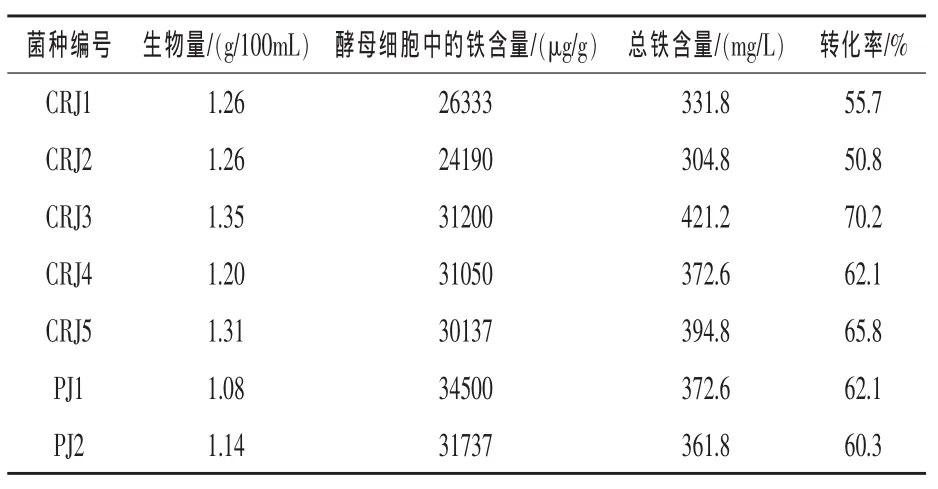
表1 7株酵母菌富铁能力比较
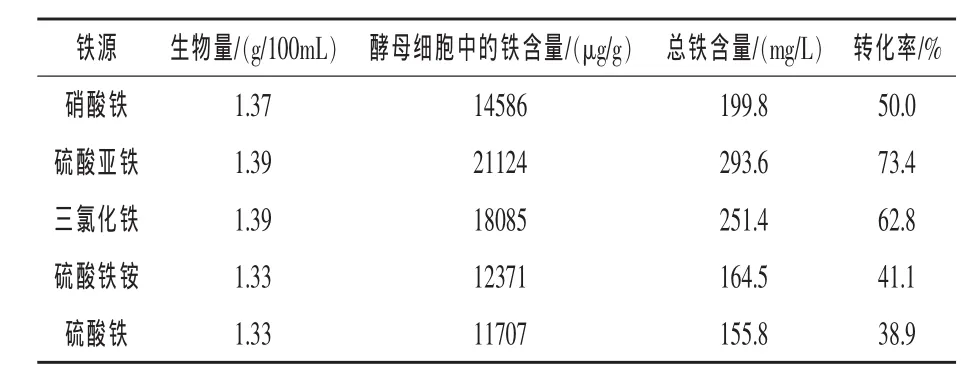
表2 不同铁盐对铁富集的影响
2.3 铁盐浓度对富铁酵母的影响 不同硫酸亚铁浓度下菌株CRJ3的细胞生物量及铁富集情况见表3。由表3可知,铁盐浓度在0~800 μg/mL范围内变化时,菌株CRJ3的生长趋于平缓,且总铁含量在800 μg/mL时达到最高,为508.1 mg/L;当起始浓度高于800 μg/mL时,随着培养基中铁浓度的升高菌株的生长受到明显的抑制,但总铁含量差异不显著。综合考虑,确定培养基中起始铁浓度为 800 μg/mL。

表3 培养基中Fe2+添加量对富铁酵母的影响
2.4 起始pH对富铁酵母的影响 由表4可知,pH对酵母的生长影响较大,即弱酸性条件有利于酵母菌的生长,而中性偏碱的环境不利于酵母菌的生长;同时对铁的富集也有较大的影响,pH可明显影响酵母的生长和代谢,进而影响生物量的累积及铁的富集。在pH为6.5时,生物量达到最大,为1.36 g/100 mL,但酵母细胞中铁含量、总铁含量及转化率在pH为5.0时达到最高,分别为39877 μg/g、510.4 mg/L 和 63.8%。 综合考虑,富铁酵母的最佳发酵起始pH确定为5.0。
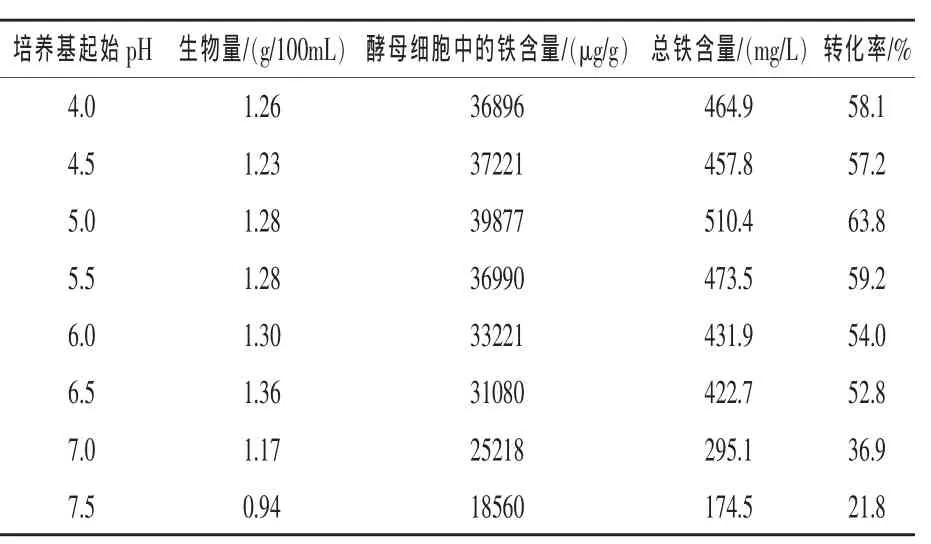
表4 起始pH值对富铁酵母的影响
2.5 接种量对富铁酵母的影响 由表5可知,接种量对酵母铁的生物量及铁含量、转化率均有较大的影响,接种量过大,可抑制生物量的累积及铁的富集;接种量为6%时,生物量达到最大,为1.39 g/100 mL,接种量为2%时,酵母细胞中铁含量、总铁含量及转化率均最高,分别为34364 μg/g、453.2 mg/L和56.7%。综合考虑,确定接种量为2%。
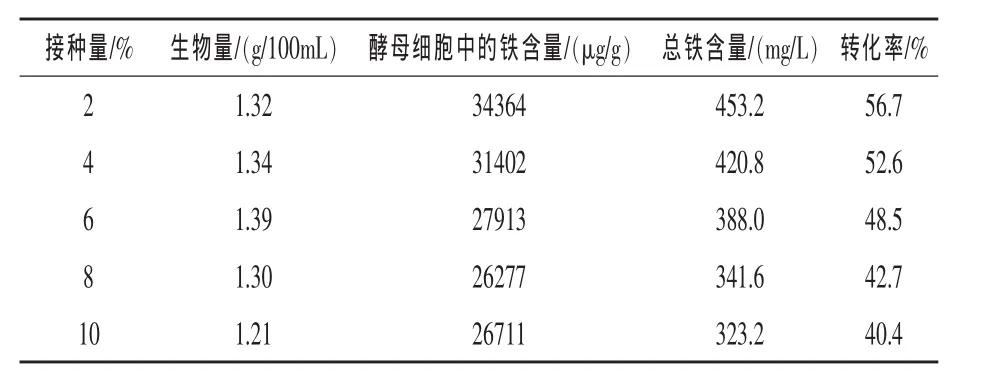
表5 接种量对富铁酵母的影响
2.6 装液量对富铁酵母的影响 本试验利用不同的装液量模拟溶解氧条件的影响,结果见表6。由表6可知,装液量对菌株CRJ3的生物量及铁的富集有较大的影响。装液量在75 mL/500 mL三角瓶时,总铁含量及转化率均达到最大,分别为410.4 mg/L和51.3%。
2.7 不同加铁时间对富铁酵母的影响 在发酵培养基和培养条件优化的基础上,为了确定最佳铁盐的加入时间,从而诱导细胞获得较高的总铁含量,试验设计在不同发酵时间点加入硫酸亚铁800 μg/mL。由表7可知,随着加铁时间的延迟,富铁酵母的生物量呈递增趋势,但酵母细胞中的铁、总铁含量及转化率随加铁时间的延迟大幅降低。因此,在发酵开始即加入硫酸亚铁,富铁效果较好,可使细胞中铁含量、总铁含量及转化率分别达到34988 μg/g、454.8 mg/L 和 56.9%。

表6 装液量对富铁酵母的影响
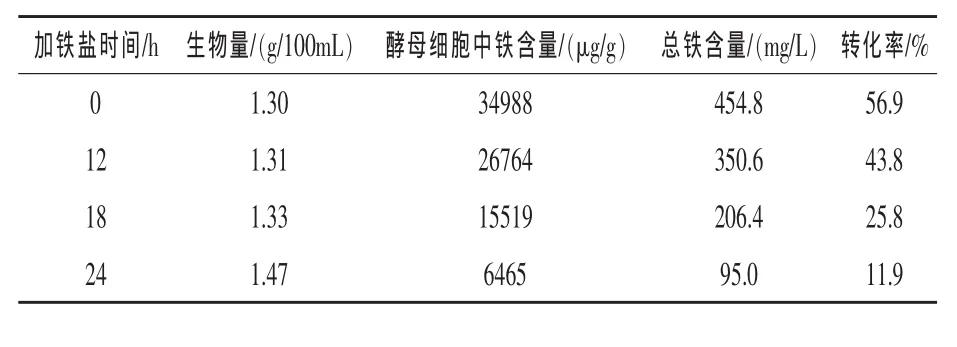
表7 不同加铁时间对富铁酵母的影响
2.8 实验室发酵罐培养 按2%的接种量接种,向初始培养基中加入800 μg/mL硫酸亚铁,在(28~30)℃,初始转速为 180 r/min,罐压 0.05 MPa下进行恒定pH培养(pH=5.0)。主要是根据培养基pH值的变化流加NaOH溶液,当pH低于4.0时,加入碱液使pH升高至5.0。发酵过程中每2 h时取样一次,测定发酵液的生物量以及总铁含量。以酵母菌的生物量和总铁含量为纵坐标、培养时间为横坐标,绘制富铁酵母菌株CRJ3的生长曲线。由图1可知,在优化发酵条件下,该菌株在0~6 h处于延滞期,6 h以后进入对数生长期,发酵24 h生物量达到最大,24~34 h生物量保持在一个相对稳定的数值。随着发酵时间的延长,总铁含量呈上升趋势,至24 h达到最高,之后总铁含量有下降趋势。从规模生产上考虑,发酵时间可以控制在24 h左右。
在上述优化发酵条件下,对细胞所富集的铁进行了有机化程度分析,结果显示,细胞所富集的铁中约有98%为有机铁。
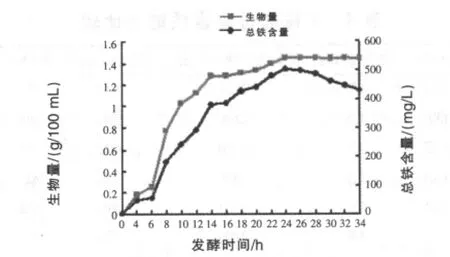
图1 菌株CRJ3的生长曲线及铁富集曲线
3 结论
3.1 添加硫酸亚铁对酵母菌的生长有一定的抑制作用,本试验筛选出一株富铁能力较高的产朊假丝酵母菌株CRJ3,作为试验菌株。
3.2 本试验综合考虑产朊假丝酵母的生长周期,不同pH下生长的情况,以及耐受铁的能力等,优化得到富铁酵母的最佳培养条件为:在500 mL三角瓶中装入75 mL培养基,培养基起始pH为5.0,所用的铁源为硫酸亚铁,浓度为800 μg/mL,并且在发酵开始即加入硫酸亚铁,按2%的接种量,培养时间为24 h,在上述条件下进行发酵,生物量能达1.30 g/100 mL,总铁含量能450 mg/L以上,细胞中铁的含量能达到35 mg/g以上。
3.3 按上述条件,采用实验室发酵罐进行恒定pH发酵,所得酵母菌体生物量能达到1.45g/100mL以上,总铁含量能够达500 mg/L左右,并且细胞所富集的铁中约98%为有机铁,适合工业化规模生产。
[1]成都科学技术大学与浙江大学分析化学教研室.分析化学试验 (第二版)[M].北京:高等教育出版社,1993.155 ~ 161.
[2]李志东,李娜,张洪林,等.啤酒酵母吸附重金属离子铬的研究[J].中国酿造,2006,10:38 ~ 42.
[3]王利伟,钱爱东,林春艳,等.酵母富集微量元素铁的研究[J].中国微生态学杂志,2002,14:83 ~ 84.
[4]许祯莹,陈代文,余冰.啤酒酵母富铁培养条件筛选[J].四川农业大学学报,2010,28(1):52.
[5]Gaudreau H,Tompkins T A,Champagne C P.The distribution of iron in iron-enriched cells of Saccharomyces cerevisiae[J].Acta Alimentaria,2001,30:355~361.
[6]Shin Y M,Kwon T H,Kim K S,et al.Enhanced iron uptake of Saccharomyces cerevisiae by heterologous expression of a tadpole ferritin gene[J].Appl Environ Microbiol,2001,67:1280 ~ 1283.

