枯草芽孢杆菌D-29拮抗作用及其抗菌蛋白特性研究
谈静惠,高莹,程超,李宏,王美琴,郝晓娟
(1.山西农业大学 农学院,山西 太谷030801;2.山西农业大学 生命科学学院,山西 太谷030801)
枯草芽孢杆菌(Bacillus subtilis)作为应用较广的生防微生物,具有与环境兼容性好、抗菌活性高、抗逆性强等优点[1]。枯草芽孢杆菌制剂的稳定性、与化学农药的相容性和在不同植物不同年份防效的一致性方面均优于不产芽孢的细菌和真菌生防菌株。其生防作用和生防机理一直是国内外研究的热点[2~7]。研究表明,该菌的生防机理包括竞争作用、拮抗作用、诱导植物抗性等,尤以拮抗作用为最主要的防病机理[8]。
枯草芽孢杆菌D-29菌株是本课题组从地肤中获得的一株具有生防潜力的内生细菌[9],本研究对该菌株的抑菌谱和抑菌物质特性进行了分析,为其进一步应用提供了科学依据。
1 材料和方法
1.1 供试菌种及培养基
枯草芽孢杆菌D-29菌株和棉花立枯病菌(Rhizoctonia solani)、玉米大斑病菌(Exserohilum turcicum)、辣椒枯萎病菌(Fusarium oxysporum f.sp.vasinfectum)、茄子枯萎病菌(Fusarium oxysporumf.sp.melongenae)、小麦赤霉病菌(Fusarium graminearum)、番茄灰霉病菌(Botrytis cinerea)、梨树腐烂病菌(Valsa mali)、西瓜枯萎病菌(Fusarium oxysporumf.sp niveum)、玉米穗腐病菌(Fusarium graminearum)、黄瓜枯萎病菌(Fusarium oxysporumf.sp.cucumerinum)、苹果炭疽病菌(Colletotrichum gloeosporioides)等菌株均由山西农业大学植物病理学实验室提供。供试真菌菌株的培养及平板对峙试验使用马铃薯葡萄糖培养基(PDA),内生细菌D-29的培养使用牛肉膏蛋白胨培养基(NA)[10]。
1.2 D-29对供试病原菌的拮抗作用
平板对峙法[11]测定D-29对供试病原真菌拮抗作用。
抑制率/%=[(对照真菌菌落直径-处理真菌菌落直径)/(对照真菌菌落直径-6)]×100%。
菌落直径=(水平直径+垂直直径)/2
1.3 D-29菌株抑菌蛋白提取与抑菌活性测定
将斜面活化的枯草芽孢杆菌D-29菌株接种到装有150mL NB培养液的250mL三角瓶中,在170r·min-1,28 ℃培养48h。4 ℃,10000r·min-1离心10min,收集上清液。用不同饱和度的硫酸铵分级盐析,4℃下沉淀12h后,4℃、10000r·min-1离心10min,取上清备用,沉淀用少量体积20mmol·L-1的 Tris-Hcl缓冲液(pH 6.8)溶解,用同种缓冲液透析去盐即得到抑菌蛋白粗提液。平板扩散法测定抑菌活性[12]。
1.4 D-29蛋白粗提液的稳定性测定[13]
热稳定性:将蛋白粗提液分别在50℃处理60 min、80℃ 处理30min和60min、100℃处理30 min和60min。
pH稳定性:将蛋白粗提液用盐酸和氢氧化钠分别 调 至 pH 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0,4 ℃静置过夜,用盐酸和氢氧化钠将各pH值调回中性后检测活性。
对有机溶剂的敏感性:在蛋白粗提液中分别加入等体积的乙醚、乙酸乙酯、石油醚、三氯甲烷、丙酮和甲醇,充分混匀,30min后,热水浴(约50℃)去除有机溶剂检测活性。
紫外照射稳定性:将蛋白粗提液在20W紫外灯下距离10cm 分别照射0、2、4、6、8、10、12h后检测活性。
平板扩散法测定活性,每孔加处理过的蛋白粗提液40μL,以未处理的粗蛋白作对照。
2 结果与分析
2.1 D-29对供试病原菌的拮抗作用测定结果
由表1可以看出,D-29对11种供试病原菌均有抑制作用,具有广谱抑菌活性。D-29对西瓜枯萎病菌及黄瓜枯萎病菌表现出较强的拮抗作用,抑菌率分别为31.6%和31.3%;对玉米大斑病菌拮抗作用最强烈,抑菌率高达54.6%。
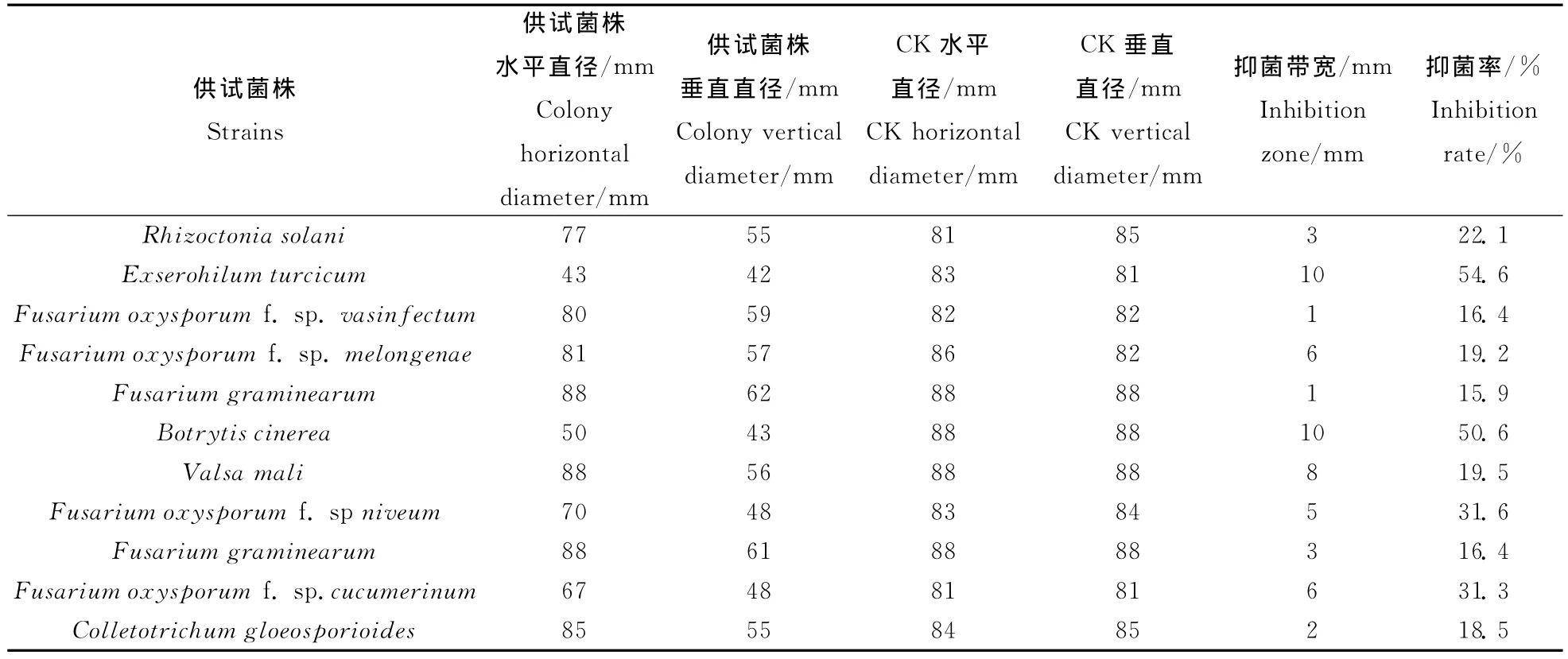
表1 枯草芽孢杆菌D-29对病原菌的拮抗作用Table 1 Antagonistic effects of Bacillus subtilis D-29on pathogens
2.2 D-29蛋白粗提液活性测定结果
由图1可以看出,随着硫酸铵饱和浓度的增大,有效物质的沉淀量逐步增大,拮抗活性随之上升,而上清液对玉米大斑病菌的抑制作用成逐渐下降的趋势。当硫酸铵饱和度达到80%时抑菌活性最强,上清液拮抗活性最低(图2)。确定抑菌蛋白最佳盐析饱和度为80%。
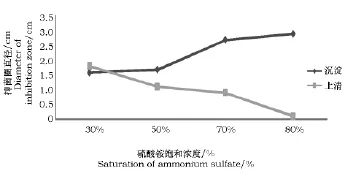
图1 不同饱和度硫酸铵沉淀抗菌蛋白抑菌活性Fig.1 Effects of different saturation of ammonium sulfate on inhibiting activity of antifungal protein
2.3 D-29蛋白粗提液的稳定性测定结果
2.3.1 热稳定性
蛋白粗提液50℃处理60min后,活性与对照相比没有变化,100℃60min后,仍保持了66%的抑菌活性(图3)。结果表明D-29蛋白粗提液具有良好的热稳定性。

图2 硫酸铵沉淀抗菌蛋白抑菌活性Fig.2 Effect of ammonium sulfate on inhibiting activity of antifungal protein注:1:80%沉淀2:80%上清3:D-29无菌滤液4:NANote:1:80%precipitation 2:80%supernatant 3:germfree filtrate 4:NA

图3 温度对蛋白粗提液的活性影响Fig.3 Effect of temperature on on inhibiting activity of crude protein
2.3.2 pH 稳定性
蛋白粗提液在pH 2.0~9.0范围内活性较稳定,在pH 5.0~7.0时,抑菌活性最强,抑菌圈直径为2.9cm。当pH大于9.0时蛋白活性急剧下降。粗提蛋白在强酸条件下稳定,但在强碱条件下抑菌活性不稳定 (图4)。
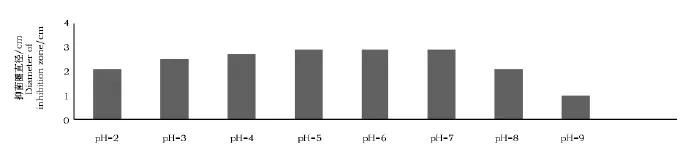
图4 pH蛋白粗提液的影响Fig.4 Effect of pH on on inhibiting activity of crude protein
2.3.3 对有机溶剂的敏感性
蛋白粗提液经有机溶剂处理后,乙醚处理抑菌活性不变,其它处理对抑菌活性略有影响,受影响最大的为丙酮处理,其抑菌活性为对照的86.2%(图5)。该蛋白粗提液对供试有机溶剂均具有一定的稳定性。

图5 有机溶剂对菌株D-29蛋白粗提液的影响Fig.5 Effect of organic solvent on on inhibiting activity of crude protein
2.3.4 紫外照射稳定性
蛋白粗提液经不同时间的紫外照射后,抑菌活性没有变化。结果表明该蛋白在紫外照射下具有稳定性。
3 讨论
枯草芽孢杆菌是一种嗜温的好氧性产芽孢杆状细菌,具有广泛的抗菌活性和极强的抗逆能力,易于商业化,因此一直是植病生物防治领域的研究热点。很多优良的枯草芽孢杆菌菌株已应用于生产实践[14]。枯草芽孢杆菌能够分泌多种抗菌蛋白抑制植物病原真菌和细菌的生长与繁殖[15,16]。
随着对植物病害生物防治要求的提高。人们越来越多的把注意力投入到抑菌物质的研究上。本研究中D-29对番茄灰霉病菌、玉米大斑病菌等11种病原菌均有不同程度的抑制作用,具有广谱抑菌活性。其中对玉米大斑病菌的抑制效果最好,抑菌率高达54.6%,形成最佳的病害菌株组合。获得的蛋白粗提液耐高温、耐强酸、对有机溶剂、光照不敏感,有利于生防产品的开发。通过对菌株D-29抑菌蛋白的蛋白的理化性质研究,为蛋白的分离纯化及揭示该菌生防机理奠定了基础。
[1]E G Wulf,C M Mguni,K Mansfeld-Giese,et al.Biochemical and molecular characterization of Bacillus amyloliquefaciens,B.subtils and B.Pumilus isolates with distinct antagonistic potential against Xanthomonas campestris pv.campestris[J].Plant Patho,2002,51(5):574-584.
[2]Asaka O,Shoda M.Biocontrol of Rhizoctonia solation damping off of tomato with Bacillus subtilis RB14[J].Applied and Environmental Microbiology,1996,62(11):4081-4085.
[3]Sturz A V,Christie B R,Nowak J.Bacterial endophytes:potential role in developing sustainable systems of crop production[J].Critical Reviews in Plant Sciences,2000,19(1):1-30.
[4]陈志谊,高太东,严大富,等.枯草芽孢杆菌B-2916防治水稻纹枯病的田间试验[J].中国生物防治,1997,13(2):75-78.
[5]隋文志,丁丽俐,吴魁斌.枯草芽孢杆菌 HB-248防病增产效果研究[J].现代化农业,1995(3):4-5.
[6]Raupach G S,Kloepper J W.Mixtures of plant grow promoting rhizobacteria enhance biological control of multiple cucumber pathogens[J].Biological Control,1998,88(11):1158-1164.
[7]Gueldner R C,Reilly C C,Pusey P L,et al.Isolation and identification of iturins as antifungal peptides in biological control of peach brown rot with Bacillus subtilis[J].Journal of Agricultural and Food Chemistry,1988,36 (2):366-370.
[8]陈中义,张杰,黄大昉.植物病害生防芽孢杆菌抗菌机制与遗传改良研究[J].植物病理学报,2003,33(2):97-103.
[9]谈静惠,康书静,郝晓娟,等.地肤内生细菌对番茄灰霉病菌的拮抗作用[J].山西农业大学学报:自然科学版,2011,31(4):326-331.
[10]路国兵,冀宪领,张瑶,等.桑树内生细菌的分离及生防益菌的筛选[J].蚕业科学,2007,33(3):346-351.
[11]沈萍,范秀容.微生物实验指导[M].北京:高等教育出版社,2003:30-65.
[12]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999(3):111.
[13]翟茹环,尚玉珂,刘峰,等.枯草芽孢杆菌 G8抗菌蛋白的理化性质和抑菌作用[J].植物保护学报,2007,34(6):592-596.
[14]于淑池,张利平,王立安.拮抗细菌作为生物防治手段研究进展[J].河北农业科学,2004,8(1):62-66.
[15]Zhang T,Shi ZQ,Hu LB,et al.Antifungal compounds from Bacillus subtilis B-FS06inhibiting the grow aspergillus flavus[J].World Journal Microbiol Biotechnol,2008(24):783-788.
[16]陈中义,张杰,黄大昉.植物病害生防芽孢杆菌抗菌机制与遗传改良研究[J].植物病理学报,2003,33(2):97-103.
——以渤海S油田为例

