超高效液相色谱法测定人体血浆中水杨酸含量的方法学研究
董晓茜,夏素霞*,邢天舒,唐思,张世良,王月敏
(1.辽宁省中医药研究院临床药理实验室,辽宁 沈阳 110034;2.辽宁中医药大学门诊部)
铝镁司片主要成分阿司匹林。由于阿司匹林口服后在体内很快转化为其活性代谢产物水杨酸,故在进行阿司匹林的血药浓度研究时大多测定血浆中水杨酸的浓度[1]。根据文献[2-4],人体血浆中水杨酸的测定的方法包括HPLC、LC-MS/MS、GC-MS等,考虑到HPLC法保留时间长,LC-MS/MS重复性不好,GC-MS操作繁琐。本实验建立超高效液相色谱 (ultra performance liquid chromatography,UPLC)法测定主要代谢产物水杨酸经时血药浓度,为进一步完成药代动力学实验提供可靠的依据。
1 药品、试剂与仪器
铝镁司片,规格:每片中含阿司匹林81 mg、重质碳酸镁22 mg、甘羟铝11 mg;给药途径:口服;水杨酸对照品 (批号:100106-200303)、非那西丁对照品 (批号:100095-198904)为内标(中国药品生物检定所)。乙腈为色谱纯 (德国Merck公司);冰醋酸为色谱纯 (美国 Tedia公司),甲基叔丁基醚为分析纯 (国药集团化学试剂有限公司);水为屈臣氏蒸馏水。
WASTERSACQUITY UPLCTMTUV型超高效液相,EMPOWERTM2 software数据处理系统 (美国沃特世公司);XW-80A微型旋涡混合仪 (上海沪西分析仪器厂);XS105分析天平 (梅特勒-托利多仪器有限公司);SIGMA3-18k低温高速离心机(德国Sigma公司)。
2 方法与结果
2.1 取血方法
2.1.1 受试者选择 健康志愿者30人,男女各半,年龄19~28岁,平均年龄 (22.90±2.35)岁;体重指数为19.1~23.7 kg/m2,平均 (20.91±1.52)kg/m2;所有受试者均无药物过敏史,无烟嗜好。试验前所有受试者的血压、脉搏等生命特征检查、心电图检查及血、尿常规和肝、肾功能等检查,均在正常值范围。试验前二周至试验结束前停用任何其他药物。受试者试验前应签署知情同意书。本试验方案经本院伦理委员会审批后通过。
2.1.2 血样采集 30名受试者每组各10人,于试验前1日和试验期间均勿饮用酒类、咖啡类饮料和果汁;受试者禁食10 h后,次日早上口服给药,低、中、高三个剂量组受试者分别口服试验制剂1粒、2粒、4粒,同一剂量组的每个受试者给药时间间隔5 min,抽血时间间隔5 min。中剂量组受试者完成单次给药试验后,第2天早上进行多次给药试验 (以单次给药试验当天为多次给药的第1 d)。多次给药7 d,每天1次,每次口服试验制剂2粒,第4、5、6天早上用药前采集血样测谷浓度以确定达稳态浓度的时间。第7天早上用药后按照单次给药的采血时间点采集血样。用药后2 h方能饮水,4,10 h后可进食统一的标准餐。受试者用药后应避免剧烈活动,亦不得长时间卧床。分别于服药前 (0 h)和给药后5、10、20、30、45、60 min,1.5、2、2.5、3、4、6、8、12、24 h采集肘静脉血4 ml,置于肝素化的试管中,试管置于冰水浴中,4℃,3 000 rpm离心10 min后分离血浆置-70℃冰箱备用,待测。
2.2 标准溶液和内标溶液的配制 精密称取水杨酸对照品11.28mg,置于10 ml容量瓶中,用乙腈溶解并稀释至刻度,摇匀,配成浓度为1 128mg/L的水杨酸储备液,用前稀释为应用液。精密称取非那西丁对照品14.20 mg,置于10 ml容量瓶中,用乙腈溶解并稀释至刻度,摇匀,配成浓度为1 420 mg/L的非那西丁储备液,精密量取储备液4 ml,于10 ml容量瓶中,以乙腈稀释至刻度,摇匀,即得浓度为568 mg/L的非那西丁内标溶液。
2.3 样品预处理 精密量取血浆200μl置于离心管中,精密加入非那西丁内标溶液 (568 mg/L)10μl,涡旋30 s,加入1%盐酸80μl,涡旋30 s,精密加入甲基叔丁基醚1 m l,涡旋2 min,14 000 rpm离心10 min,取上清液800μl,室温下氮气吹干,用80μl流动相溶解残渣,14 000 rpm离心10 min,取上清液5μl进样。
2.4 色谱条件 色谱柱:Waters Spursil C18(100 mm×2.10 mm,3μm);流动相:乙腈∶水 (含0.2%磷酸)=20.7∶79.3;波长:304 nm;流速:0.3 ml/min;柱温:35℃;进样量:5μl。
2.5 方法的专属性 精密取6份不同来源空白混合血浆200μl,按“2.2”项下自“涡旋30 s”起同法操作,得色谱图1-A;将浓度56.400 mg/L水杨酸标准溶液加入空白血浆中配制成相当于2.820 mg/L的含药血浆中,按“血浆样品处理方法”项下操作,得色谱图1-B;取受试者9号给铝镁司片81 mg后1.5 h收集的血浆样品,按“血浆样品处理方法”项下操作,得色谱图1-C。水杨酸保留时间为4.7 min左右;内标非那西丁的保留时间为3.9 min左右,结果表明,血浆中内源性物质不干扰水杨酸和内标的测定。
2.6 标准曲线和定量下限 精密量取不同浓度的水杨酸标准溶液10μl于7个空白离心管中,氮气吹干,加入200μl空白血浆,配制成血浆中水杨酸浓度分别为:0.018、0.113、0.564、1.410、5.640、14.100、28.200 mg/L的血浆样品。按“2.2项下”自“精密加入非那西丁内标溶液(568 mg/L)10μl”起操作,进样分析,建立水杨酸的标准曲线。以待测物浓度 (Cs)与内标浓度 (Ci)的比值 (Cs/Ci)为横坐标,以X表示,待测物峰面积 (As)与内标峰面积 (Ai)的比值(As/Ai)为纵坐标,以Y表示,用加权 (权重系数:1/X2)进行线性回归运算,得Y=19.9X+0.728,r=0.993。结果表明水杨酸在0.018~28.200 mg/L范围内线性关系良好,定量下限为0.018 mg/L(S/N >10)。
2.7 样品回收率实验 取空白离心管,分别加入不同浓度的水杨酸标准溶液各10μl,氮气吹干,加入200μl空白血浆配制成低、中、高三个浓度(分别为0.045、2.820和22.560 mg/L)的血浆样品各3份,再按“2.2”项下操作,5μl进样,得到相应的药物峰面积和内标峰面积;另取不同浓度的水杨酸标准溶液各10μl,加入非那西丁内标溶液 (568mg/L)10μl,氮气下吹干,加入100μl流动相复溶,配制低、中、高三个浓度样品 (分别为0.045、2.820和22.560 mg/L),10μl进样分析,得到药物峰面积和内标峰面积;每一浓度进行三样本分析。结果见表1,表明水杨酸低、中、高三个浓度的提取回收率为95.52%~104.63%。

图1 水杨酸专属性色谱图
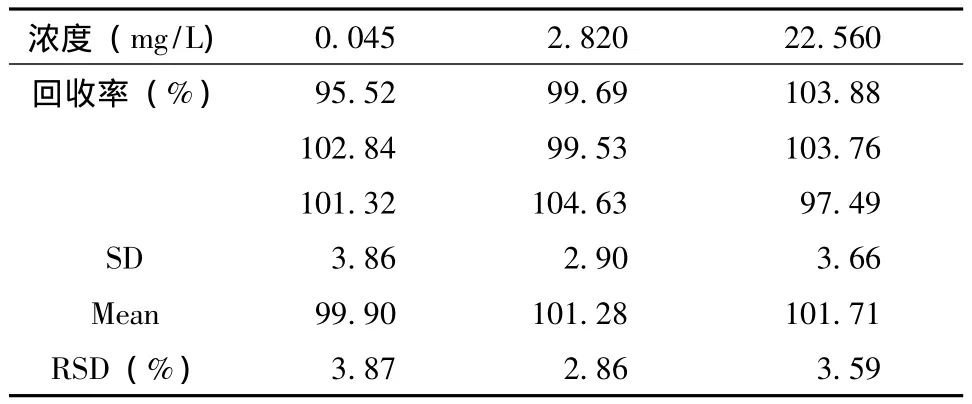
表1 血浆中水杨酸的回收率试验结果
2.8 精密度实验 按回收率试验配制3个不同浓度的水杨酸标准血浆样品,按“2.2”项下操作,在不同天内多次制备并测定,每批样品低、中、高三个浓度水平,每个浓度进行六样本分析,计算得日内和日间的相对标准偏差 (relative standard deviation,RSD)均小于10%(n=6)。
2.9 稳定性实验 取2 ml空白离心管分别加入不同浓度水杨酸标准溶液10μl,氮气吹干,再加入200μl空白血浆,配制成血浆中药物浓度分别为0.045和22.560 mg/L的低、高2个浓度血浆样品,制备五份 (每份各浓度分别为三个样本),其中三份按“2.2”项下操作,在4℃放置0、13、30 h后进样分析,考察处理后血浆样品在4℃条件下的稳定性;另一份于-70℃冰箱冷冻,待血浆融化后6 h,按“2.2”项下操作,进样分析,考察血浆样品的血浆融化后6 h稳定性;另一份于-70℃冰箱冷冻,反复冻融三次后,按“血浆样品处理方法”项下操作,进样分析,考察血浆样品的反复冻融稳定性。
另外将在试验开始配制的药物浓度分别为0.045和22.560 mg/L的低、高2个浓度血浆样品于-70℃冷冻保存3个月后,进样分析,考察血浆样品在长期冷冻条件下的稳定性,每份进行三样本分析。结果表明水杨酸血浆样品3个浓度在预处理后4℃下放置0、13、30 h后、血浆融化6h后、-70℃反复冻融3次后及在-70℃长期冷冻3个月后在本实验条件下均保持稳定且RSD<15%(n=5),符合方法学要求。
3 讨论
本实验首次采用此方法测定其血药浓度,克服了其他方法的不足,所建方法已用于大样本的药物动力学和生物利用度研究,为合理用药提供依据。在本实验的流动相条件下,先后用过乙醚、乙酸乙酯、二氯甲烷作为提取溶剂,效果均不太理想。参考文献[5],经试验确定,加入一定浓度的盐酸之后,再用甲基叔丁基醚提取,效果很好。实验以乙腈与水作为流动相,磷酸调节pH简化了流动相的配制,且具有良好的分离度,能够达到满意的分离效果
[1] Seegers JM,Oiling M,Jager LD,et a1.Interactions of aspirin with acetaminophen and afeine in rat stomach pharmacokinetics of absorption and accumulation in gastricmucosa [J].JPharm Sci,1980,69:900.
[2]田蕾,黄一玲,华潞,等.铝镁匹林片单剂量和多剂量人体药动学研究[J].中国新药杂志,2006,15(16):1393-1396.
[3]杨俊毅,蒋学华,何林,等.阿酚咖片中阿司匹林的相对生物利用度研究[J].生物医学工程学杂志,2003,20(4):661-663.
[4]周燕文,陈丽,兰聪贤.人血浆中水杨酸的测定及阿司匹林的人体药代动力学研究 [J].华西药学杂志,2008,23(5):572-574.
[5]顾洁,杭太俊,陈珺,等.氨酚匹林咖啡因片人体药代动力学和生物等效性[J].药物分析杂志,2007,27(4):486-489.

