高龄高血压患者静息心率与肾脏损害的相关性
王文艳, 张 维, 谢蒂立, 钟 萍, 周晓芳, 刘 新
高龄高血压患者静息心率与肾脏损害的相关性
王文艳, 张 维*, 谢蒂立, 钟 萍, 周晓芳, 刘 新
(四川省医学科学院×四川省人民医院, 老年疾病研究所, 成都 610072)
探讨高龄高血压患者静息心率(RHR)与肾脏功能指标的相关性。2006年9月~2011年2月入住本院患者419例为研究对象, 男289例, 女130例, 年龄80~94岁, 平均(80.8±6.1)岁。按照RHR分为A组: RHR<70 beats/min, B组: RHR 70~80次/min, C组: RHR>80次/min, 同时进行血压、体质量指数(BMI)、糖化血红蛋白、吸烟指数(SI)的检测, 用肾小球滤过率(GFR)、血肌酐(SCr)、肌酐清除率(CCr), 微量白蛋白尿(MAU)评估肾功能, 分析静息心率与肾功能参数的相关性。三组平均RHR差异有统计学意义[A, B, C组分别为(63.4±7.2), (74.1±4.0), (84.3±8.8)次/min,<0.05]; 三组SI和收缩压(SBP)均存在差异[A, B, C组SI分别为(321±73), (378±99), (463±79)(支·年); SBP分别为(140.2±10.1), (146.3±8.1), (149.8±9.6)mmHg,<0.05]。C组BMI和舒张压(DBP)均明显高于另外两组[A, B, C组BMI分别为(23.7±3.0), (23.1±5.4), (25.9±5.9)kg/m2; DBP分别为(64.6±9.5), (65.2±9.1), (71.3±12.4)mmHg,<0.05]; 三组肾功能参数差异有统计学意义[A, B, C组GFR分别为(84.5±11.0), (78.2±10.6), (67.6±10.1)ml/min; SCr分别为(87.3±23.1), (90.0±22.3), (104.0±19.7)µmol/L, CCr分别为(73.9±16.8), (68.0±18.3), (62.5±20.1)ml/min, MAU分别为(51.4±11.3), (56.0±17.3), (90.9±22.8)mg/L,<0.05]。RHR分别与SBP(=0.264,=0.002),GFR(=-0.330,=0.011),CCr (=-0.436,<0.01)和MAU(=0.208,=0.029)存在相关性。高龄高血压患者RHR与肾功能损害相关, 提示RHR增快可以作为高龄高血压患者肾功能受损的预测因子。
静息心率; 高血压; 肾功能; 微量蛋白尿; 老年人
静息心率(resting heart rate, RHR)与原发性高血压患者靶器官损害的相关性研究是临床热点之一。较快的RHR导致高血压患者心血管危险程度增加, 因此, 被认为可能是高血压患者心血管死亡的独立危险因子[1]。高龄高血压患者病理生理改变有其特殊性, RHR与肾脏损害相关性研究较少, RHR与肾小球滤过率、微量蛋白尿等的相关性尚不明确。本文探讨了老龄高血压患者RHR与肾脏功能参数的相关性。
1 对象与方法
1.1 对象
419例原发性高血压患者, 2006年9月~2011年2月入住本院心血管内科和老年科, 男289例(69.0%), 女130例(31.0%), 年龄80~94岁, 平均(80.8±6.1)岁, 有明确高血压病史。高血压诊断标准根据2005年中国高血压防治指南修订委员会修订的《中国高血压防治指南》执行, 排除继发性因素所致高血压、严重动脉粥样硬化、肾动脉狭窄及动脉畸形、尿路结石、输尿管狭窄、肾盂积水及肾囊肿(多囊肾)患者; 排除正在服用影响心率的β受体阻滞剂和非二氢吡啶类钙通道阻断剂的患者; 排除严重肝肾功能疾患、肿瘤、重症感染; 排除血糖控制欠佳, 糖化血红蛋白>7.5%和有自我发现的低血糖的糖尿病患者。吸烟指数=每日吸烟支数×吸烟年数(支·年)。按照静息心率值分为A组(RHR<70次/min), B组(RHR 70~80次/min), C组(RHR>80次/min), 分别比较各组之间的参数。
1.2 血压测量
采用校正的汞柱式血压计, 测量前患者至少休息5min, 患者应保持安静状态, 坐位时保持患者肘关节与心脏处于同一水平, 卧位时患者上臂平腋中线。以Korotokoff 第1 音为收缩压(systolic blood pressure, SBP) , 第5 音为舒张压(diastolic blood pressure, DBP)。测右上臂动脉血压, 以mmHg为计量单位(1mmHg=0.133kPa)共测量3次, 每次间隔3min, 取平均值。
1.3 RHR的测量
患者在安静环境下, 平卧休息5 min , 用三导心电图机记录标准12导联心电图。选择Ⅱ导联, 描记10 个心动周期, 用平均R-R 间期计算出RHR。
1.4 肾显像检查方法
单光子发射型计算机断层显像(single photon emission computed tomography, SPECT)机为GE公司VG型, 配低能高分辨平行孔准直器, 矩阵64×64, 能峰140kev, 窗宽20%。99mTc淋洗液由北京师洪药物制品公司提供。患者安静状态下取仰卧位, 探头置于患者背部, 探头视野包括双肾和膀胱, 静脉“弹丸”式注射锝喷替酸盐1.85MBq后即行双肾动态显像。采用二相式采集方式, 前30帧, 1帧/3s, 共90s; 引流相20帧, 1帧/60s, 共50帧。用感兴趣区域技术分别勾画出两侧肾脏轮廓。由计算机处理, 按Gate's法计算总肾肾小球滤过率(glomerular filtration rate, GFR)与分肾GFR, 并记录分肾的峰值、峰时、半排时间等指标。GFR 正常值80~110ml/min。
1.5 生化指标
患者空腹12 h以上, 于肘正中静脉取血2 ml, 使用日本OLYMPUS公司的全自动生化分析仪以及四川麦克生物技术公司生产的试剂盒检测血肌酐(serum creatinine, SCr)的水平(正常参考值: 男性 59~104µmol/L; 女性 48~84µmol/L), 采用美国伯乐公司D-10糖化血红蛋白仪测定糖化血红蛋白水平(glycosylated hemoglobin A, HbAc1)(正常参考值4%~6%)。患者留取24h尿标本, 采用终点散射比浊法进行尿微量白蛋白(micro albumin uria, MAU)定量。肌酐清除率(creatinine clearance, CCr)按如下公式计算: (男性)CCr(ml/ min)= (140-年龄)×体质量(kg)/72×SCr(mg/ dl), 或(女性)CCr(ml/min)=(140-年龄)×体质量(kg)/85×SCr(mg/dl)。体质量指数(body mass index, BMI)(kg/m2)=体质量(kg)/身高(m2)。
1.6 统计学处理
用SPSS软件进行统计学处理。对组间各项指标进行方差齐性检验, 满足方差齐性条件后, 对三组间比较采用单因素方差分析, 两组间比较用检验; 计数资料组间比较采用2检验。RHR与肾功能相关性分析为简单相关性分析。<0.05为差异有统计学意义。
2 结 果
2.1 患者一般资料
本研究纳入419例老年高血压患者, 按照静息心率分为A, B, C三组。三组一般情况比较见表1。三组平均年龄、病程、合并糖尿病比例、HbAc1水平差异无统计学意义(>0.05); C组男性患者比例较低(45.8%); C组SBP和DBP均较A组和B组明显增高, 差异有统计学意义(<0.05)。所有病例平均BMI为23.8±4.9, 而C组BMI和吸烟指数(smoking index, SI)较另两组明显增高(<0.05)。

表1 三组一般情况比较
注: RHR: 静息心率; HbAc1: 糖化血红蛋白; BMI: 体质量指数; SI: 吸烟指数; SBP: 收缩压; DBP: 舒张压。与A组比较,*<0.05,**<0.01; 与B组比较,#<0.05,##<0.01
2.2 肾功能各项参数比较
三组间GFR和CCr差异有统计学意义(<0.05); C组SCr和MAU增高明显, 差异有统计学意义(<0.05; 表2)。
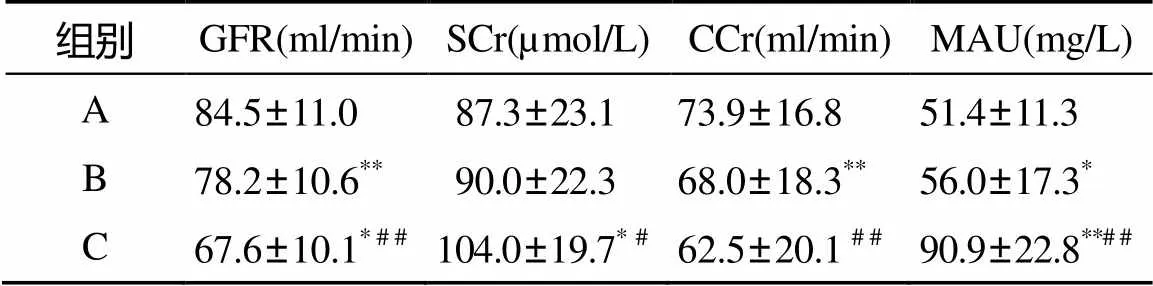
表2 肾功能各项参数比较
注: GFR: 肾小球滤过率; SCr:血肌酐; CCr: 肌酐清除率; MAU: 尿微量白蛋白。与 A组比较,*<0.05,**<0.01; 与B组比较,#<0.05,##<0.01
2.3 简单相关性分析
如表3结果所示, RHR与SBP相关(=0.273,=0.002), 与GFR(=-0.310,=0.013)和CCr成负相关(=-0.457,<0.001); MAU同样与静息心率RHR之间存在相关性(=0.198,=0.034)。而BMI, DBP, SCr与RHR无相关性(>0.05)。

表3 静息心率与肾功能的相关性分析
注: BMI: 体质量指数; HbAc1: 糖化血红蛋白; SBP: 收缩压; DBP: 舒张压; GFR: 肾小球滤过率; SCr: 血肌酐; CCr: 肌酐清除率; MAU: 尿微量白蛋白
3 讨 论
RHR是反应机体交感活性、自主神经平衡程度以及代谢率高低的一个指标[2], 研究发现, RHR增加, 动脉僵硬度增加[3], 有心血管危险因素的患者猝死率也相对较高[4]。在各类人群中, RHR 过快也可能是靶器官损害的一个重要的预测因子[5]。高龄(>80岁)高血压患者病理生理改变与其他年龄段不同, 肾脏作为靶器官受累程度明显, 将RHR作为简单的临床体征评估患者肾功能水平有实用价值。
本组高龄患者平均年龄(80.8±6.1)岁, 平均BMI(23.8±4.9), 体质量超重或肥胖比例较中青年低, 与既往国人流行病学调查资料一致。肥胖患者心脏肥大可能涉及交感神经系统(sympathetic nervous system, SNS)及肾素-血管紧张素系统(renin-angiotensin system, RAS)的激活, 脂肪组织自身的RAS 系统激活亦导致血管紧张素II(angiotensin II, AngII)的水平升高进而使心输出量增加, 心率增快。尽管本文结果显示, BMI较高者拥有更快的静息心率, 但相关性分析未能发现RHR与BMI之间的相关性。有人对慢性肾病的老年人进行观察, 未能发现肥胖对心肾功能的负面作用, 肥胖患者某些GFR反而较高, 说明在老龄患者, 体质量对心血管事件影响以及与肾功能的关系还有待客观地评价[7]。
本文观察到RHR较快组的老年患者SI较高。吸烟的年轻高血压患者交感神经呈慢性激活状态, 与心血管事件存在关联[10]。有报道, 吸烟引起的交感神经过渡兴奋是猝死的重要原因之一[8]。烟草中尼古丁通过影响自主神经系统而降低外周动脉压力感受器的敏感性, 同时增加肌肉交感神经兴奋性而改变其心率变异性和增加心率[9]。本文研究结果提示, 高龄患者吸烟仍对SNS兴奋性有影响。
RHR与微量蛋白尿之间的关系有不同的结论。最近发表的PROactive试验亚组分析未发现二者之间存在关联[11]。但是也有较多证据支持RHR与肾脏早期损害包括微量蛋白尿的相关性[12]。Böhm等[13]研究发现, 无论有无心房颤动病史, 心室率快的患者微量白蛋白尿发生率较高。RHR增快提示交感神经兴奋, 同时兴奋RAS, 肾组织局部Ang II水平增加, 可导致肾小球出球小动脉收缩, 通过血流动力学及非血流动力学因素导致肾小球高压、高滤过、高灌注, 使尿蛋白排出增加。糖代谢的异常与MAU相关性已得到证实, 高血糖可导致肾脏微血管灌注不足, 肾小球滤过率升高, 囊内压以及通透性增高, 微量白蛋白漏出。因本研究排除血糖控制不良的患者, 肾功能严重受损的患者合并糖尿病的比例和糖化血红蛋白水平三组无明显差异, 但是交感的活性增加势必会影响葡萄糖代谢, 因此, 还需扩大样本进一步研究确证。
本文结果提示, 高龄高血压患者平均GFR均有降低, 随着RHR增快, GFR下降更加明显; 同时SCr和CCr也与RHR呈负相关的关系。研究表明, SNS活性在慢性肾脏疾病(chronic kidney disease, CKD)的发生与发展中发挥着至关重要的作用[14,15], 且交感异常活化与CKD 心血管并发症密切相关。有研究发现, 大鼠行肾脏大部切除后, 若接受交感神经阻断剂或者肾脏去神经术处理后, 肾脏的损害程度会减轻, 血压下降, 尿蛋白定量减少, 病理改变也在减轻; 另一方面, 衰老本身会导致自主神经平衡性失调, Irigoyen等[16]报道老年大鼠控制肾脏交感神经活性和心率的压力感受器受损, 儿茶酚胺可通过β肾上腺素受体介导的增殖作用以及对足突细胞的损伤导致肾脏的损害, 亦能诱导血管平滑肌细胞和血管外膜成纤维细胞的增殖, 加速肾小球硬化的进展。本文结果显示, 高龄患者CCr均偏低, 随着RHR增加, 提示交感神经兴奋性增加, 肾功能损害进一步加重。
高龄高血压患者RHR与肾功能(包括GFR, SCr、CCr、微量白蛋白尿)存在相关性, 提示作为简单的生命体征, RHR可以作为老年高血压患者肾功能受损的预测指标。
[1] Cooney MT, Vartiainen E, Laatikainen T,. Simplifying cardiovascular risk estimation using resting heart rate[J]. Eur Heart J, 2010, 31(17): 2141-2147.
[2] Lauer MS. Autonomic function and prognosis[J]. Cleve Clin J Med, 2009, 76 (Suppl 2): S18-22.
[3] Park BJ, Lee HR, Shim JY,. Association between resting heart rate and arterial stiffness in Korean adults[J]. Arch Cardiovasc Dis, 2010, 103(4): 246-252.
[4] Paul L, Hastie CE, Li WS,. Resting heart rate pattern during follow-up and mortality in hypertensive patients[J]. Hypertension, 2010, 55(2): 567-574.
[5] Sacre JW, Franjic B, Jellis CL,. Association of cardiac autonomic neuropathy with subclinical myocardial dysfunction in type 2 diabetes[J]. JACC Cardiovasc Imaging, 2010, 3(12): 1207-1215.
[6] Lambert E, Sari CI, Dawood T,. Sympathetic nervous system activity is associated with obesity-induced subclinical organ damage in young adults[J]. Hypertension, 2010, 56(3): 351-358.
[7] Valocikova I, Valocik G, Kristofova B,. Obesity paradox and chronic kidney disease[J]. Bratisl Lek Listy, 2011, 112(7): 402-406.
[8] Manzano BM, Vanderlei LC, Ramos EM,. Acute effects of smoking on autonomic modulation: analysis by Poincaré plot[J]. Arq Bras Cardiol, 2011, 96(2): 154-160.
[9] Barutcu I, Esen AM, Kaya D,. Cigarette smoking and heart rate variability: dynamic influence of parasympathetic and sympathetic maneuvers[J]. Ann Noninvasive Electrocardiol, 2005, 10(3): 324-329.
[10] Hering D, Kucharska W, Kara T,. Smoking is associated with chronic sympathetic activation in hypertension[J]. Blood Press, 2010, 19(3): 152-155.
[11] Pfister R, Erdmann E, Schneider CA. Association and prognostic impact of heart rate and micro-albumin uria in patients with type 2 diabetes and cardiovascular disease: results from the PROactive trial[J]. J Atheroscler Thromb, 2011, 18(1): 65-71.
[12] Moran A, Palmas W, Field L,. Cardiovascular autonomic neuropathy is associated with microalbuminuria in older patients with type 2 diabetes[J]. Diabetes Care, 2004; 27(4): 972-977.
[13] Böhm M, Thoenes M, Neuberger HR,. Atrial fibrillation and heart rate independently correlate to microalbuminuria in hypertensive patients[J]. Eur Heart J, 2009, 30(11): 1364- 1371.
[14] Brotman DJ, Bash LD, Qayyum R,. Heart rate variability predicts ESRD and CKD-related hospitalization[J]. J Am Soc Nephrol, 2010, 21(9): 1560-1570.
[15] Grassi G, Quarti-Trevano F, Seravalle G,. Early sympathetic activation in the initial clinical stages of chronic renal failure[J]. Hypertension, 2011, 57(4): 846-851.
[16] Irigoyen MC, Moreira ED, Werner A,. Aging and baroreflex control of RSNA and heart rate in rats[J]. Am J Physiol Regul Integr Comp Physiol, 2000, 279(5): R1865- 1871.
(编辑: 王雪萍)
Resting heart rate and impaired renal function in very old hypertensive patients
WANG Wenyan, ZHNAG Wei*, XIE Dili, ZHONG Ping, ZHOU Xiaofang, LIU Xin
(Sichuan Provincial Academy of Medical Sciences & Sichuan Provincial People’s Hospital, Institute of Geriatric Diseases, Chengdu 610072, China)
Resting heart rate(RHR) symbolizes the sympathetic nerve activity and is correlated with target organ damage in hypertensive subjects. This study aimed to investigate the relation between RHR and the parameters of renal function and other risk factors in elderly hypertensive patients.Totally 419 in-hospital patients from September, 2006 to February, 2011 were enrolled, including 289 males and 130 females, with age ranging from 80~94 years, averaged (80.8±6.1) years. The subjects were divided into three groups according to RHR: group A, RHR<70 beats/min; group B, RHR 70~80 beats/min; group C, RHR>80 beats/min. The blood pressure, body mass index(BMI), smoking index(SI) and glycosylated hemoglobin A(HbAc1) were determined. Renal function were evaluated by glomerular filtration rate(GFR) which was determined by Single Photon Emission Computed Tomography(SPECT) , serum creatinine (SCr), creatinine clearance(CCr) and micro albumin uria (MAU) respectively. The relation between RHR and these parameters was identified by simple correlation analysis.The RHR was significantly different between the three groups [(63.4±7.2), (74.1±4.0), and (84.3±8.8) beats/min in group A, B and C respectively,<0.05], as well as SI [(321±73), (378±99), and (463±79) (cigarettes·year)in group A, B and C respectively,<0.05] and SBP [(140.2±10.1), (146.3±8.1) and (149.8±9.6)mmHg in group A, B and C respectively,<0.05]. No significant difference was found in age, hypertension course, diabetes and HbAc1level among the three groups. BMI and DBP were higher in group C than in group A and B[BMI:(23.7±3.0), (23.1±5.4), (25.9±5.9)kg/m2; DBP: (64.6±9.5), (65.2±9.1), (71.3±12.4)mmHg in group A, B, C respectively,<0.05]. Significant difference in GFR[(84.5±11.0), (78.2±10.6) and (67.6±10.1)ml/min in group A, B and C respectively,<0.05], SCr[(87.3±23.1), (90.0±22.3) and (104.0±19.7)µmol/L in group A, B and C respectively,<0.05], CCr[(73.9±16.8), (68.0±18.3) and (62.5±20.1)ml/min in group A, B and C respectively,<0.05] and MAU[(51.4±11.3), (56.0±17.3) and (90.9±22.8)mg/L in group A, B and C respectively,<0.05] was found among the three groups. RHR was correlated with SBP(=0.264,=0.002),GFR(=-0.330,=0.011), CCr (=-0.463,<0.01) and MAU(=0.208,=0.029).For elderly hypertensive patients, RHR is correlated with impaired renal function, suggesting that RHR could be regarded as the predictor in renal dysfunction of elderly hypertensive patients.
resting heart rate; hypertension; renal function; micro albuimiuria; elderly
R544.1
A
10.3724/SP.J.1264.2012.00005
2011-10-12;
2011-12-10
张 维, Tel: 028- 87393148, E-mail: ddmm611@163.com

