平胃散调控湿困脾胃证大鼠肠道能量代谢的实验研究
陈继兰,黄秀深,曾跃琴,秦玉花,周艳霞
(成都中医药大学基础医学院,四川成都611137)
湿困脾胃证,又称湿阻中焦证,是指湿邪困阻脾胃,阻遏气机所表现出的一组证候。临床主要表现为头重身困肢倦,脘闷腹胀,大便溏泄,舌苔白厚而腻,脉濡缓。本研究模拟中医发生湿困脾胃证的三大病因,“久居湿地,饮食不节,情志不遂”,采用增加湿度、饮食调控结合睡眠控制的方法建立大鼠湿困脾胃证动物模型[1],并以此为平台,研究其肠屏障能量代谢变化情况,进一步探究湿困脾胃证模型大鼠肠屏障功能障碍情况及平胃散的调节作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SD大鼠40只,雌雄各半,体重180 g~220 g,由成都中医药大学实验动物中心提供,检疫后备用。适应性饲养1 w,自由摄食全价颗粒饲料,动物房温度维持在18℃~25℃左右。
1.1.2 实验药物 造模用药:成都人人乐超市购买的熟猪油,自制4℃冰水。治疗用药:平胃散,配方:苍术24 g,厚朴18 g,陈皮12 g,炙甘草6 g,均购自同仁堂成都分店,经成都中医药大学制剂室鉴定合格。先将药物加水500 mL浸泡1 h,然后与大枣2枚、生姜2片一同煎煮至300 mL左右,再浓缩成浓度为1 g生药/mL药液,4℃冰箱保存备用。
1.1.3 实验试剂 谷氨酰胺(Gln)测试盒,批号:20070628;ATPase(定磷法)测试盒,批号:20070629;考马斯亮蓝测试盒,批号:20070714,均购自南京建成生物工程研究所。
1.2 实验方法
1.2.1 造模及给药 SD大鼠40只,雌雄各半。随机分为2批,10只常规饲养(空白组),30只造模。湿困脾胃模型造模方法:使大鼠居住在温度18℃~25℃,湿度90%以上的造模箱内,每日上午用小站台法控制睡眠时间5 h,单日禁食并给予4℃冰水灌胃1次(1 mL/只),双日供应充足饲料并给予猪油灌胃1次(4 mL/只),连续20 d。造模结束后,30只大鼠随机分为模型组、平胃散组和自然恢复组。平胃散组大鼠给予平胃散汤剂灌胃(10 mL/kg),空白组、模型组和自然恢复组给予等量0.9%生理盐水灌胃,共3 d。
1.2.2 检测方法 模型组于造模结束当日处死取材,其他3组3 d后处死取材。冰上取空肠组织各100 mg,冰水匀浆配制成10%匀浆液。待检测样品处理方法:Gln:4℃3000 r/min,离心10 min取上清液,-80℃冰冻保存待测;ATPase:4℃ 1500 r/min,离心 15 min取上清液,-80 ℃冰冻保存待测;考马斯亮蓝测定蛋白含量:4℃1500 r/min,离心10 min取上清液,-80℃冰冻保存待测。检测操作及运算严格按照实验说明书步骤进行。
1.3 统计学方法
实验资料中的数据采用SPSS11.0 for Windows统计分析软件分析处理,数据用(±s)表示,组间比较采用单因素方差分析。
2 结果
2.1 动物一般状态观察
空白组大鼠在整个实验过程中,自始至终形体肥壮,食量较多,活动灵敏,背毛光泽,尾色正常,未见大便溏泻。模型组大鼠反应迟钝,体重减轻,嗜卧懒动,皮毛色泽晦暗,毛发打结,尾色苍白无泽,大便溏,饮水量明显减少。给药后,平胃散组大鼠体征有所改善,自然恢复组大鼠体征改善不明显。
2.2 空肠Gln含量变化
结果见表1。
表1 空肠Gln变化比较 (±s)

表1 空肠Gln变化比较 (±s)
注:与空白组比较,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01
组别 n 空肠G l n(m m o l/L)空白组 10 3.6065±1.6080 3)模型组 10 1.1114±0.4579 1)平胃散组 10 2.0519±0.6252 1)2)自然恢复组 10 1.3243±0.6525 1)
由表1可知,与模型组比较,平胃散组空肠Gln浓度明显升高,差异有统计学意义(P<0.05)。
2.3 空肠 Na+-K+-ATPase、Ga2+-ATPase 活力变化比较
结果见表2。
表2 空肠 Na+-K+-ATPase、Ga2+-ATPase 活力变化比较 (±s)
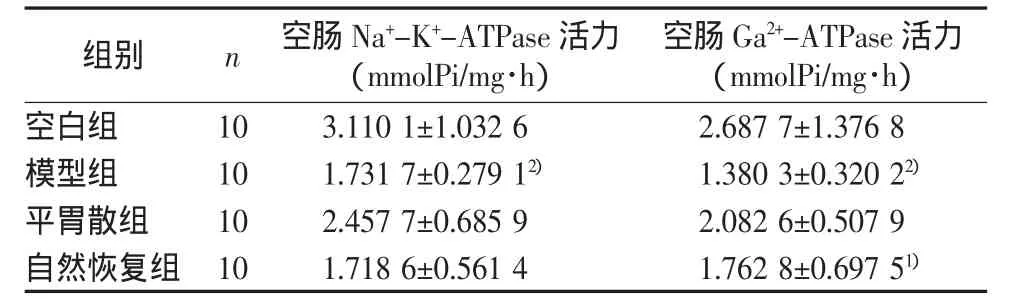
表2 空肠 Na+-K+-ATPase、Ga2+-ATPase 活力变化比较 (±s)
注:与模型组比较,1)P<0.05;与空白组比较,2)P<0.01
空肠 G a 2+-A T P a s e 活力(m m o l P i/m g·h)空白组 10 3.1101±1.0326 2.6877±1.3768模型组 10 1.7317±0.2791 2) 1.3803±0.3202 2)平胃散组 10 2.4577±0.6859 2.0826±0.5079自然恢复组 10 1.7186±0.5614 1.7628±0.6975 1)组别 n 空肠N a+-K+-A T P a s e活力(m m o l P i/m g·h)
由表2可知,与空白组比较,模型组大鼠空肠Na+-K+-ATPase、Ga2+-ATPase活力显著下降,差异有统计学意义(P<0.01);Na+-K+-ATPase 活 力 自 然 状 态 下 未 恢 复 ,Ga2+-ATPase活力自然状态下有一定恢复,经平胃散治疗后均有一定好转。
3 讨论
3.1 湿困脾胃证与Gln水平的探讨
目前认为,Gln是肠黏膜屏障中一个非常重要的营养素,它是肠上皮细胞、淋巴细胞和巨噬细胞的重要代谢燃料,肠道70%以上的能量供给依赖Gln。Gln参与三羧酸循环,葡萄糖氧化生成ATP供能,是肠道相关淋巴组织细胞和其他各种免疫细胞中核酸、蛋白质等生物分子合成的主要供氮体和氧化供能底物[2]。众多研究表明,Gln能够增加肠黏膜厚度,上皮细胞绒毛长度及缩小紧密连接间隙,维护肠黏膜结构;提高中性粒细胞的杀菌能力及SIgA水平,增强肠黏膜免疫功能,增加黏膜含氮量,减少肠道细菌和内毒素移位,从而提高肠黏膜的通透性,维持肠黏膜功能的完整[3]。同时,Gln也是谷胱甘肽生物合成的前体,有利于还原型谷胱甘肽的储存;谷胱甘肽又是细胞内抗氧化防御系统的重要组成部分,因此Gln对清除机体自由基堆积也有间接作用[3]。临床上,Gln已作为治疗肠黏膜屏障损伤的最重要疗法—肠内营养的首选营养剂[4]。
本实验中,模型大鼠Gln含量明显下降,说明湿困脾胃证导致肠道多种细胞供能严重不足,肠上皮细胞供能不足,导致肠上皮细胞绒毛变短,紧密连接间隙增大,肠黏膜萎缩,肠道通透性增加,肠黏膜机械屏障损伤;免疫细胞供能不足,SIgA分泌减少,免疫功能下降,肠免疫屏障功能障碍;Gln不足导致谷胱甘肽合成减少,自由基清除不利,加速肠黏膜屏障损伤。自然恢复下大鼠Gln水平难以恢复,给予平胃散治疗后,Gln水平有较好恢复,提示平胃散可能通过提高机体Gln水平来修复损伤的肠黏膜屏障。
3.2 湿困脾胃证与ATPase活性的探讨
ATPase主要存在于组织细胞及细胞器的膜上,是生物膜上的蛋白酶,它在水液代谢、物质转运、能量转换以及信息传递方面发挥重要作用,维持细胞内外水、电解质平衡,维持细胞的兴奋性和传导性,调节神经递质的释放及代谢。在肠道,Na+-K+-ATPase主要分布于质膜上,通过细胞内Na+和细胞外K+的跨膜主动交换,使细胞外与细胞内产生 Na+浓度梯度,然后通过膜上Na+、Ga2+交换器将胞浆中Ga2+排出胞外,维持肠道平滑肌细胞正常膜电位和生理功能[5]。Ca2+-ATPase在肠道平滑肌电生理中发挥重要作用,Ga2+是胃肠起搏细胞Cajal间质细胞(Interstitial Cells of Cajal,ICC)重要且必需的离子基础,ICC 主要依靠 Ga2+携带内向瞬时电流形成电位差起搏肠道平滑肌[6]。
笔者在以前的研究中即发现,湿困脾胃证大鼠红细胞膜、肝细胞、结肠组织、脑组织 Na+-K+-ATPase 活性降低,平胃散均可纠正这种异常。结合本次研究中造模大鼠空肠组织 Na+-K+-ATPase、Ga2+-ATPase 活力均明显下降,提示多系统ATPase活性下降是湿困脾胃证的基本病理改变之一。其损伤机制可能如下:Na+-K+-ATPase受到抑制,细胞内 Na+增多-Na+、Ga2+交换增加-细胞内 Ga2+堆积,松解紧密连接及提高肠上皮通透性,并激活特异的钙依赖的磷脂酶和蛋白酶,引起细胞损伤和死亡;细胞外Na+、Ga2+浓度降低,ICC自发电生理活动被抑止,肠蠕动减慢;ATPase代谢障碍,降解为次黄嘌呤,继而被黄嘌呤氧化酶催化为黄嘌呤在组织中聚积,产生大量自由基损伤细胞[7]。在这三重打击下,肠黏膜机械屏障功能及完整性均遭到破坏,Na+肠道吸收障碍,细胞外液Na+浓度继续降低,导致低钠血症发生,临床上低钠血症可见患者无口渴感,饮水减少,少尿或凹陷性水肿,这与湿困脾胃证主症较为相似。给予平胃散治疗后,二酶活性均有较好恢复,效果好于自然恢复组,提示复方平胃散可能是通过提高组织ATPase活性来修复细胞紊乱的能量及水液代谢,发挥燥湿健脾之效。
[1]刘伟,黄秀深,罗玉熙,等.湿阻证动物模型研究进展[J].四川中医,2005,24(4):35-36.
[2]Domeneghini C,Di Giancamillo A,Bosi G,et al.Can nutraceuticals affect the structure of intestinal mucosa?Qualitative and quantitative microanatomy in L-glutamine diet-supplemented weaning piglets[J].Vet Res Commun,2006,30(3):331,42.
[3]秦环龙,沈通一.谷氨酰胺在肠道屏障功能障碍中的作用[M]//王兴鹏.肠道屏障功能障碍:基础与临床.上海:第二军医大学出版社,2006:444-451.
[4]Coeffier M,Dechelotte P.The role of glutamine in intensive care unit patients:mechanisms of action and clinical outcome[J].Nutr Rev.2005,63(2):65,9.
[5]吴丽颖,王兴鹏.肠黏膜内pH值及其氧代谢[M]//王兴鹏.肠道屏障功能障碍:基础与临床.上海:第二军医大学出版社,2006:173-174.
[6]谢勇,周南进.Cajal细胞[M]//王兴鹏.肠道屏障功能障碍:基础与临床.上海:第二军医大学出版社,2006:95-96.
[7]王宏志,刘俊,宋慧,等.乌司他丁联合三七总皂甙对急性胰腺炎大鼠氧自由基的影响[J].世界华人消化杂志,2007,15(17):1956-1959.

