褪黑素合成酶ASMT基因启动子和第一外显区单核苷酸多态性与儿童孤独症的关联研究☆
王力芳卢天兰李俊郑凡凡阮燕燕贾美香岳伟华刘靖张岱
褪黑素合成酶ASMT基因启动子和第一外显区单核苷酸多态性与儿童孤独症的关联研究☆
王力芳*卢天兰*李俊*郑凡凡*阮燕燕*贾美香*岳伟华*刘靖*张岱*
目的探讨参与褪黑素合成的乙酰血清素甲基转移酶(acetylserotonin methyltransferase,ASMT)基因启动子和第1外显子区遗传多态性位点与儿童孤独症是否关联。方法对390例儿童孤独症患者和420例正常对照者的ASMT基因启动子和第1外显子区域进行测序。比较该区域5个单核苷酸多态性(single nucleotide polymorphisms,SNPs)位点的等位基因频率、基因型频率和单体型频率在患者组与对照组之间的差异。结果患者组和对照组之间,5个SNPs(rs4446909、rs5989681、rs56690322、rs6644635、rs17149149)等位基因和基因型频率的差异均无统计学意义(P>0.05)。3个SNPs位点rs4446909、rs5989681和rs6644635之间存在连锁不平衡(linkage disequilibrium,LD)(D’值为0.85-0.98)。但此3个SNPs构成的单体型频率在两组间的差异无统计学意义(P>0.05)。结论本研究未发现ASMT基因启动子和第1外显子区域的遗传多态性位点与儿童孤独症关联,提示这些位点可能未参与中国汉族人群孤独症的致病。
儿童孤独症 ASMT基因 褪黑素 关联研究
儿童孤独症是一种神经发育性疾病,遗传度高达90%[1]。近期研究发现与神经发育有关的基因可能是孤独症的易感基因[2-7]。另有研究发现,孤独症和孤独症谱系障碍患者血清褪黑素和夜间尿液中褪黑素代谢产物6-sulphatoxymelatonin水平显著低于正常儿童[8-10]。褪黑素是吲哚类神经激素,对于胎脑发育起重要作用,可避免自由基对发育期大脑的损伤[11]。乙酰血清素甲基转移酶(acetylseroto-ninmethyltransferase,ASMT)是参与褪黑素合成最后一个过程的酶[12],因此编码此酶的ASMT基因受到研究者的关注,被作为孤独症的候选基因进行研究。既往国外研究发现,位于该基因启动子区的2个单核苷酸多态性(single nucleotide polymorphisms,SNPs)位点rs4446909和rs5989681与孤独症谱系障碍关联[13]。但是另一项研究中未能验证此结果[14]。另有研究报道,6%~7%的孤独症谱系障碍患者有ASMT基因的部分微重复(microduplication),而仅有2% 的正常对照具有此微重复[15]。由于上述研究对象均为欧洲人群,且研究结果并不一致,而中国汉族人群ASMT基因与孤独症的关联研究尚无相关报道。因此,本研究旨在探讨中国汉族人群中孤独症与ASMT基因启动子和第1外显子区单核苷酸多态性位点的关联。
1 对象和方法
1.1 研究对象 来自2006年1月至2009年12月间就诊北京大学精神卫生研究所的儿童孤独症患者。入组标准:①符合美国精神障碍诊断统计手册第四版(diagnostic and statistical manual of mental disorders,fourth edition,DSM-IV)孤独症诊断标准,由两名儿童精神科主任医师进行诊断;②克氏儿童孤独症评定量表(childhood autism rating scale,CARS)评分≥36分;③孤独症行为量表(autism behavior checklist,ABC)评分≥67分。排除标准:①Asperger综合征、Rett综合征和其他广泛性发育障碍者;②符合DSM-IV诊断标准的其他轴I精神障碍诊断;③脆性X综合征;④结节性硬化;⑤染色体异常;⑥严重躯体疾病患者;⑦非汉族人群。共纳入390例孤独症患者,其中男359例,女31例,年龄1.9~16.4岁,中位数为6.3岁。
正常对照组为性别与患者组匹配的420名汉族健康成年人,男389名,女31名,年龄18~45岁,中位数为27岁。个体间无血缘关系、无严重躯体疾病、由精神科医师采用非结构式临床访谈明确正常对照无精神疾病。排除既往有精神疾病史和有精神神经疾病家族史者。两组性别比例差异无统计学意义(χ2=0.092,P=0.76)。
此项研究得到北京大学精神卫生研究所伦理委员会的批准。所有研究对象均来自中国北方地区汉族人群,均于入组前详细了解本研究的目的和程序,并签署知情同意书。孤独症儿童由其法定监护人签署知情同意书。
1.2 研究方法
1.2.1 全基因组DNA提取 抽取受试者外周静脉血 5 mL,乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA)抗凝,分装血浆和血细胞后保存于-80℃冰箱,全基因组DNA采用Qiagen公司生产的小量血液基因组DNA提取试剂盒(QIAamp DNA Blood Mini Kit)提取。
1.2.2 基因型扩增 参考既往文献报道,依据dbSNP数据库(http://www.ncbi.nlm.nih.gov/SNP/)和国际人类基因组单体型图计划(international HapMap project)数据库(http://www.hapmap.org/),选择位于ASMT基因启动子和第1外显子区域的5个SNPs。这5个SNPs包括位于ASMT基因5’非翻译区的rs4446909、rs5989681、rs56690322、rs6644635和位于第1外显子的错义突变rs17149149。采用DNA直接测序法进行基因型检测。上游引物为5′-GCTGGCATCTTGATGTTGAA-3′,下游引物为5′-CAACAATGGAACGTG AGTGTG-3′。
聚合酶链式反应(polymerase chain reaction,PCR)扩增反应体系为25 μL,包括10 mmoL的Tris-HCl(pH 8.3),50 mmoL的氯化钾,1.5 mmoL的氯化镁,200 μmoL三磷酸碱基脱氧核苷酸(deoxy-ribonucleoside triphosphate,dNTPs),上下游引物各0.3 μmoL,Taq DNA聚合酶1个单位,全基因组DNA 30 ng。PCR扩增反应条件:94°C预变性5 min,94° C变性30 s,55°C退火30 s,72°C延伸40 s,共36个循环,最后72°C延伸7 min。取3 μL PCR扩增产物用1.5%的琼脂糖凝胶电泳分析鉴定。
1.2.3 DNA测序 PCR扩增产物长586 bp(碱基对)。先使用试剂盒(Ampli Taq DNA polymerase)对PCR产物进行纯化,其后使用BigDye测序试剂盒(ABI公司,美国),通过ABI 3730xl测序仪进行基因型检测。测序结果采用DNAstar中的MegAlign软件与标准序列进行比对。
1.2.4 统计分析 应用卡方拟合优度检测法对每个SNP位点进行Hardy-Weinberg平衡检验,P值大于0.05为符合HW平衡。采用Haploview4.0软件,计算两个SNP之间的连锁不平衡(linkage disequi-librium,LD)D’值。D’值大于0.8被认为存在连锁不平衡,构成连锁不平衡块。每个SNP等位基因和基因型频率在患者组与正常对照组之间的差异采用皮尔森χ2分析。计算所得最小期望值小于1时,采用Fisher确切概率法。计算所得最小期望值小于5时,采用连续校正法。应用SPSS 13.0进行计算,检验水准ɑ=0.05,双侧检验。针对本研究样本量,采用遗传效能计算器(genetic power calculator)(pngu. mgh.harvard.edu/~purcell/gpc/)计算统计效能。
2 结果
2.1 Hardy-Weinberg遗传平衡检验 正常对照组和患者组中5个SNPs的基因型频率均符合HW 平衡 (rs4446909:χ2=2.57,P>0.05;χ2=0.39,P>0.05;rs5989681:χ2=2.50,P>0.05;χ2=0.03,P>0.05;rs56690322:χ2=0.01,P>0.05;χ2=0.02,P>0.05;rs6644635:χ2=0.10,P>0.05;χ2=0.55,P>0.05;rs17149149:χ2=0.27,P>0.05;χ2=0.19,P>0.05)。
2.2 ASMT基因启动子区域遗传多态性在孤独症患者和正常对照之间的比较 患者组和对照组间5个SNP位点的基因型和等位基因频率的差异均无统计学意义(rs4446909:χ2=2.98,P>0.05;χ2=0.51,P>0.05;rs5989681:χ2=3.45,P>0.05;χ2=1.90,P>0.05;rs56690322:χ2=0.58,P>0.05;χ2=0.57,P>0.05;rs6644635:χ2=0.10,P>0.05;χ2=0.0002,P>0.05;rs17149149:χ2=3.79,P>0.05; χ2=3.63,P>0.05)。见表1。
2.3 ASMT基因3个SNP之间的连锁不平衡分析 由于两个位点rs56690322和rs17149149最小等位基因频率在正常对照组分别为 0.005和0.038,均小于0.05,因此仅计算另外3个SNPs位点rs4446909、rs5989681和rs6644635之间的连锁不平衡情况。3个SNP之间的D’值为0.85-0.98,表明此3个SNPs位点之间存在连锁不平衡。对这3个SNPs位点等位基因构成的单体型进行关联分析,患者组和对照组单体型频率的差异无统计学意义(rs4446909-rs5989681:A-Cχ2=0.70,P>0.05;G-Cχ2=0.47,P>0.05;G-Gχ2=1.59,P>0.05;rs5989681-rs6644635:C-Cχ2=2.15,P>0.05;G-C χ2=2.63,P>0.05;G-Tχ2=0.005,P>0.05;rs4446909-rs5989681-rs6644635:A-C-Cχ2=0.91,P>0.05;G-C-Cχ2=0.42,P>0.05;G-G-Cχ2=2.96,P>0.05;G-G-Tχ2=0.11,P>0.05)。见表2。
2.4 遗传统计效能 3个常见 SNPs rs4446909、rs5989681和 rs6644635的最小等位基因频率为0.23-0.43,故在计算统计效能时,将风险等位基因的最小等位基因频率设为0.23;由于孤独症是多基因复杂疾病,故相对危险度设为1.5,经计算本研究样本的统计效能约为75%。
3 讨论
本研究采用病例对照的研究设计,对390例孤独症患者和420名正常对照的ASMT基因启动子和第1外显子区域进行测序。测序是检测基因型的经典方法,准确率高且有助于发现新的SNPs。本研究发现,该区域5个SNPs等位基因频率与基因型频率在患者组与正常对照组之间的差异无统计学意义,提示ASMT基因启动子和第1外显子区域的遗传多态性位点可能与中国汉族孤独症无关联。

表1 儿童孤独症患者组与对照组ASMT5个SNPs位点基因型和等位基因频率的比较 n(%)
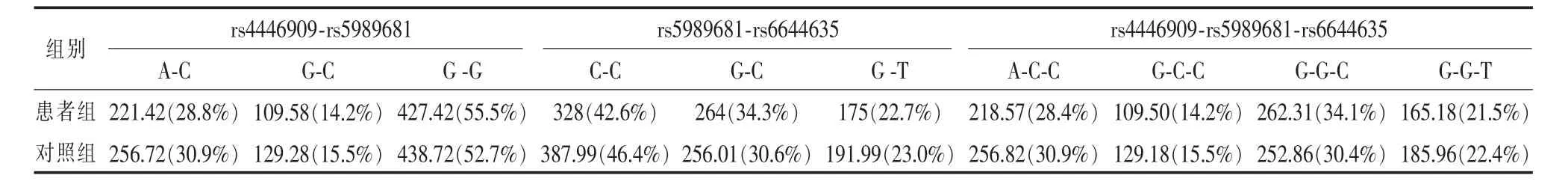
表2 ASMT基因3个SNP构成的单体型频率在患者组和对照组的比较 n(%)
本研究正常对照组和患者组中5个SNPs的基因型频率均符合H-W平衡,表明研究样本为随机婚配,无明显的自然选择、迁移、遗传漂变等因素对遗传平衡的影响,样本具有代表性。经计算本研究统计效能约为75%,说明本研究样本量满足关联研究需要。
国外研究对250例孤独症谱系障碍患者和255名正常对照的ASMT基因进行测序,发现位于ASMT基因启动子区域的2个SNPs位点rs4446909和rs5989681与孤独症关联,且这两个位点与外周白细胞系中ASMT基因转录水平降低有关。该研究还发现1例孤独症谱系障碍患者的rs17149149(N17K)基因型为AA,导致其编码的第17位氨基酸由天冬酰胺变为赖氨酸;而正常对照中未发现此变异。此外,另1例患者第5外显子与内含子交界区存在1个频率很低的变异(IVS5+2 T>C)[10]。另一项研究对109例孤独症谱系障碍患者进行ASMT基因测序,也发现1例患者携带第5外显子与内含子交界区的变异(IVS5+2 T>C)[13]。
与国外研究结果并不一致,本研究未发现ASMT基因启动子和第1外显子区SNPs与孤独症关联;仅发现1名正常对照rs17149149的基因型为AA,且该基因型经反向测序进一步证实,但在儿童孤独症患者中均未发现此变异。本研究结果与国外研究不一致的可能原因分析如下:①不同种族之间遗传背景不同,存在着遗传异质性;如欧洲人群中ASMT基因启动子区的SNP位点 rs56690322最小等位基因频率为0.1至0.13,而在本研究中国汉族人群中却为0.008。因此,ASMT启动子和第1外显子区遗传多态性位点可能不是中国汉族人群孤独症的致病原因。②ASMT基因其他的遗传变异仅仅增加了孤独症的患病风险。③孤独症具有临床异质性,其临床表现不尽相同,故不同研究中可能存在样本的异质性问题。国外研究对象多为孤独症谱系障碍,包括孤独症、Asperger综合征和未特定的广泛性发育障碍(pervasive developmental disorder-not otherwise specified,PDD-NOS)。但本研究入组对象均为典型孤独症患者,减少了研究对象的异质性。
综上所述,本研究采用病例对照的研究方法,探讨ASMT基因启动子和第1外显子区域遗传多态性与孤独症的关联研究,结果并未发现该区域的5个SNPs与孤独症关联。但本研究仅对ASMT基因启动子和第1外显子进行测序,而未对该基因的其他外显子进行测序。今后的研究将进一步扩大样本对该基因其他外显子进行测序,以发现导致氨基酸改变的SNPs,进一步探讨ASMT基因与孤独症是否存在关联。
[1]Veenstra-Vanderweele J,Cook EJr,Lombroso PJ.Genetics of childhood disorders:XLVI.Autism,part 5:genetics of autism[J].J Am Acad Child Adolesc Psychiatry,2003,42(1):116-118.
[2]Jamain S, Quach H, Betancur C,et al.Mutations of the X-linked genes encoding neuroligins NLGN3 and NLGN4 are associated with autism[J].Nat Genet,2003,34(1):27-29.
[3]Durand CM,Betancur C,Boeckers TM,et al.Mutations in the gene encoding the synaptic scaffolding protein SHANK3 are associated with autism spectrum disorders[J].Nat Genet,2007,39(1):25-27.
[4]Berkel S,Marshall CR,Weiss B,et al.Mutations in the SHANK2 synaptic scaffolding gene in autism spectrum disorder and mental retardation[J].Nat Genet,2010,42(6):489-491.
[5]Kilpinen H,Ylisaukko-Oja T,Hennah W,et al.Association of DISC1 with autism and Asperger syndrome[J].Mol Psychiatry,2008,13(2):187-196.
[6]Wang K,Zhang H,Ma D,et al.Common genetic variants on 5p14.1 associate with autism spectrum disorders[J].Nature,2009,459(7246):528-533.
[7]Alarcón M,Abrahams BS,Stone JL,et al.Linkage,association,and gene-expression analyses identify CNTNAP2 as an autismsusceptibility gene[J].Am J Hum Genet,2008,82(1):150-159.
[8]Kulman G,Lissoni P,Rovelli F,et al.Evidence of pineal endocrine hypofunction in autistic children[J].Neuro Endocrinol Lett,2000,21(1):31-34.
[9]Nir I,Meir D,Zilber N,et al.Brief report:circadian melatonin,thyroid-stimulating hormone,prolactin,and cortisol levels in serum of young adults with autism[J].J Autism Dev Disord,1995,25(6):641-654.
[10]Tordjman S,Anderson GM,Pichard N,et al.Nocturnal excre-tion of 6-sulphatoxymelatonin in children and adolescents with autistic disorder[J].Biol Psychiatry,2005,57(2):134-138.
[11]Jimenez-Jorge S,Guerrero JM,Jimenez-Caliani AJ,et al.Evidence for melatonin synthesis in the rat brain during development[J].J Pineal Res,2007,42(3):240-246.
[12]Agez L,Laurent V,Guerrero HY,et al.Endogenous melatonin provides an effective circadian message to both the suprachiasmatic nuclei and the pars tuberalis of the rat[J].J Pineal Res,2009,46(1):95-105.
[13]Melke J,Goubran Botros H,Chaste P,et al.Abnormal melatonin synthesis in autism spectrum disorders[J].Mol Psychiatry,2008,13(1):90-98.
[14]Toma C,Rossi M,Sousa I,et al.Is ASMT a susceptibility gene for autism spectrum disorders? A replication study in European populations[J].Mol Psychiatry,2007,12(11):977-979.
[15]Cai G,Edelmann L,Goldsmith JE,et al.Multiplex ligation-dependent probe amplification for genetic screening in autism spectrum disorders:efficient identification of known microduplications and identification of a novel microduplication in ASMT[J].BMC Med Genomics,2008,(1):50.
[16]Jonsson L,Ljunggren E,Bremer A,et al.Mutation screening of melatonin-related genes in patients with autism spectrum disorders[J].BMC Med Genomics,2010,(3):10.
Association study between polymorphisms in the promotor and exon 1 of ASMT and autism in a Chinese Han population.
WANG Lifang,LU Tianlan,LI Jun,ZHENG Fanfan,RUAN Yanyan,JIA Meixiang,YUE Weihua,LIU Jing,ZHANG Dai.Institute of Mental Health,Peking University;Key Laboratory of Mental Health,Ministry of Health(Peking University),No.51 Hua Yuan Bei Road,Haidian District,Beijing 100191,China.Tel:010-82801960.
ObjectiveTo investigate whether single nucleotide polymorphisms(SNPs)in ASMT(acetylserotonin methyltransferase)promotor and exon 1 were associated with autism in a Chinese Han population.MethodsThe polymorphisms in promoter and exon 1 were genotyped by direct sequencing in 390 Chinese Han individuals with autism and 420 healthy controls.Allele and genotype frequencies for each polymorphism were compared between patients and controls using Person’s chi-square analysis.Resultsour study did not detect significant differences of genotypic distribution and allele frequencies of 5 SNPs (rs4446909, rs5989681, rs56690322, rs6644635, and rs17149149)between autism patients and healthy controls(P>0.05).Rs4446909,rs5989681,and rs6644635 were in one linkage disequilibrium(LD)block with D’ranged from 0.85 to 0.98。However,the haplotypes constructed by these three SNP were not significantly associated with autism(P>0.05).ConclusionsGenetic variants in the promoter, and exon 1 of ASMT may be not significantly associated with autism in Chinese Han population.Further sequencing the other exons is needed.
Autism ASMT gene Melatonin Association study
R749.94
A
2012-01-01)
(责任编辑:文飞)
10.3969/j.issn.1002-0152.2012.03.003
☆ 国家重点基础研究发展计划(973计划,编号:2010CB833905);国家自然科学基金(编号:30870897,81071110);北京市自然科学基金(编号7081005)
* 北京大学精神卫生研究所,卫生部精神卫生学重点实验室(北京大学)

