大豆油脱臭馏出物中角鲨烯的富集研究
丁 辉,程 楠,齐德珍,徐世民
(1.天津大学化工学院,天津 300072; 2.精馏技术国家工程研究中心,天津 300072)
角鲨烯(squalene),为无色或微黄色透明油状液体,分子式为C30H50,化学名称为2,6,10,15,19,23-六甲基-2,6,10,14,18,22-二十四碳六烯,是一种高度不饱和的直链三萜类化合物,广泛存在于大多数动植物体内。角鲨烯在医药、化妆品和保健品等领域有着重要的应用[1-3]。目前它的主要来源为鲨鱼肝油,而由于近年来鲨鱼的低繁殖率以及环境破坏对鱼种的污染,出于对野生海洋动物的保护,提取植物性角鲨烯逐渐替代动物性角鲨烯逐渐成为一种趋势[4-5]。
大豆油脱臭馏出物(SODD)是大豆油脱臭过程中得到的副产品,主要组成为:游离脂肪酸(FFA)、甘油酯、甾醇及甾醇酯、生育酚、角鲨烯、少量的烃类、酮和醛等。它可用来提取脂肪酸、生育酚、甾醇,也可用于提取角鲨烯。目前国内外对生育酚、植物甾醇的提取分离研究较多,许多成果已经实现工业化[6-9]。
目前植物性角鲨烯的提取分离多采用植物油为原料,价格昂贵,成本较高;主要方法有皂化分离法、减压蒸馏法、分子蒸馏法、超临界流体萃取法和柱色谱分离法等[10-14]。本研究以大豆脱臭馏出物为原料,成本低廉,通过皂化、二级分子蒸馏过程富集角鲨烯,用高效液相色谱测定其含量。并讨论了皂化反应以及分子蒸馏的最适宜条件,为正在发展的植物角鲨烯的提取提供有用的依据。
1 试验部分
1.1 仪器与试剂
大豆油脱臭馏出物,ω(角鲨烯)为1.95%,购于某油脂加工厂;色谱纯甲醇;液氮;其他为国产分析纯。
Waters 600-717-996高效液相色谱仪,美国Waters公司;刮膜式小试分子蒸馏器,德国VTA公司;LABOROTA 4000型旋转蒸发仪,德国海道尔夫公司;F12再循环冷却器,德国Julabo公司。
1.2 不皂化物的提取
称取300 g大豆油脱臭馏出物放入2 000 mL三口圆底烧瓶中,加入一定量的氢氧化钾-乙醇溶液,在一定温度下搅拌回流一定时间;停止加热后用500 mL蒸馏水进行水洗;冷却后用150 mL正己烷重复萃取5次,合并萃取液;用质量分数为10%的乙醇水溶液洗涤萃取液;将洗涤后的不皂化物在冰箱内存放4 h,将析出的皂去除;用旋转蒸发仪蒸除正己烷,得到不皂化物[15]。
1.3 分子蒸馏过程
SODD不皂化物从进料器经预热后进入分子蒸馏装置,物料在重力及刮膜器共同作用下在蒸发表面上形成均匀液膜,蒸馏温度由导热油精确控制。原料在蒸发面上受热,在高真空条件下(系统压力低于10 Pa),低沸点组分从液膜表面蒸发,在中间冷凝器被冷凝成液相,沿冷凝面流入馏出液接收瓶;重组分则沿主体壁面流入馏余液接收瓶。为防止挥发性物质进入真空系统,在管路上设置冷阱,其中加入液氮作为制冷剂。由于真空系统有中间冷凝管和冷阱的双重冷凝作用,保证了整个系统操作压力的均衡[15]。
1.4 分析方法
采用Waters 600-717-996 高效液相色谱仪。色谱条件为:色谱柱YMC-PackODS-A(s-5 μm,12 nm);柱温25 ℃;流动相V(甲醇)∶V(水)为99∶1,流速1.0 mL/min;检测波长210 nm;检测时间25 min;进样量10 μL。采用面积归一法计算含量。
2 结果与讨论
2.1 皂化反应正交试验结果
影响皂化反应的主要因素有反应时间、反应温度和碱的浓度等。以不皂化物中角鲨烯含量为指标,采用L8(27)正交设计对3个因素进行优化,确定最适宜皂化反应条件。其试验因素和水平设置见表1。水平1的选择依据为前期单因素试验结果,水平2则在水平1基础上相应降低,以寻求在较低时间、较低温度、较少碱用量的情况下,获取最适宜试验效果。试验结果列于表2中。

表1 皂化反应正交试验因子水平表Table 1 Definition of factors and levels for saponification
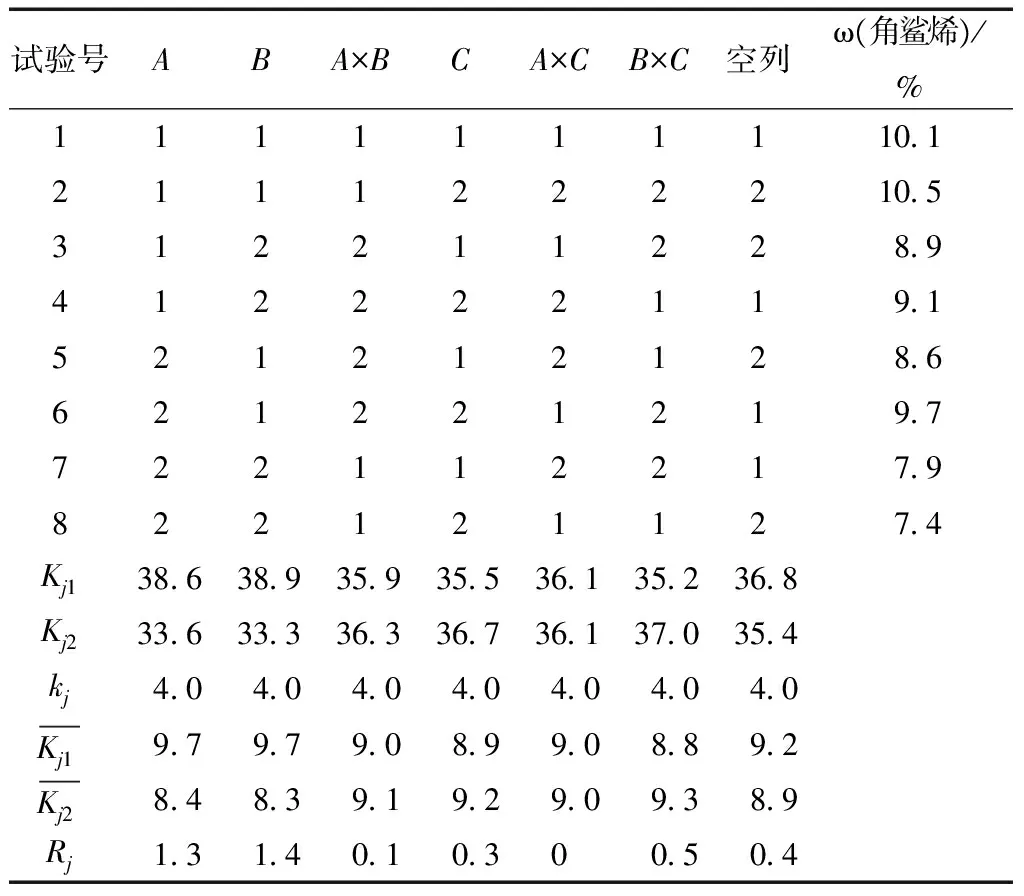
表2 正交设计直观分析表Table 2 Visual analysis table of orthogonal design
由表2可知,影响皂化反应的因素的主次顺序为B>A>C;在交互作用中RB×C>RA×B>RA×C,但是这些交互作用的影响相对于温度和时间的影响可以忽略不计,可视为由试验误差引起的。在此未考虑角鲨烯收率的原因是,在前期单因素试验结果中,角鲨烯收率变化并不明显。这是由于维生素E的抗氧化效果甚于角鲨烯,对角鲨烯起到了保护作用,而SODD中维生素E的含量较高,故角鲨烯在原料中具有较高的稳定性,不会遭到破坏,这与文献报道的结果一致[16]。综合考虑得出最适宜工艺条件为A1B1C2,即反应时间为40 min,反应温度为80 ℃,KOH浓度为0.8 mol/L。
为验证优化条件,取原料10 g,加入0.8 mol/L新配制的氢氧化钾-乙醇溶液100 mL,在80 ℃搅拌回流条件下反应40 min,按1.2步骤进行提取,在此进行3组平行试验,3次试验结果ω(角鲨烯)的平均值为9.9%,收率为98.6%。
2.2 第一级分子蒸馏响应面设计分析
2.2.1设计方案及结果
影响分子蒸馏富集效果的因素主要有:系统压力、预热温度、蒸发温度、进料速率、刮膜转速等。由于角鲨烯是热敏性物质,需尽量降低蒸馏温度,故固定系统压力为装置所能达到的最小压力,即0.1 Pa,固定预热温度70 ℃,SODD进料量60 g。采用Box-Behnken响应曲面法[17]对分子蒸馏效果影响较大的蒸发温度、进料速率、刮膜转速这3因素进行试验设计和分析,以获得角鲨烯的最高含量及最佳收率。本试验设计包括12个因子试验点和3个重复中心点,其中3个重复中心点用来计算纯误差。具体的因素水平见表3。各水平的确定以单因素影响研究结论为依据,由于第一级分子蒸馏的目的是去除轻烃、醛、酮等低沸点物质,而角鲨烯较容易被蒸出,故第一级分子蒸馏在较低蒸发温度及进料速率范围内进行。

表3 3因素水平及编码Table 3 Independent variables and their levels

表4 Box-Behnken试验设计及试验数据Table 4 Box-Behnken design and experimental data
2.2.2响应面模型的建立与分析
由Design-Expert软件对试验数据进行分析并回归拟合,方差分析结果如表5所示,可得到以角鲨烯含量及收率为响应值的回归公式分别为:

表5 角鲨烯含量及收率的响应面分析拟合回归方程的方差分析结果Table 5 Analysis of variance with regression model on extraction conditions of squalene content and yield
注:Values of “Prob>F” less than 0.050 0 indicate model terms are significant.
Y1=15.01+0.44X1+0.63X1X2-
(1)
Y2=89.00-15.00X1+5.12X2+
(2)
由表5可以看出:回归方程Y1和Y2的线性相关系数分别为0.965 3及0.980 2;模型项P值均远小于0.05,说明方程显著;失拟项不显著,说明方程的拟合度较好。各交互作用对角鲨烯含量和收率影响的响应面图如图1及图2所示。
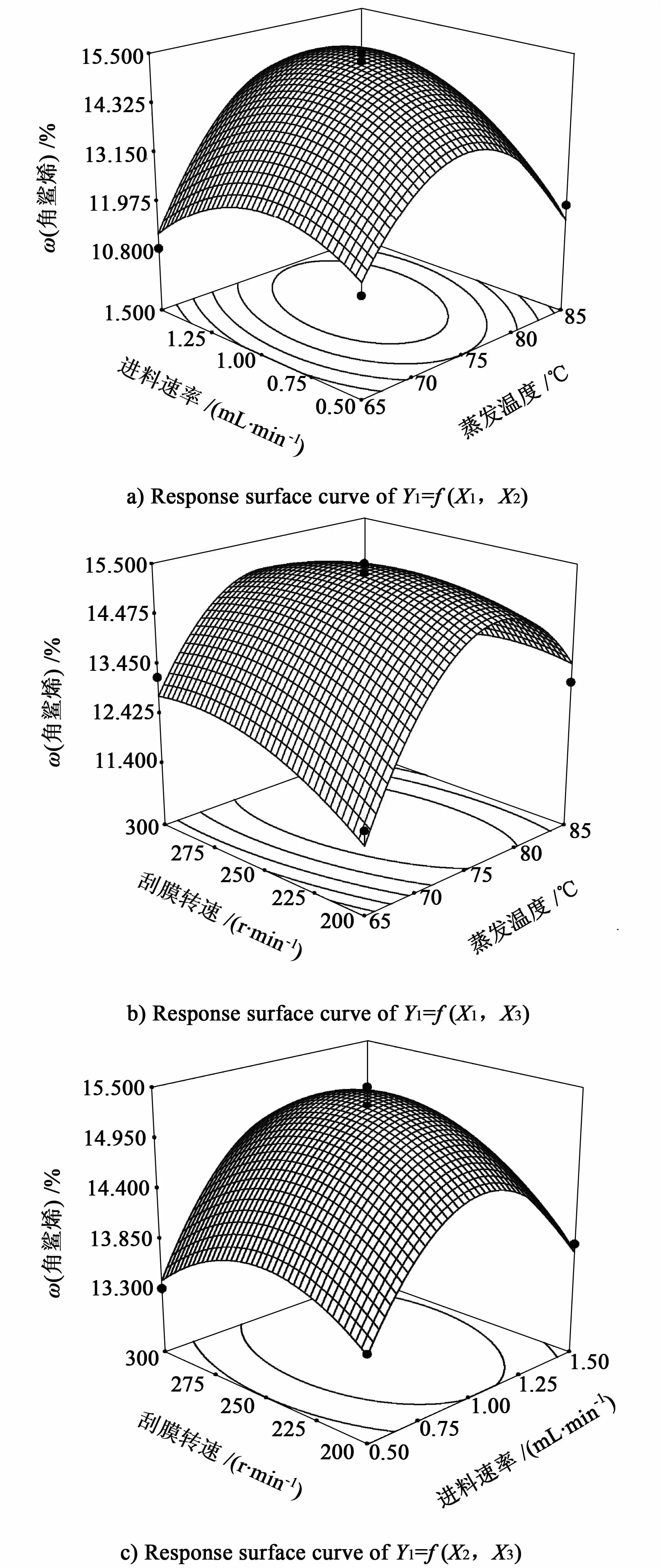
图1 各交互作用对角鲨烯含量影响的响应面图Fig.1 Response surface curve of squalene content as functions of each interaction
2.2.3最适宜条件的确定及试验验证
为使角鲨烯的ω(角鲨烯)和收率同时达到一最适宜值,依旧利用Design-Expert软件,将ω(角鲨烯)的标准范围定在15.0%~15.5%,目标选定“maximize”;收率范围定在90.0%~100.0%,应用2个模型方程,通过Design Expert软件可以得到目标的图解最优化。最优化图解如图3所示。
最终确定优化条件为:蒸发温度73 ℃、进料速度1.1 mL/min、刮膜速度250 r/min,此时重相中ω(角鲨烯)为15.2%,收率为92.0%。该温度条件下能保证角鲨烯不随之被蒸出,而较低的进料速度可以保证物料在蒸发壁面上的停留时间不致过短,提高蒸发效率;较高的刮膜转速能使液膜厚度更小,分布更均匀,使得蒸发过程的传热和传质过程更完全,但是转速过高也会导致角鲨烯在轻组分中出现。
在优化条件下进行重复试验,试验结果列于表6中。
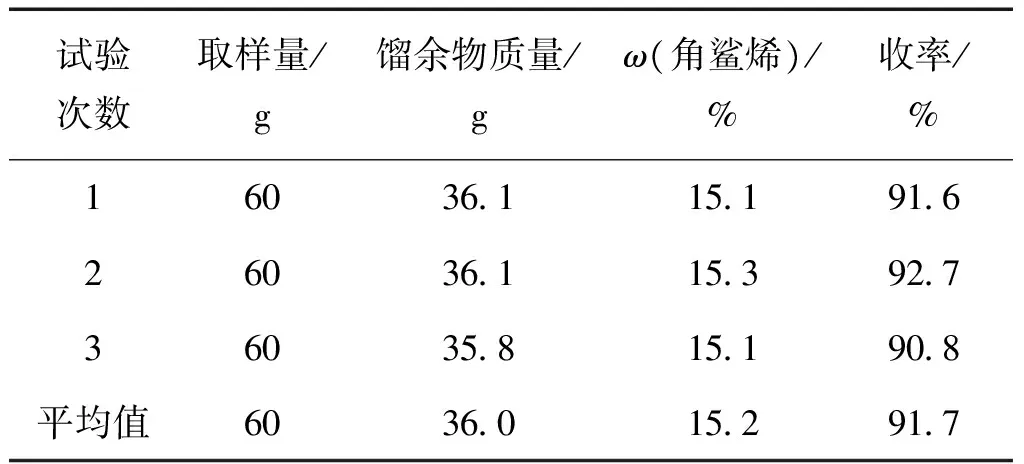
表6 最适宜条件下测定结果Table 6 Results in optimal conditions
2.3 第2级分子蒸馏结果分析
以第1级分子蒸馏的馏余物36 g为原料进行第2级分子蒸馏,选用的条件为:系统压力:0.1 Pa、蒸发温度175 ℃、进料速率4 mL/min、刮膜转速200 r/min、预热温度:70 ℃、冷凝面温度:25 ℃。得到ω(角鲨烯)为21.0%的轻相,收率为95.7%。
3 结论
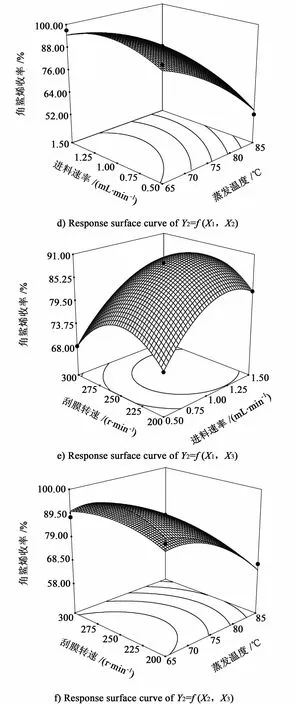
图2 各交互作用对角鲨烯收率影响的响应面图Fig.2 Response surface curve of squalene yield as functions of each interaction
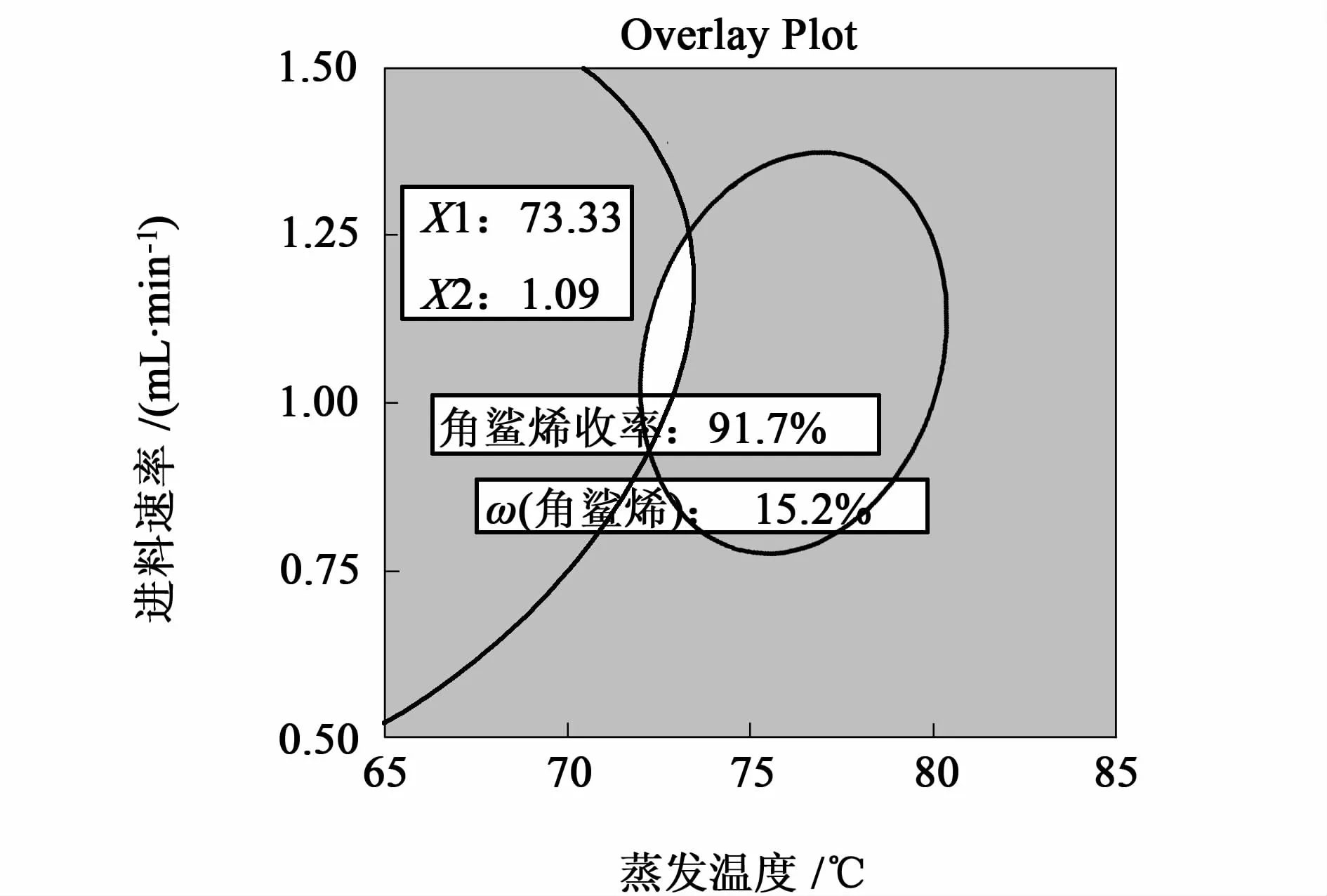
图3 优化图(覆盖图)Fig.3 Overlay plot
采用大豆油脱臭馏出物为原料,探索了经皂化反应及2级分子蒸馏提取植物性角鲨烯代替动物角鲨烯的工艺过程。分别用正交因子设计及响应面法对皂化反应及分子蒸馏的试验条件进行了优化,得到了相应的优化工艺条件。
1)皂化反应过程:反应时间40 min,反应温度80 ℃,KOH浓度0.8 mol/L,得到ω(角鲨烯)为9.92%的不皂化物,收率为98.6%;
2)第1级分子蒸馏过程:蒸发温度73 ℃,进料速率1.10 mL/min,刮膜转速250 r/min,得到ω(角鲨烯)为15.2%的重相,收率为91.7%。经第2级分子蒸馏过程得到ω(角鲨烯)为21.01%的轻相,总收率为86.8%。
参考文献:
[1]肖友国.植物油脂中生物活性成分的研究与展望[J].粮食与食品工业,2006,13(4):1-5
[2]TIKEKAR R V,LUDESCHER R D,KARWE M V.Processing stability of squalene in amaranth and antioxidant potential of amaranth extract[J].Journal of Agricultural and Food Chemistry,2008,56(22):10 675-10 678
[3]REDDY L H,COUVREUR P.Squalene:A natural triterpene for use in disease management and therapy[J].Advanced Drug Delivery Reviews,2009,61(15):1 412-1 426
[4]NENADIS N,TSIMIDOU M.Determination of squalene in olive oil using fractional crystallization for sample preparation[J].The Journal of the American Oil Chemist’Society,2002,79(3):257-259
[5]PAOLO B.Refining by-products as a source of compounds of high-added value[J].Refining by products,2006,57(1):123-123
[6]HIROTA Y,WATANABE T N Y.Purification of steryl esters from soybean oil deodorizer distillate[J].Journal of the American Oil Chemists’ Society,2003,80(4):341-346
[7]TORRES C F,FORNARI T,TORRELO G,etal.Production of phytosterol esters from soybean oil deodorizer distillates[J].European Journal of Lipid Science and Technology,2009,111(5):459-463
[8]GUNAWAN S,FABIAN C,YI-HSU J.Isolation and purification of fatty acid steryl esters from soybean oil deodorizer distillate[J].Industrial & Engineering Chemistry Research,2008,47(18):7 013-7 018
[9]ZHOU W,QIN D,QIAN J.Optimisation of enzymatic pretreatment of soybean oil deodorizer distillate for concentration of tocopherols[J].International Journal of Food Science & Technology,2009,44(7):1 429-1 437
[10]HE H,CAI Y,SUN M,etal.Extraction and purification of squalene from amaranthus grain[J].Journal of Agricultural and Food Chemistry,2002,50(2):368-372
[11]官波,郑文诚.角鲨烯提取、纯化及其应用[J].粮食与油脂,2010,(02):44-46
[12]徐世民,戴宇航,丁辉,等.以橄榄油为原料提取高纯度角鲨烯的方法:中国,200910069670.8[P].2009-12-09
[13]MARTINEZ-CORREA H A,GOMES D C A,KANEHISA S L.Measurements and thermodynamic modeling of the solubility of squalene in supercritical carbon dioxide[J].Journal of Food Engineering,2010,96(1):43-50
[14]AGUADO R M,MARTIN A.Acquiring squalene comprises alkaline saponification of the raw material;physical separation of the saponificable and unsaponifiable fractions; and distillation of the obtained unsaponifiable molecular fraction:WO,2008142175-A1[P].2008-11-27
[15]齐德珍.大豆油脱臭馏出物中角鲨烯的分离提取研究[D].天津:天津大学,2010
[16]徐莉,王若兰,曹晓博.橄榄油抗氧化成分变化研究[J].河南工业大学学报:自然科学版,2007,28(2):38-41
[17]崔刚.分子蒸馏法分离提取大蒜精油[J].食品科学,2010,31(24):236-240

