破骨细胞核因子κB受体活化因子配体和骨保护素在根尖周囊肿和肉芽肿中的表达及意义
张梅华 于蕴之 缪羽
(1.内蒙古医学院第三附属医院 口腔科,包头014010;2.内蒙古医学院第四附属医院 口腔科,包头014030)
破骨细胞核因子κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)/骨保护素(osteoprotegerin,OPG)系统是影响破骨细胞分化、发育、调节的重要信号通路,也是全身因子和局部因子调节骨代谢的共同通路[1]。根尖周囊肿以及根尖周肉芽肿的发病机制错综复杂,至今尚未完全阐明。柳惠荣等[2]研究发现慢性牙周炎患者龈沟液中RANKL浓度增高,OPG浓度下降,RANKL和OPG之间平衡失调,促进牙槽骨吸收。Zhang等[3]研究发现,在根尖周病变活动期RANKL表达增加而OPG表达降低,病变的静止期或修复期RANKL表达降低而OPG表达增加。随着RANKL和OPG调控失衡引发骨吸收理论的出现,人们对根尖周病变骨破坏的认识转向到炎症发生和调控上。本研究采用免疫组织化学法,检测RANKL和OPG在根尖周囊肿和根尖周肉芽肿中的表达水平,并分析其相关关系,旨在观察两因子在根尖周囊肿、根尖周肉芽肿和正常牙周组织中的表达规律,探讨RANKL和OPG在不同根尖周疾病周围骨质破坏机制中的作用,从而为根尖周囊肿和根尖周肉芽肿的临床治疗提供理论依据。
1 材料和方法
1.1 研究对象
收集2008年9月—2011年1月到内蒙古医学院第四附属医院就诊的因根尖周囊肿拔除的患牙,取其囊肿组织20例为囊肿组,其中男12例,女8例,平均年龄(32.35±4.76)岁;收集不愿意治疗或根管治疗失败要求拔除的根尖周肉芽肿患牙,取其根尖周肉芽肿组织20例为肉芽肿组,其中男11例,女9例,平均年龄(30.55±7.39)岁;收集同时间、因正畸需要拔除的正常无病变牙的牙周膜组织20例为对照组,其中男8例,女12例,平均年龄(29.30±2.54)岁。3组的年龄、性别均无统计学差异(P>0.05)。所有研究对象均排除有全身系统性疾病者(如糖尿病、骨代谢性疾病及甲亢等),同时排除更年期妇女。
本课题中涉及到人体的实验设计以及实验操作规程,均得到捐献者的知情同意,并经过内蒙古医学院伦理委员会审核准予执行。
1.2 主要试剂和仪器
免疫组织化学染色试剂盒Histostain-Plus Kit(Invitrogen公司,美国):试剂A(蓝色液体)为封闭用正常山羊血清工作液,试剂B(黄色液体)为生物素化二抗工作液,试剂C(橙色液体)为辣根酶标记链霉卵白素工作液。DAB试剂盒(Invitrogen公司,美国)。RANKL及OPG抗体(Santa Cruz公司,美国)均为1∶100稀释。25%戊二醛(国药集团化学试剂北京有限公司),10%甲醛(张家口市化学试剂厂)。
KD-BM型生物组织包埋机(浙江省金华市科迪仪器设备有限公司),Leica 2016型切片机、TK-C1381-EG病理图像分析系统、全自动组织脱水机(Leica公司,德国),SHA-C型水浴锅(金坛市荣华仪器制造有限公司),光学显微镜(Nikon公司,日本),KDC-16H高速离心机(合肥科大创新股份有限公司),普通冰箱(Siemens公司,德国),电热恒温水浴锅(北京长安科学仪器厂),DW86L386型超低温保存箱(青岛海尔集团),显微摄像系统(Olympus公司,日本)。
1.3 实验方法
1.3.1 组织石蜡切片准备 将标本从10%甲醛中取出脱水,脱水程序:自来水冲洗过夜,75%乙醇2 h,85%乙醇2 h,95%乙醇1 h,100%乙醇1 h×2次。二甲苯透明20 min×2次,浸蜡55 ℃,切片,厚度为4 μm,60 ℃烤片4 h。
1.3.2 免疫组织化学操作过程 1)石蜡切片常规脱蜡至水(二甲苯Ⅰ8 min,二甲苯Ⅱ8 min,无水乙醇5min,95%乙醇5 min,85%乙醇5 min,75%乙醇5 min,流水冲洗5 min)。2)抗原修复:将切片连同柠檬酸缓冲液放入高压锅内,加热至产生喷气,并持续2 min,压力锅离开热源。3)取出并恢复至室温,PBS液冲洗,3 min×3次。4)3%H2O2去离子水(无色液体)孵育20 min以消除内源性过氧化物酶活性,PBS液冲洗,3 min×3次。5)滴加试剂A室温孵育10~15 min,倾去,勿洗。6)滴加适当比例稀释的一抗(1∶100),阴性对照以PBS代替一抗。放入湿盒内4 ℃过夜。7)取出并恢复至室温,PBS液冲洗,3 min×3次。8)滴加试剂B室温或37 ℃孵育10~15 min,PBS液冲洗,3 min×3次。9)滴加试剂C室温或37 ℃孵育15 min,PBS液冲洗,3 min×3次。10)DAB显色剂显色,自来水充分冲洗约5 min,苏木素复染,脱水,透明。中性树脂封片。
1.4 阳性结果判定
先在光学显微镜低倍镜下观察整张切片,然后在高倍镜下每张切片选10个视野,取各视野阳性细胞表达的平均值(个)作为阳性细胞表达值。同时采用形态学图像分析系统对各组免疫组织化学染色切片随机采集、放大、输入计算机,每个标本两张切片,每张切片随机选取5个高倍视野(×400),观测RANKL和OPG的表达及病变。显微镜下观察到细胞浆及核膜上呈棕色或褐色颗粒,为阳性染色(即阳性表达)。
1.5 统计学处理
采用SPSS 17.0软件进行统计学分析。计量资料描述以±s表示。3组间的比较,先在正态分布和方差齐同的条件下对3组进行单因素方差分析,然后采用q检验进行任意两组间的比较。各组RANKL和OPG的相关性分析采用直线相关,先绘制散点图,并求其相关系数r,再做显著性检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组间RANKL和OPG表达的比较
3组间RANKL和OPG的表达及比较见图1、2和表1、2。1)囊肿组、肉芽肿组、对照组中,RANKL的表达分别为75.00±7.54、68.40±6.74和29.40±2.46,方差齐性检验P=0.12>0.1,表明方差齐同。单因素方差分析P<0.01,差异有统计学意义,进一步两两比较,任两组之间比较均为P<0.01,差异有统计学意义,从高到低依次为囊肿组、肉芽肿组和对照组。2)囊肿组、肉芽肿组、对照组中,OPG的表达分别为38.10±7.09、47.65±13.85和58.60±5.88,方差齐性检验P=0.11>0.1,表明方差齐同。单因素方差分析P<0.01,差异有统计学意义,进一步两两比较,任两组之间比较均为P<0.01,差异有统计学意义,从低到高依次为囊肿组、肉芽肿组和对照组。
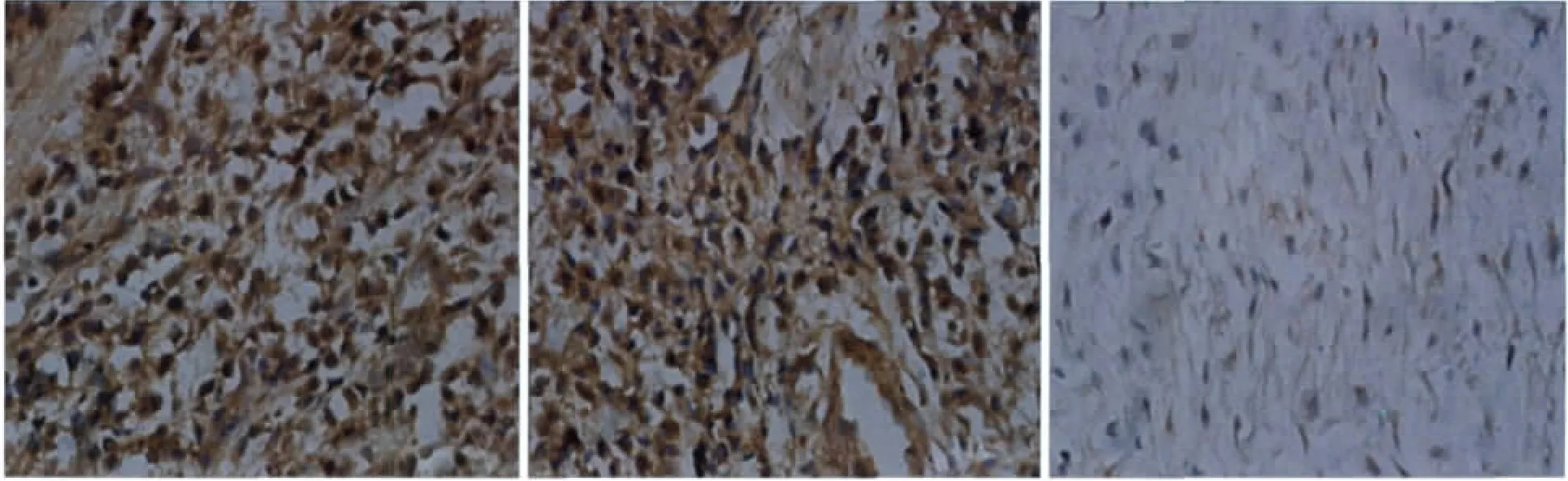
图1 囊肿组(左)、肉芽肿组(中)和对照组(右)RANKL阳性表达 免疫组织化学×400Fig 1 The positive expression of RANKL among the cyst group(left),granuloma group(medium)and control group(right)immunohistochemistry×400
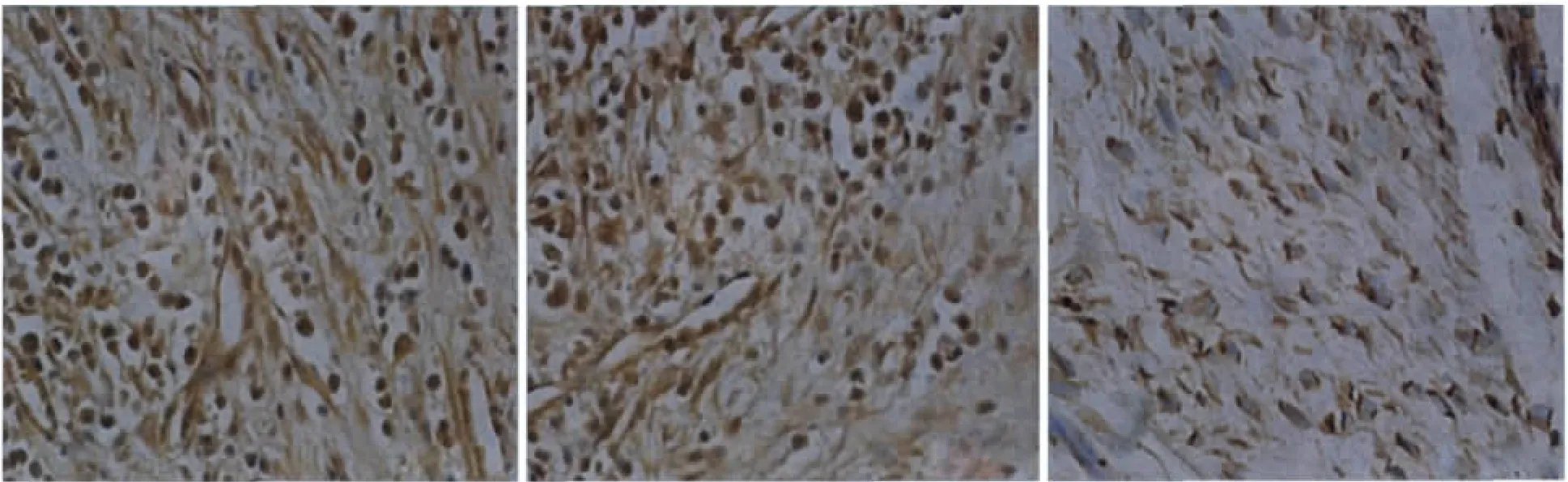
图2 囊肿组(左)、肉芽肿组(中)和对照组(右)OPG阳性表达 免疫组织化学×400Fig 2 The positive expression of OPG among the cyst group(left),granuloma group(medium)and control group(right)immunohistochemistry×400
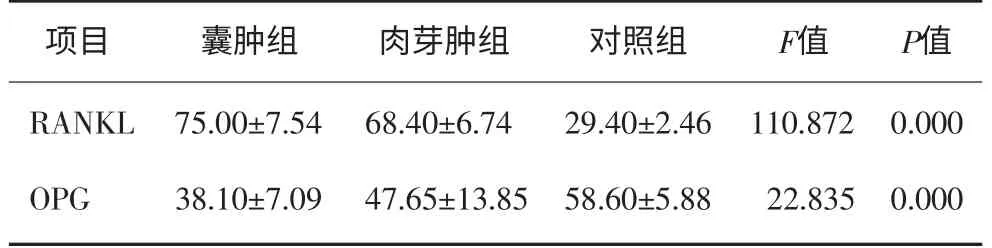
表1 3组间RANKL和OPG的表达及比较Tab 1 The expression and comparison of RANKL and OPG among three groups
2.2 RANKL和OPG的相关性分析
囊肿组中RANKL与OPG的相关性散点图呈线性趋势(图3),相关系数r=-0.56,P=0.01,说明囊肿组中RANKL与OPG呈负相关关系。肉芽肿组其相关系数r=-0.388,P=0.091,对照组其相关系数r=0.059,P=0.805,且二者散点图均不成线性趋势,说明肉芽肿组和对照组中RANKL和OPG无相关关系。
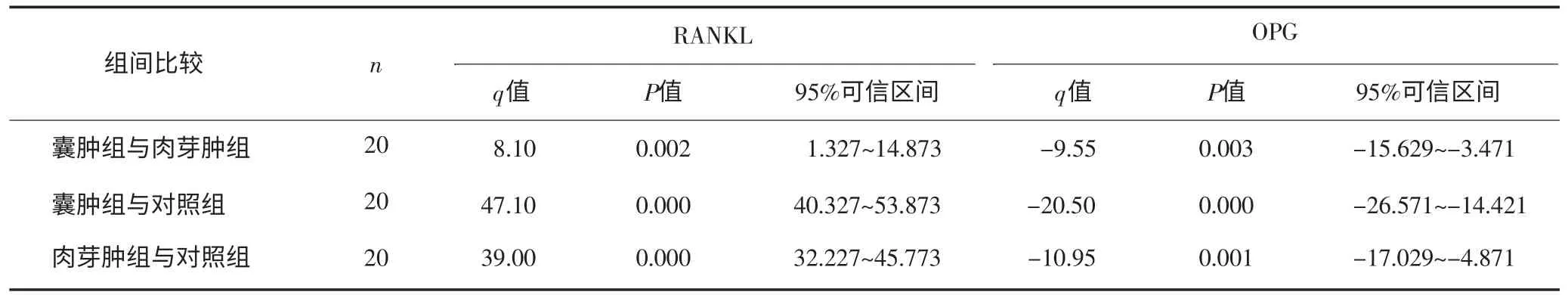
表2 3组间RANKL和OPG表达的两两比较Tab 2 Any two groups expression comparison of RANKL and OPG among three groups
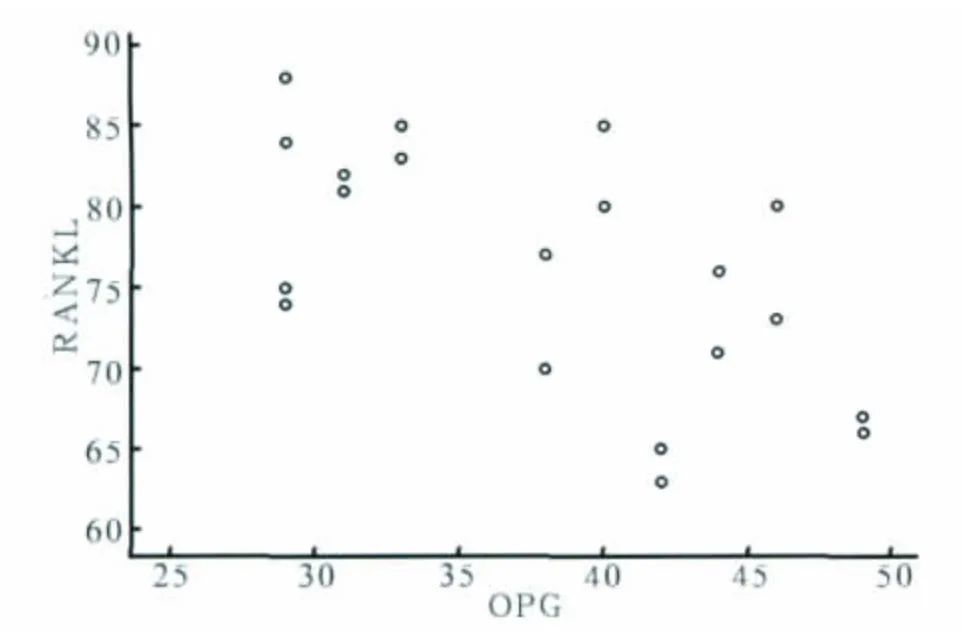
图3 囊肿组RANKL、OPG的相关性分析Fig 3 The correlation analysis of RANKL and OPG in the cyst group
3 讨论
目前关于RANKL和OPG因子在根尖周囊肿及根尖周肉芽肿周围骨破坏和吸收中作用的研究却较少。本实验中利用免疫组织化学技术,检测到了RANKL的表达在三组间差异均有统计学意义,囊肿组>肉芽肿组>对照组,说明RANKL的表达随病变发展而增加,这符合根尖周肉芽肿和囊肿均是颌骨的溶骨性病变,且RANKL在正常牙周膜中的表达也是骨正常代谢活动的表现。OPG的表达在3组间的差异也有统计学意义,囊肿组<肉芽肿组<对照组,显示肉芽肿组中OPG较囊肿组增强,其对破骨细胞激活的抑制作用也随之增强,致使骨吸收活动减弱。OPG是RANKL的诱骗受体,通过与表达在成骨细胞表面和T细胞表面的破骨细胞核因子κB受体活化因子(receptor activator of nuclear factor κB,RANK)结合,竞争性地抑制RANKL与受体RANK之间的信号传导,从而抑制RANKL对破骨细胞的生成激活等诱导作用[4],随着病变程度的加重,RANKL在囊肿组中的表达较肉芽肿组增加,说明根尖周肉芽肿患牙未经过正规彻底的治疗,会发展为根尖周囊肿,根尖周囊肿的周围破坏较肉芽肿范围大。RANKL的高表达又促进了骨吸收的进程,根尖周组织的骨破坏进一步加重,这一点与临床表现相同。
Sabeti等[5]采用逆转录多聚酶链反应,对21个人类根尖周病损组织中RANKL和OPG的mRNA表达进行检测,结果发现所有样本中均有其mRNA表达。RANKL可能与慢性根尖周炎骨吸收活动关系密切,同时RANKL和OPG可能在根尖周病变的疾病进展中具有重要作用。本研究中,对RANKL和OPG两因子进行了相关性分析,发现囊肿组中两因子呈负相关关系(r=-0.56,P<0.05),而肉芽肿组和对照组则无相关关系。在根尖周囊肿中,随着RANKL增加,OPG表达减少,这可能是因为在根尖周囊肿病变活动期,骨吸收活跃,而根尖周肉芽肿中,致病力相对较弱,骨吸收和骨形成相对较平衡,病变发展较缓和。
通常人们认为根尖周肉芽肿只需进行根管治疗即可解决问题,但是在临床上很多根尖周肉芽肿患者在根管治疗后几年内,根尖周肉芽肿继续长大,继续破坏周围骨质。而根尖周囊肿则可引起颌骨膨胀,致唇颊侧骨壁吸收变薄,甚至发生病理性骨折。所以系统了解根尖周病变骨破坏的机制,实施恰当有效的诊治方案显得尤为重要。唐华[6]在诱发大鼠牙周炎动物模型中采用OPG重组质粒局部注射法进行研究,发现OPG基因制剂治疗能够有效地抑制破骨细胞的分化和活性,减缓牙周炎导致的牙槽骨丧失。Kim等[7]和Hofbauer等[8]提出了可渗透细胞的RANK受体抑制剂(RANK receptor inhibitor,RRI),认为RRI在骨质疏松等骨骼疾病的治疗中具有潜在作用。因此纠正RANKL/OPG的失衡可能成为治疗慢性根尖周病的新途径。当然这还需要大量的动物实验与临床实验的支持与论证。
[1]Findlay DM,Haynes DR.Mechanisms of bone loss in rheumatoid arthritis[J].Mod Rheumatol,2005,15(4):232-240.
[2]柳惠荣,张子彦,郭丽香.慢性牙周炎患者龈沟液OPG和RANKL的变化及意义[J].实用口腔医学杂志,2008,24(1):131-135.
Liu Huirong,Zhang Ziyan,Guo Lixiang.Change and significance of the receptor activator for NF-κB ligand and osteoprotegerin in gingival crevicular fluid in patients with chronic periodontitis[J].J Pract Stomatol,2008,24(1):131-135.
[3]Zhang X,Peng B.Immunolocalization of receptor activator of NF kappa B ligand in rat periapical lesions[J].J Endod,2005,31(8):574-577.
[4]陈丽萍,杨富生,吴礼安.骨保护素的有关研究[J].牙体牙髓牙周病学杂志,2007,17(6):361-363.
Chen Liping,Yang Fusheng,Wu Li’an.Relevant research of osteoprotegerin[J].Chin J Conserv Dent,2007,17(6):361-363.
[5]Sabeti M,Simon J,Kermani V,et al.Detection of receptor activator of NF-kappa beta ligand in apical periodontitis[J].J Endod,2005,31(1):17-18.
[6]唐华.人骨保护素质粒转染抑制大鼠实验性牙周炎骨吸收的研究[D].成都:四川大学,2000.
Tang Hua.Inhibitory effect of plasmid delivery of osteoprotegerin on alveolar bone resorption resulting from experimental periodontitis in rats[D].Chengdu:Sichuan University,2000.
[7]Kim H,Choi HK,Shin JH,et al.Selective inhibition of RANK blocks osteoclast maturation and function and prevents bone loss in mice[J].J Clin Invest,2009,119(4):813-825.
[8]Hofbauer LC,Zeitz U,Schoppet M,et al.Prevention of glucocorticoid-induced bone loss in mice by inhibition of RANKL[J].Arthritis Rheum,2009,60(5):1427-1437.

