细胞内渗透压改变对三叉神经电压门控钠离子通道电流的影响
沈颉飞 王海业 麻颖宜 刘云飞 张书垣 杜莉
(口腔疾病研究国家重点实验室,四川大学,成都610041)
生命体不断感受着生存环境中的力学刺激,这些生物力作用方式包括剪切力、拉伸力等,这些刺激可影响细胞本身的生理特性[1]。作为生物力学中的特殊类别,渗透压在神经系统中的作用举足轻重,研究表明:调节细胞外液渗透压可以影响神经的动作电位传导[2]、周边神经的痛觉传导[3]以及大脑神经细胞突触和脑垂体细胞电压门控钠离子通道(voltage-gated sodium channels,VGSCs)的动力学参数等[4-5]。
作为主要负责口腔颌面部感觉传导的三叉神经,它的生理基础是由电压门控离子通道共同参与的动作电位传导,在这一过程中广泛存在于三叉神经节神经元(trigeminal ganglion neuron,TRGN)上的VGSCs起到了关键作用[6]。有研究已经证明:改变细胞外渗透压可以影响三叉神经细胞上电压门控钾离子通道(voltage-gated potassium channels,VGPCs)的峰值电流密度、失活曲线[7-8],以及电压门控钙离子通道(voltage-gated calcium channels,VGCCs)的电流电压关系曲线[9]。生物体渗透压平衡由细胞内和细胞外环境共同决定,然而关于改变细胞内渗透压所带来的具体影响依然没有被阐述,细胞内渗透压浓度主要由Na、K和Cl 3种离子共同决定[10],VGSCs在保证胞内离子平衡上扮演了重要角色,该通道的表达与三叉神经受损[11]和三叉神经痛[12]也有密切关系,因此研究该通道在胞内不同渗透压影响下所发生的电生理特性改变,具有一定的生理意义。
本研究通过膜片钳全细胞记录法详细记录TRGN上VGSCs的激活和失活过程,并将因细胞内高渗透和低渗透刺激所带来的电生理特性改变进行对比,为进一步推测其可能的机制打下基础。
1 材料和方法
1.1 TRGN细胞的获取
实验动物的获取及处理过程均由四川大学口腔疾病研究国家重点实验室伦理委员会批准。TRGN从SD乳鼠分离出来后,用Hanks平衡液(Hanks’balanced salt solution,HBSS)清洗,平衡液的组成:130 mmol·L-1NaCl、5 mmol·L-1KCl、0.3 mmol·L-1KH2PO4、4 mmol·L-1NaHCO3、0.3 mmol·L-1Na2HPO4·12H2O、5.6 mmol·L-1D-葡萄糖、10 mmol·L-1羟乙基哌嗪乙磺酸(hydroxyethyl piperazine ethanesulfonic acid,HEPES),pH=7.4。然后将剪碎的神经节转移至装有1.5 mL消化液(含20 U·mL-1木瓜蛋白酶,Sigma公司,美国)的EP管中,将其置于37 ℃的恒温水浴箱内消化48~50 min,然后再加入约1 mL DMEM/F-12(体积比1∶1)混合培养基,由大至小用不同口径的Pasteur吸管轻柔反复地吹打组织块约8 min,直至形成细胞悬液。将细胞悬液接种于35 mm培养皿中经过多聚赖氨酸处理的盖玻片上,转移至37 ℃、5%CO2、饱和湿度条件下的细胞培养箱内,使神经细胞贴壁50~60 min,然后在上机之前用细胞外液完全置换培养基,以备下一步操作。
1.2 细胞内液高渗和低渗的形成
根据细胞内液渗透压的高低,将实验所用的细胞分为3组,分别为对照组(306 mOsm组)、低渗组(260 mOsm组)、高渗组(350 mOsm组)。应用渗透压摩尔浓度测定仪通过控制D-甘露醇在电极内液中的量,从而调节细胞内渗透压。等渗细胞内液组成为:110 mmol·L-1CsCl、10 mmol·L-1NaCl、0.1 mmol·L-1CaCl2、10 mmol·L-1HEPES、11 mmol·L-1乙二醇双(2-氨基乙醚)四乙酸[ethyleneglycol bis(2-aminoethyl ether)tetraacetic acid,EGTA]、70 mmol·L-1D-甘露醇,pH=7.3,渗透压为306 mOsm。低渗电极内液不含有D-甘露醇,pH=7.3,渗透压为260 mOsm。高渗电极内液D-甘露醇的量为106 mmol·L-1,pH=7.3,渗透压为350 mOsm。细胞外液组成均为:60 mmol·L-1氯化胆碱、60 mmol·L-1NaCl、20 mmol·L-1氯化四乙铵(tetraethylammonium chloride,TEA-Cl)、5 mmol·L-1KCl、5 mmol·L-1MgCl2·6H2O、2 mmol·L-1CaCl2、0.1 mmol·L-1CdCl2·5H2O、20 mmol·L-1D-葡萄糖、10 mmol·L-1HEPES,pH=7.4,渗透压为306 mOsm。
1.3 VGSCs的全细胞膜片钳记录
VGSCs的全细胞电压膜片钳记录采用Axopatch 200B膜片钳放大器、Digidata 1200数模转换器,采样频率为10 kHz,低通滤波频率为1 kHz,电容和串联电阻的补偿≥90%,电极电阻约为2~4 mΩ。激活电流刺激程序:先使TRGN细胞破膜后保持在-60 mV的电位,超级化至-80 mV保持70 ms作为预刺激电位,然后从-60 mV开始以10 mV为步阶去极化至+60 mV,间隔2 s,整个时程为50 ms。失活电流刺激程序:将细胞电位钳制在-60 mV,然后给予-80~0 mV、时程为50 ms、步阶10 mV的预刺激,再从预刺激位点去极化至0 mV,间隔4 s,并保持50 ms(图1)。
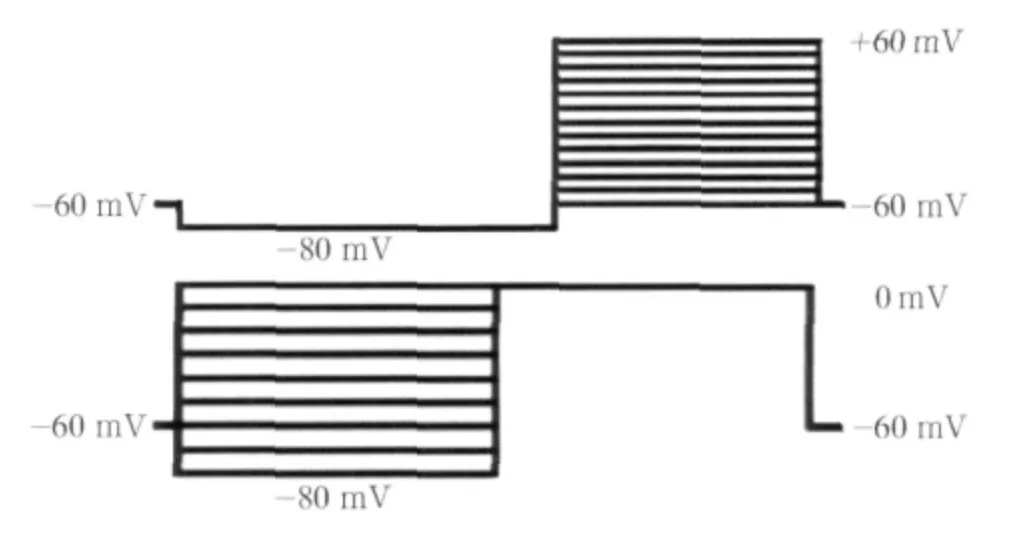
图1 VGSCs电流的刺激程序波形Fig 1 The stimuli waveforms for VGSCs currents
用电流密度来表示全细胞电流强度,即电流密度为电流强度值与各个TRGN全细胞电容值的比值,单位为pA/pF,优点在于统计比较更标准化。对于标准激活和失活曲线的绘制,是根据相应的电流和电压关系,即I-V曲线(current-voltage relationship curve),再按标准步骤绘制形成G-V曲线。实验数据通过Clampfit 10.0(Axon Instruments Inc.,美国)进行图形分析,然后在Origin 7.0(Microcal Software Inc.,美国)软件包内分别使用Boltzmann方程G/Gmax=1/[1+exp(V0.5-Vm)/k]和I/Imax=1/[1+exp(V0.5-Vm)/k]对激活曲线和失活曲线进行拟合,其中Vm为膜电位,V0.5为半激活或激活电位,k为斜率因子。
1.4 统计学分析
所有数据均用均数±标准差表示,在SPSS 17.0软件包中运用单因素方差分析来进行统计分析,P<0.05为差异具有统计学意义。
2 结果
在实验中,一共27个TRGN细胞被纳入记录范围,每组分别为9个细胞;此外选取细胞胞体直径在15~25 μm的TRGN细胞作为研究对象,来检测不同浓度胞内渗透压对VGSCs电生理特性的影响。在电极破膜形成高阻封接后,为了保证电极内液与细胞内液的完全置换,在前5 min内不做任何记录,这主要是因为微电极的体积要远远大于神经细胞体积,因此在经过完全置换后,可以认为电极内液的渗透压约等于细胞内液渗透压。
2.1 不同浓度细胞内液渗透压对VGSCs电流波形和I-V关系的影响
在不同浓度细胞内液渗透压的作用下,典型的VGSCs激活电流和失活电流波形见图2,I-V曲线见图3。这些波形与以往关于VGSCs在TRGN及其他神经的研究有着类似的波形特征[13-14]。低渗组激活电流I-V关系与对照组相比,曲线有一定程度的上移;但高渗组曲线整体变化并不大。
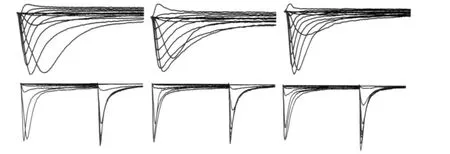
图2 不同浓度渗透压对VGSCs电流波形的影响Fig 2 Effects of osmolality changes on the VGSCs currents
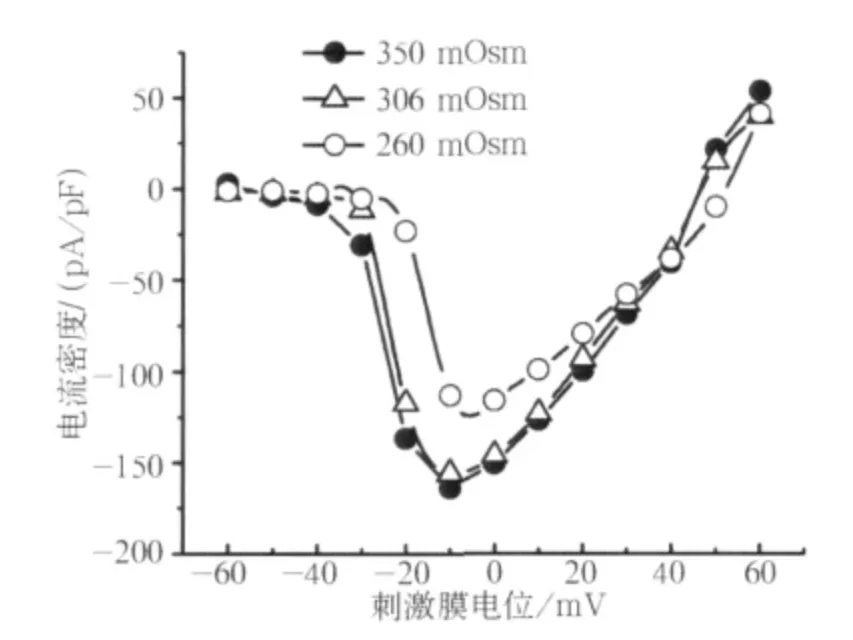
图3 260、306、350 mOsm作用下的典型I-V曲线Fig 3 The typical I-V curves under effects of 260,306,350 mOsm osmolality
2.2 不同浓度细胞内液渗透压对VGSCs激活特性的影响
当膜电位去极化至-30 mV时,高渗组和低渗组开始激活,并且在+30 mV达到最大激活;细胞内低渗透压刺激下,G-V曲线轻微地向去极化方向偏移,但3组之间差异并无统计学意义(图4)。然而,在细胞内高渗透压作用下,激活曲线略向超级化方向偏移(图4)。分析结果显示:3组峰值电流密度以及激活曲线的V0.5值间差异无统计学意义,但是在高渗透压作用下激活曲线的k值与对照组相比差异有统计学意义(P<0.05,表1)。
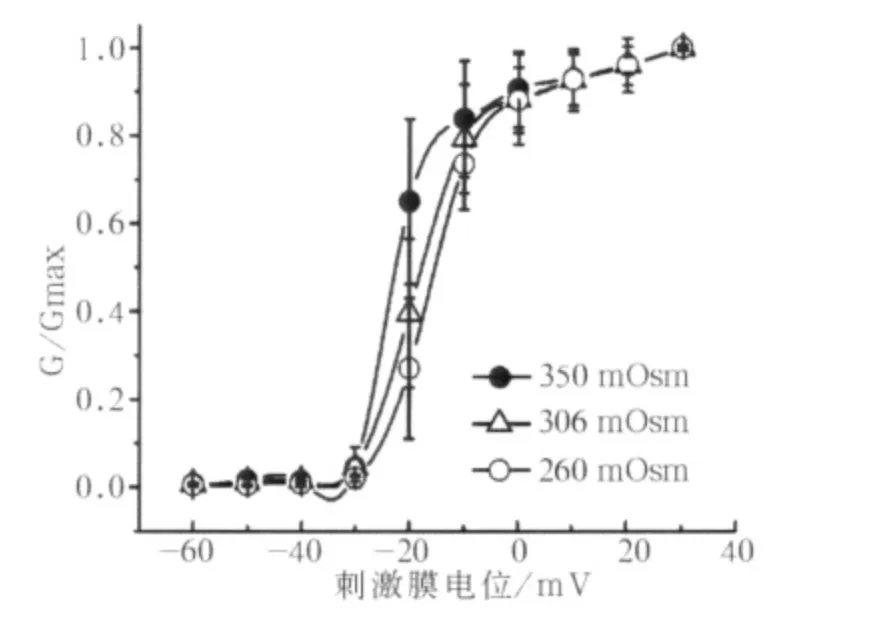
图4 260、306、350 mOsm作用下标准G-V曲线Fig 4 The typical G-V curves under effects of 260,306,350mOsm osmolality
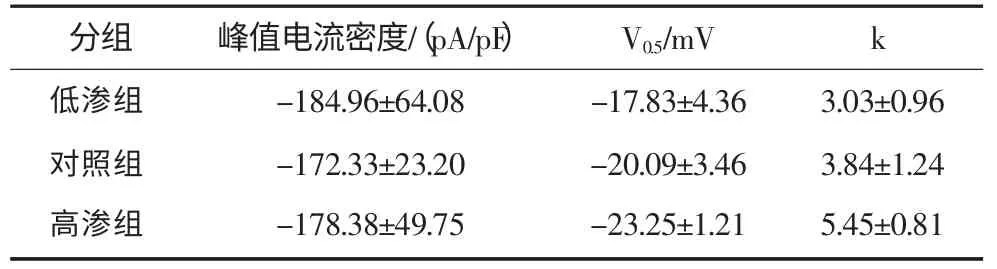
表1 VGSCs激活曲线的拟合结果Tab 1 The fitting results of VGSCs activation curves
2.3 不同浓度细胞内液渗透压对VGSCs失活特性的影响
在260 mOsm渗透压作用下,失活曲线明显地朝向去极化方向移动(图5)。
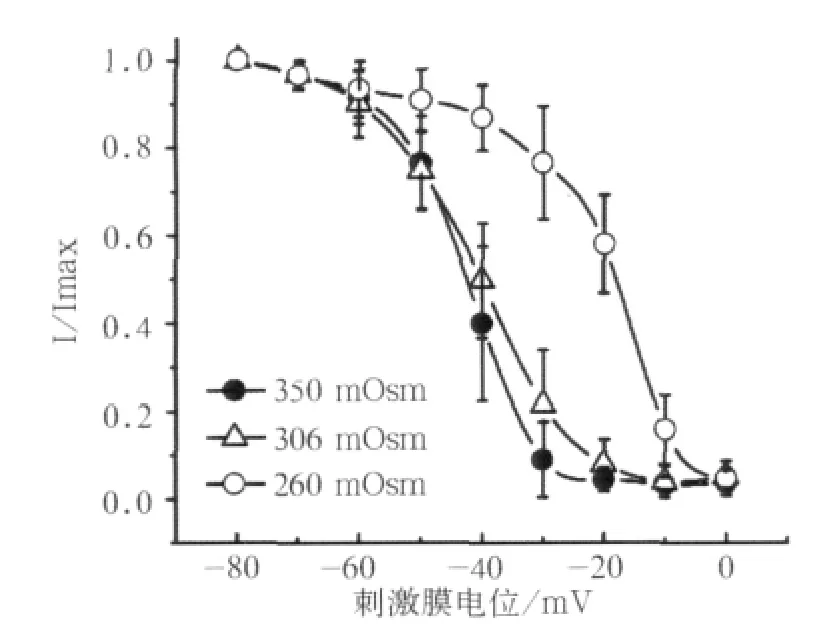
图5 260、306、350 mOsm作用下标准失活曲线Fig 5 The typical inactivation curves under effects of 260,306,350 mOsm osmolality
3组均是当膜电位达到-60 mV时才开始缓慢失活;当膜电位达到0 mV时,低渗组失活达到最大值;而对于对照组和高渗组则是膜电位达到-10 mV时才达到最大失活。
对照组和高渗组、低渗组和高渗组失活速率(最小电流密度/最大电流密度)间差异有统计学意义(P<0.05)。对照组和低渗组失活曲线的V0.5差异有统计学意义(P<0.05);不同浓度细胞内渗透压作用下,失活曲线的k值与对照组间差异有统计学意义(P<0.05,表2)。
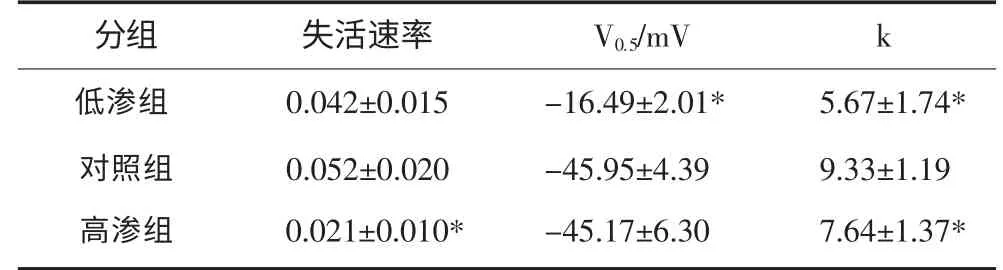
表2 VGSCs失活曲线的拟合结果Tab 2 The fitting results of VGSCs inactivation curves
3 讨论
改变细胞外液渗透压可以对三叉神经细胞上的电压门控离子通道的电生理特性产生一系列影响[7-8]。在Chen等[15]关于TRGN上VGSCs的研究中,在不同浓度细胞外液渗透压作用下,非河豚毒素依赖性(TTXR)钠离子的电流大小可以在一定程度上被抑制;在高渗环境下,电压依赖性的激活和失活曲线都往超级化的方向移动,而在低渗环境下仅仅失活曲线朝向超级化方向偏移。这些现象可能的机制是,细胞外液高渗或低渗刺激可分别通过cAMP依赖性蛋白激酶A或脂质级联信号转导通路的反馈作用方式调节钠离子通道电生理特性[15]。类似的作用在瞬时感受器电位香草酸受体1[16]、VGCCs[5,9,17]及VGPCs[8,18]上也有所体现。
实验结果可见,在低渗刺激下整体失活曲线和最大失活电压都明显地朝着去极化方向偏移,此外用k值来表示的失活速率也有所减小;但是,VGSCs的激活波形以及动力学参数并没有明显的改变。而在高渗环境下,激活曲线和失活曲线都朝着超级化方向移动,这些变化与斜率k值的变化有一定的相关性,但是V0.5的变化并没有统计学意义。考虑到细胞内液低渗刺激类似于细胞外液高渗的作用(反之亦然),在同一程度上的渗透压改变,可以看出由细胞内液渗透压改变给VGSCs电流激活和失活特性所带来影响程度,要大于且广于由Liu等[13]描述的细胞外液渗透压改变所带来的影响。
电压门控离子通道的激活和失活机制如下。电压门控钠离子通道是由一个α亚基和一个或多个β亚基构成的复合体[6],以往的研究揭示了每一个α亚基由4个相似或相同的跨膜结构域(I-IV)构成,四者对称排列形成一个中央离子孔道,而每一个结构域含有6次跨膜螺旋结构(S1-S6),其中S4为电压感受器[19]。Long等[20]研究表明:在KvAP和Kv1.2组成结构中,S3的第二部分(S3b)和S4共同形成了一个螺旋-转角-螺旋结构,即电压感受器桨状构型,该结构对于离子通道的开放具有重要意义。而被α螺旋膜电位感受器所包绕KvAP代表着典型的电压门控离子通道构型[19],因此这一构象也可适用于VGSCs,可以推测当VGSCs被激活后,船桨样结构开始由胞内向胞外移动的同时,S6螺旋发生旋转并向胞外移动,增大了通道孔道的直径,从而通道逐渐开放。VGSCs的失活是一个快速失活过程,其中的机制可能是因为球-链结构[21],在这一结构中离子通道的N端含有系列氨基酸残基,当通道开始失活,这一系列氨基酸促使细胞内孔道逐渐关闭[22-23]。
VGSCs的生理学作用不仅依赖于通道本身的构象变化,而且与细胞的胞膜结构有关。无论是在细胞外液或者细胞内液的渗透压作用下,可能是直接通过调节细胞膜张力,导致位于细胞膜上的离子通道的构架改变,从而使细胞膜上VGSCs电生理特性改变[24]。膜张力的改变主要影响离子通道的跨膜部分,在这一组分中位于VGSCs胞膜脂质双层中间的S4作用明显[25],而Kukita[26]也证明了S4在神经感受外界渗透压环境改变的过程中扮演着重要的角色,这也许是其可能机制之一。在实验中,当细胞内液低渗环境形成之后,随着在压力下细胞本身结构和体积的稳定,神经细胞膜张力逐渐减小,离子通道可能不再发生收缩形变,因此可见在低渗透压条件下,VGSCs的激活特性并没有发生明显改变。但是在细胞内液处于高渗透压的环境中时,随着胞膜张力逐渐增加,VGSCs的S4段可能被拉伸,然后导致激活电流的电生理特性改变。
本实验通过描述改变细胞内渗透压的梯度所带来的变化,进一步明确了VGSCs在维持胞内离子平衡中的重要作用,也为推断三叉神经痛及三叉神经感觉异常的机制打下基础。在口腔修复学领域,作为主要负责口腔颌面部感觉的三叉神经,其与种植体植入的部位密切相关,因此如何选择种植体的植入部位、植入方式,以及如何评估种植所带来的各种影响,就成为口腔种植修复研究一个必不可少的课题,因此对VGSCs的电生理研究,也为此拓展了新的研究方向[27]。在这里应该指出的是,以往关于细胞外液渗透压作用于电压门控离子通道的研究中,通过冲洗的方式可以移除细胞外液高渗或低渗刺激,方式更加客观。而细胞内液的渗透压环境主要由电极内液控制,在全细胞记录过程中进行液体置换不可避免的在一定程度上破坏高阻封接和细胞本身。因此,为了观察通过调节电极内液而改变细胞内液渗透压所带来的后续影响,更为先进的技术应该被运用到全细胞记录过程中。
[1]Bao G.Mechanics of biomolecules[J].J Mech Phys Solids,2002,50(11):2237-2274.
[2]Chen L,Liu C,Liu L.Osmolality-induced tuning of action potentials in trigeminal ganglion neurons[J].Neurosci Lett,2009,452(1):79-83.
[3]Wood JN,Boorman JP,Okuse K,et al.Voltage-gated sodium channels and pain pathways[J].J Neurobiol,2004,61(1):55-71.
[4]Waseem TV,Kolos VA,Lapatsina LP,et al.Hypertonic shrinking but not hypotonic swelling increases sodium concentration in rat brain synaptosomes[J].Brain Res Bull,2007,73(1/3):135-142.
[5]Ben-Tabou De-Leon S,Blotnick E,Nussinovitch I.Effects of osmotic swelling on voltage-gated calcium channel currents in rat anterior pituitary cells[J].Am J Physiol Cell Physiol,2003,285(4):C840-C852.
[6]Catterall WA.From ionic currents to molecular mechanisms:The structure and function of voltage-gated sodium channels[J].Neuron,2000,26(1):13-25.
[7]Piao L,Li HY,Park CK,et al.Mechanosensitivity of voltagegated K+ currents in rat trigeminal ganglion neurons[J].J Neurosci Res,2006,83(7):1373-1380.
[8]Chen L,Liu C,Liu L.The modulation of voltage-gated potassium channels by anisotonicity in trigeminal ganglion neurons[J].Neuroscience,2008,154(2):482-495.
[9]Chen L,Liu C,Liu L.Changes in osmolality modulate voltagegated calcium channels in trigeminal ganglion neurons[J].Brain Res,2008,1208:56-66.
[10]Burton RF.Cell composition as assessed from osmolality and concentrations of sodium,potassium and chloride:Total contributions of other substances to osmolality and charge balance[J].Comp Biochem Physiol A Comp Physiol,1983,76(1):161-165.
[11]Davies SL,Loescher AR,Clayton NM,et al.Changes in sodium channel expression following trigeminal nerve injury[J].Exp Neurol,2006,202(1):207-216.
[12]Priestley T,Hunter JC.Voltage-gated sodium channels as molecular targets for neuropathic pain[J].Drug Dev Res,2006,67(4):360-375.
[13]Liu L,Oortgiesen M,Li L,et al.Capsaicin inhibits activation of voltage-gated sodium currents in capsaicin-sensitive trigeminal ganglion neurons[J].J Neurophysiol,2001,85(2):745-758.
[14]Gu Y,Wang L,Xiao C,et al.Effects of lead on voltage-gated sodium channels in rat hippocampal CA1 neurons[J].Neuroscience,2005,133(3):679-690.
[15]Chen L,Liu C,Liu L,et al.Changes in osmolality modulate voltage-gated sodium channels in trigeminal ganglion neurons[J].Neurosci Res,2009,64(2):199-207.
[16]Verbalis JG.Brain volume regulation in response to changes in osmolality[J].Neuroscience,2010,168(4):862-870.
[17]Ben-Tabou De-Leon S,Ben-Zeev G,Nussinovitch I.Effects of osmotic shrinkage on voltage-gated Ca2+ channel currents in rat anterior pituitary cells[J].Am J Physiol Cell Physiol,2006,290(1):C222-C232.
[18]Macdonald AG.Ion channels under high pressure[J].Comp Biochem Physiol A Mol Integr Physiol,2002,131(3):587-593.
[19]Elinder F,Nilsson J,Arhem P.On the opening of voltage-gated ion channels[J].Physiol Behav,2007,92(1/2):1-7.
[20]Long SB,Campbell EB,Mackinnon R.Crystal structure of a mammalian voltage-dependent Shaker family K+ channel[J].Science,2005,309(5736):897-903.
[21]Aldrich RW,Corey DP,Stevens CF.A reinterpretation of mammalian sodium channel gating based on single channel recording[J].Nature,1983,306(5942):436-441.
[22]Hoshi T,Zagotta WN,Aldrich RW.Biophysical and molecular mechanisms of Shaker potassium channel inactivation[J].Science,1990,250(4980):533-538.
[23]Hughes S,El Haj AJ,Dobson J,et al.The influence of static magnetic fields on mechanosensitive ion channel activity in artificial liposomes[J].Eur Biophys J,2005,34(5):461-468.
[24]Hu H,Sachs F.Stretch-activated ion channels in the heart[J].J Mol Cell Cardiol,1997,29(6):1511-1523.
[25]Männikkö R,Elinder F,Larsson HP.Voltage-sensing mechanism is conserved among ion channels gated by opposite voltages[J].Nature,2002,419(6909):837-841.
[26]Kukita F.Solvent effects on squid sodium channels are attributable to movements of a flexible protein structure in gating currents and to hydration in a pore[J].J Physiol,2000,522(Pt3):357-373.
[27]Hegedus F,Diecidue RJ.Trigeminal nerve injuries after mandibular implant placement—Practical knowledge for clinicians[J].Int J Oral Maxillofac Implants,2006,21(1):111-116.
——2017年渗透压相关高考真题赏析

