Indian Hedgehog在牵张力促进成骨细胞增殖中的作用研究
韩磊 张晓玲 唐国华
(1.南京大学医学院附属口腔医院 口腔正畸科,南京210025;2.中国科学院上海生命科学研究院/上海交通大学医学院健康科学研究所 骨科细胞与分子生物学实验室;3.上海交通大学医学院附属第九人民医院 口腔正畸科,上海市口腔医学重点实验室,上海200011)
牙槽骨和颅颌面骨是应力丰富区,也是成骨细胞活跃区。在外界机械应力刺激下,成骨细胞的增殖分化是骨组织发生适应性改建和骨再生重建的源泉[1]。越来越多的实验证实牵张力是有效促进成骨细胞活性和功能的力学刺激。现有的研究发现:与力学有关的信号包括细胞外调节蛋白激酶-1/2(extracellular regulated protein kinases-1/2,ERK-1/2)信号通路、c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)信号通路、促分裂原活化蛋白激酶(mitogenactivated protein kinases,MAPK)信号通路、钙离子通道、Rho蛋白及相关蛋白激酶(Rho/Rho-associated coiled-coil containing protein kinase,Rho/ROCK)通路、骨形态发生蛋白(bone morphogenetic proteins,BMPs)通路、Hedgehog通道、转化生长因子-β(transforming growth factor-β,TGF-β)通路等。回顾与Hedgehog相关的一些研究,笔者了解到在脊椎动物中,Hedgehog(Hh)蛋白家族至少含有3种成员,分别为Sonic Hedgehog(Shh)、Indian Hedgehog(Ihh)和Dersert Hedgehog(Dhh)[2]。所有的Hh蛋白均可通过自身裂解过程产生一个C末端和功能性N末端结构域,并且裂解的部位相当保守。Ihh与Shh的C末端有明显的区别,而N端结构93%一致,故两者有相似的生物学作用[3]。Hh受体Patched(Ptch)为一类12通道的跨膜蛋白,Hedgehog信号的传导通过Smoothened(Smo,一类G蛋白偶联的多通道膜蛋白)而发挥作用。缺乏Hedgehog蛋白时,Smo与Ptch结合处于抑制状态。当Hedgehog蛋白与Ptch结合后导致Smo释放,活性状态的Smo激活目的基因的转录活性,最终诱导一系列下游信号分子的释放,发挥其调控作用[3-4]。Hedgehog通道抑制剂环巴胺(cyclopamine,cy)是一种植物性甾体类生物碱,主要通过对抗Smo而抑制Hh信号通路[5]。Hedgehog信号参与调节骨的生长发育,其中Ihh对经历软骨内成骨的四肢骨及大部分颅面骨的作用明显。Ihh在软骨细胞和成骨细胞的增殖和分化中起调节作用[3]。进一步研究发现:Ihh在成骨细胞中也有表达[6]。同时研究表明:Ihh是一个机械传导因子,在下颌前导实验中,牵张力会激发下颌髁突增殖层细胞Ihh的表达,进而促进间充质细胞的增殖[7]。基于此,笔者提出假设:Hedgehog信号可能在机械应力介导的成骨细胞增殖中发挥调控作用。因此本实验的研究目的是通过建立成骨细胞体外培养加力模型,研究牵张力下Hedgehog家族中Ihh对成骨细胞增殖的作用,从而探索机械应力对成骨细胞增殖的调控机制。
1 材料和方法
1.1 材料
新生SD大鼠(中国科学院斯莱克动物中心),鼠N端Hedgehog重组蛋白(N-terminus Sonic Hedgehog,N-Shh)(R&D公司,美国),环巴胺(Biomol公司,美国),三氯化钆(GdCl3)、0.25%胰酶、Ⅱ型胶原酶(Sigma公司,美国),α-MEM培养基(Gibco公司,美国),含100 U·mL-1青霉素和100 mg·mL-1链霉素(Invitrogen公司,加拿大)的双抗,甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)(Promega公司,美国),流式细胞仪(BD公司,美国),Flexcell 4000TM加力系统(Flexcell公司,美国)。
1.2 方法
1.2.1 成骨细胞的分离鉴定 取出生不足24 h的新生SD大鼠,在无菌条件下获取颅顶骨,采用次序性酶消化法分离成骨细胞[8-9],加入含10%胎牛血清(fetal bovine serum,FBS)的α-MEM培养基,接种于75 cm2培养瓶,次日吸去残留骨片后隔日换液,细胞80%~90%汇合时传为P1代。
1.2.2 成骨细胞加力 常规细胞复苏,用含10%小牛血清(fetal calf serum,FCS)的α-MEM培养液重悬细胞,隔日换液。当细胞生长达85%汇合时,按照每个培养皿每平方厘米1×105个细胞传代于Flexcell加力板上,细胞种板日标记为0 d;培养24 h后,换无血清的培养液培养24 h,使细胞状态同步化;重新加入10%FCS的α-MEM培养基之后,分别对成骨细胞施加变形率为3%和6%(频率为0.5 Hz、1/2正弦波形)的循环式牵张力,作用时间分别为4、12、24、36、48、60、72 h;对照组成骨细胞未施加循环式牵张力。每个样本有3个复孔。
1.2.3 成骨细胞形态学观察 在3%和6%牵张应变作用24 h后,在加力板内加入固定液,显微镜观察成骨细胞形态。
1.2.4 成骨细胞增殖能力分析 对成骨细胞施加4、12、24、36、48、60、72 h的循环式牵张力,每个样本有3个复孔,加力结束后收样,通过MTT比色法检测细胞的相对数。运用流式细胞仪技术进行细胞周期分析。选择24 h的时间点对成骨细胞进行干预,在成骨细胞接种于Flexcell加力板的第2天分别加入100 ng·mL-1N-Shh和2.5 μmol·L-1cy后同步化处理,在加力前15 min分别加入10 μmol·L-1的GdCl3,加力结束后收样检测细胞相对数和细胞周期。
1.3 统计学分析
采用SAS 8.0软件包对结果进行t检验,每次实验重复3次,数据用±s表示,P<0.05为差异有统计学意义。
2 结果
2.1 成骨细胞鉴定结果
取P2代细胞,培养1周后多数细胞表现为碱性磷酸酶染色阳性;经含β-甘油磷酸钠和抗坏血酸的培养基培养,2周后可形成明显的矿化结节,茜素红染色为鲜红色,证实所获得的成骨细胞具有体外成骨功能。
2.2 成骨细胞形态学观察
成骨细胞受到周期性牵张应变作用后的形态学观察结果见图1。在3%牵张应变作用24 h后,加力板边缘原来呈现短梭形的成骨细胞被拉长,呈成行排列,与受力方向垂直;中间部分细胞仍呈不规则排列,但细胞体积增大。6%牵张应变作用下成骨细胞形态变化与受到3%牵张应变类似。
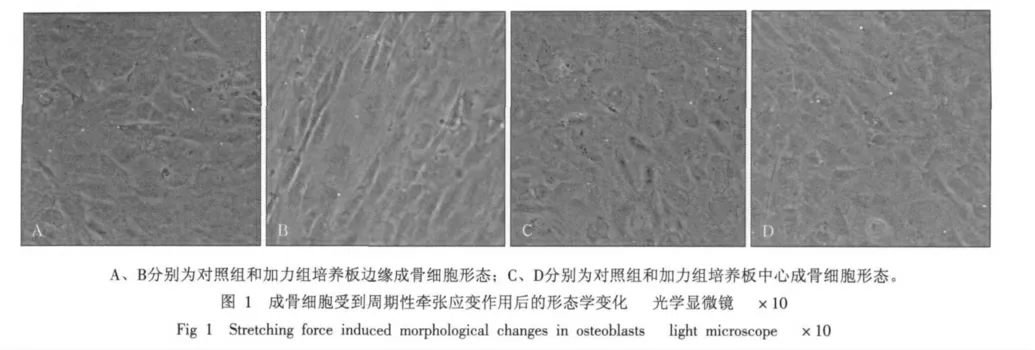
2.3 成骨细胞增殖能力分析
2.3.1 不同大小牵张应变对成骨细胞增殖的影响 细胞计数显示,3%牵张应变作用12、24、36、48 h后,加力组较对照组成骨细胞数目显著增加,二者间差异有统计学意义(P<0.05);而在加力60、72 h后,2组细胞数目间差异无统计学意义(图2)。6%牵张应变下成骨细胞数目的变化趋势与3%类似(图2)。流式细胞仪定量检测显示,3%牵张应变作用下成骨细胞进入S期的比例在加力24和48 h后分别比对照组增加了70%和20%;6%牵张应变作用下成骨细胞进入S期的比例在24和48 h后分别比对照组增加了80%和35%。
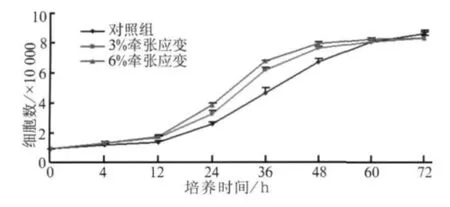
图2 牵张应力对成骨细胞增殖的影响Fig 2 The effect of stretching force on cell proliferation
施加牵张应变24 h后,与3%牵张应变相比,6%牵张应变对成骨细胞增殖的促进作用更明显(图3、4)。当使用GdCl3处理后,3%和6%牵张应变均不能促进成骨细胞的增殖(图3、4)。
2.3.2 Hedgehog在牵张应变促进成骨细胞增殖中的作用 对成骨细胞施加牵张应变24 h,细胞周期检测显示,Hh通道抑制剂cy抑制了6%牵张应变对S期比例的促进作用,使S期比例降低了40%(图5);加入cy后,加力组较cy处理组在S期比例上差异有统计学意义(P<0.05,图5),再加入机械通道抑制剂GdCl3后,更能抑制S期比例(P<0.05,图5)。加入Hh通道增强剂N-Shh后,加力组较对照组S期比例升高(P<0.05,图6)。成骨细胞在受到6%牵张应变后,加入N-Shh组与不加N-Shh组在S期比例上差异无统计学意义(图6)。

图3 牵张应变和GdCl3对成骨细胞数目的影响Fig 3 The effect of stretching force and GdCl3 on cell proliferation of osteoblasts

图4 牵张应变和GdCl3对细胞S期比例的影响Fig 4 The effect of stretching force and GdCl3 on S phase ratio
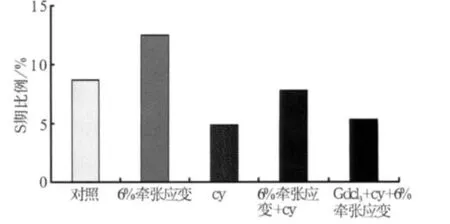
图5 cy和GdCl3对牵张应力下成骨细胞增殖的影响Fig 5 The effects of cy and GdCl3 on the stretch induced proliferation of osteoblasts

图6 N-Shh对牵张应变下成骨细胞增殖的影响Fig 6 The effect of N-Shh on the stretch induced proliferation of osteoblasts
3 讨论
成骨细胞是骨修复、重建过程中重要的功能细胞,具备增殖、分化、分泌骨细胞外基质的能力[10-12]。牵张应变促进成骨细胞增殖的机理仍然不是很清楚。目前发现的与增殖激活有关的基因有c-Myc、c-Fos、c-Jun等[13-16]。先期研究发现:Ihh对软骨内成骨过程中成骨细胞的增殖是必需的。本研究发现:Ihh参与了成骨细胞力学传导和细胞增殖两种过程。作用于成骨细胞的牵张力经过一系列信号传导促进Ihh信号的表达,Ihh信号进一步介导成骨细胞的增殖。
本实验采用的Flexcell 4000TM系统能够将动态的、可控性强的力学信号作用于体外培养的成骨细胞。成骨细胞形态学观察结果提示加力板边缘的成骨细胞受到单轴牵张力,而加力板中央的大部分成骨细胞受到等轴牵张力。Flexcell 4000TM系统所施加的力学信号主要有力值大小、频率、波形、作用时间4个重要的参数。从模拟生理环境的角度,本实验采用了中度变形幅度(3%和6%)、低频(0.5 Hz)间断刺激[10-12]。生理情况下的力通常是由无到最大值一个连续缓慢的变化过程,所以采用1/2正弦波形。在牵张应变作用48 h内,加力组较对照组成骨细胞数目显著增加,而在加力60、72 h后,2组细胞数目差异无统计学意义。这可能与成骨细胞对周期性牵张应力的作用时间(或总周期数)具有“扳机点”效应有关[11]。对成骨增殖周期进行定量检测结果显示:受到牵张应变后,成骨细胞处于S期比例的细胞数目增多,牵张应力能促进成骨细胞的增殖,并且此促进作用主要发生在48 h内,6%牵张应变对成骨细胞刺激较3%牵张应变更明显,因此,在后续实验中,主要选取24 h,6%牵张应变的参数。GdCl3被认为是特异性的机械通道抑制剂[17]。当先使用GdCl3后再施加牵张力,3%和6%牵张应变均不能促进成骨细胞的增殖。这些结果均证实牵张应变能促进成骨细胞增殖。
笔者在前期实验中发现:变形率为6%的牵张应变作用于成骨细胞4、12、24 h后,Hedgehog家族中的Ihh基因表达分别增加了20%、110%和50%,6%的牵张应变较3%牵张应变对Ihh基因表达的促进作用更明显。这提示Hedgehog家族中的Ihh信号对力学刺激敏感。使用GdCl3阻断牵张力通道,GdCl3能完全抑制牵张力对Ihh表达的促进作用。这提示Ihh基因对力学刺激敏感,牵张应变通过成骨细胞膜表面的机械力通道调节Ihh基因的表达。基于上述发现,本实验进一步研究Ihh信号与牵张应变下成骨细胞增殖间的关系。
为了揭示Ihh信号在牵张应变促进成骨细胞增殖中的作用,笔者分别观察了Hh通道增强剂N-Shh、Hh通道抑制剂cy以及机械通道抑制剂GdCl3对牵张应力下成骨细胞增殖的影响。前期实验证实:N-Shh干预成骨细胞后,其数目及处于增殖期(S期)的细胞比例增多[6]。而经过cy处理后的细胞数量和S期细胞数均明显减少。这提示:Hedgehog信号促进成骨细胞的增殖。笔者在实验中发现Hedgehog通道抑制剂cy不但阻断了6%牵张应变对S期比例的促进作用,而且使S期比例降低了40%,这与前期的研究结果一致[6],同时也提示cy对成骨细胞增殖的抑制作用大于牵张力的促进作用。为了进一步研究Ihh是否是牵张应力促进成骨细胞增殖的唯一途径,分别加入cy和(或)GdCl3。加入cy后再施加牵张力仍然能促进细胞的增殖,但这种促进作用能被GdCl3抑制,这提示Ihh并非是牵张应变促进成骨细胞增殖的唯一途径,牵张力还可能通过其他通路或因子促进成骨细胞增殖。
此外,加入Hh通道增强剂N-Shh后,加力组较对照组成骨细胞增殖增加,这也进一步支持了牵张应变促进成骨细胞增殖的传导通道可能涉及众多的通路或因子,而Ihh仅仅是其中之一;Hh通道增强剂N-Shh和力学刺激共同作用也并不比单独力学刺激更能促进成骨细胞增殖。这提示牵张力和N-Shh在促进成骨细胞增殖上并无协同作用。
综上所述,Ihh参与了牵张力对成骨细胞增殖的调节;Hedgehog通路是参与应力对成骨细胞增殖调控的通道之一。对Hedgehog信号的调控,可能成为促进骨形成和骨修复的又一有效途径。
[1]Skerry TM.The response of bone to mechanical loading and disuse:Fundamental principles and influences on osteoblast/osteocyte homeostasis[J].Arch Biochem Biophys,2008,473(2):117-123.
[2]St-Jacques B,Hammerschmidt M,McMahon AP.Indian hedgehog signaling regulates proliferation and differentiation of chondrocytes and is essential for bone formation[J].Genes Dev,1999,13(16):2072-2086.
[3]Jemtland R,Divieti P,Lee K,et al.Hedgehog promotes primary osteoblast differentiation and increases PTHrP mRNA expression and iPTHrP secretion[J].Bone,2003,32(6):611-620.
[4]van den Heuvel M,Ingham PW.Smoothened encodes a receptorlike serpentine protein required for hedgehog signalling[J].Nature,1996,382(6591):547-551.
[5]Incardona JP,Gaffield W,Lange Y,et al.Cyclopamine inhibition of Sonic hedgehog signal transduction is not mediated through effects on cholesterol transport[J].Dev Biol,2000,224(2):440-452.
[6]韩磊,张晓玲,李晅,等.Hedgehog通路对成骨细胞增殖和分化的作用研究[J].上海口腔医学,2009,18(3):287-290.
Han Lei,Zhang Xiaoling,Li Xuan,et al.Hedgehog pathway is associated with the proliferation and differentiation of osteoblasts[J].Shanghai J Stomatol,2009,18(3):287-290.
[7]Tang GH,Rabie AB,Hägg U.Indian hedgehog:A mechanotransduction mediator in condylar cartilage[J].J Dent Res,2004,83(5):434-438.
[8]鄂玲玲,刘洪臣,王东胜.贴壁组织块反复消化法培养新生大鼠下颌骨成骨细胞及鉴定[J].华西口腔医学杂志,2009,27(2):130-134.
E Lingling,Liu Hongchen,Wang Dongsheng.Primary culture and identification of neonatal rat’s mandibular osteoblasts with modified repeating enzymatic digestion-adherent explants method[J].West China J Stomatol,2009,27(2):130-134.
[9]李良,邓力,陈孟诗,等.力学刺激对3月龄骨质疏松大鼠成骨细胞增殖与合成功能的影响[J].生物医学工程学杂志,2004,23(2):341-346.
Li Liang,Deng Li,Chen Mengshi,et al.The effect of mechanical stimulation on the proliferation and synthetic function of osteoblasts from osteoporotic rat[J].J Biomed Eng,2004,23(2):341-346.
[10]Mikuni-Takagaki Y,Suzuki Y,Kawase T,et al.Distinct responses of different populations of bone cells to mechanical stress[J].Endocrinology,1996,137(5):2028-2035.
[11]Jaasma MJ,Jackson WM,Keaveny TM.The effects of morphology,confluency,and phenotype on whole-cell mechanical behavior[J].Ann Biomed Eng,2006,34(5):759-768.
[12]Stanford CM,Morcuende JA,Brand RA.Proliferative and phenotypic responses of bone-like cells to mechanical deformation[J].J Orthop Res,1995,13(5):664-670.
[13]Fournier HN,Dupé-Manet S,Bouvard D,et al.Nuclear translocation of integrin cytoplasmic domain-associated protein 1 stimulates cellular proliferation[J].Mol Biol Cell,2005,16(4):1859-1871.
[14]Shur I,Lokiec F,Bleiberg I,et al.Differential gene expression of cultured human osteoblasts[J].J Cell Biochem,2001,83(4):547-553.
[15]张西正,郭勇,李瑞欣,等.单向交变拉伸应变及压应力对大鼠成骨细胞FOS蛋白表达及细胞定位的影响[J].生物医学工程学杂志,2006,23(2):326-328.
Zhang Xizheng,Guo Yong,Li Ruixin,et al.Influence of stretch strain and pressure on expression of osteoblasts’FOS protein[J].J Biomed Eng,2006,23(2):326-328.
[16]Shevde NK,Bendixen AC,Dienger KM,et al.Estrogens suppress RANK ligand-induced osteoclast differentiation via a stromal cell independent mechanism involving c-Jun repression[J].Proc Natl Acad Sci U S A,2000,97(14):7829-7834.
[17]Wu X,Walker J,Zhang J,et al.Purmorphamine induces osteogenesis by activation of the hedgehog signaling pathway[J].Chem Biol,2004,11(9):1229-1238.

