彩色多普勒超声在乳腺肿块诊断中的应用
罗莉莉,葛艺东,秦 信,耿 峰,赵月雷
乳腺癌是女性最常见的恶性肿瘤之一,死亡率占所有妇女癌症的17%,早期诊断、发现和治疗能显著提高患者生存质量。随着超声诊疗技术不断发展,超声已成为诊断乳腺疾病重要方法之一。本文回顾性分析我院56 例乳腺肿块患者二维及彩色多普勒特点,并将超声诊断结果与病理结果对照,确定超声对乳腺肿块的诊断价值。
1 资料与方法
1.1 资料 本组56 例为2010年2月~2011年11月以乳房肿块或乳房疼痛来我院就诊,行二维及彩色多普勒检查的患者。年龄17~65 岁,平均年龄39.2 岁。肿块大小约为0.8~5.3 cm,平均2.2cm。所有患者均经手术或穿刺活检后病理诊断确诊。
1.2 方法 仪器:采用GE-Voluson730 彩色多普勒超声诊断仪,探头频率为10~12 MHz。脉冲多普勒取样容积为1.5~2.0 mm,壁滤波≤50 Hz,调整声束—血流夹角θ<60°。检查方法:受检者平卧位,两手上举置于头侧枕上,充分暴露腋窝部和双侧乳腺。首先行乳腺超声检查,以乳头为中心做放射状扫查,发现病灶后从多切面观察,观察测量其部位、大小、形态、边界、有无包膜、内部回声、有无钙化、有无高回声晕,有无后方声衰减及侧方声影,同时检查双侧腋窝淋巴结情况,有无转移,转移淋巴结数目。而后在获得较好的二维图像基础上,叠加彩色多普勒,着重观察肿瘤内及周边的血流分布情况。根据肿块内彩色血流信号的大小和数量,将肿块内血流信号的丰富程度按Adler 方法分成四个等级:0 级为肿块内未发现血流信号;I 级为少量血流信号,可见1~2 个点状或细短棒状血流信号;Ⅱ级为中量血流信号,可见3~4 个点状或一个较长的血管,其长度可接近或超过肿块半径;Ⅲ级为多量血流信号,可见5 个以上点状血管或2 个较长的血管。对评价Ⅱ级和Ⅲ级乳腺包块检测血流阻力指数等血流动力学参数,重复3 次,取其平均值。
1.3 统计学方法 采用SPSS12.0 统计分析软件,两样本之间均数的比较采用t 检验,计数资料比较采用χ2检验。
2 结果
2.1 超声诊断与病理诊断比较 本组56 例乳腺超声检查出肿块的患者病理诊断结果,浸润癌4 例,乳腺导管癌7 例,髓样癌1 例,单纯癌2 例,纤维腺瘤30 例,乳腺囊肿8 例,导管内乳头状瘤1 例,炎性肿块3 例。2 例单纯癌均误诊为良性肿块,经与术后病理结果比较,良性肿块诊断符合率为95.5%(42/44),恶性肿块诊断符合率为85.7%(12/14)。
2.2 良恶性肿块二维声像图及彩色多普勒特征的比较 本组56 例乳腺肿块二维超声声像图表现见表1;乳腺肿块彩色多普勒血流丰富程度比较见表2;乳腺肿块多普勒血流参数见表3。

表1 乳腺肿块二维超声声像图表现(n=56)
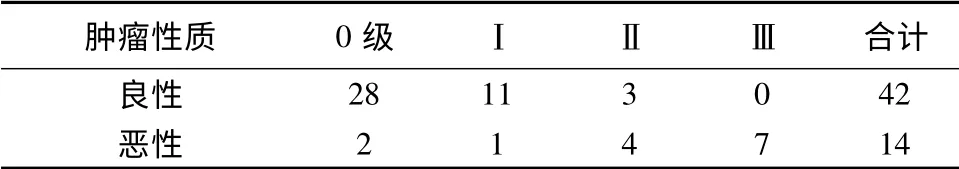
表2 乳腺肿块彩色多普勒血流丰富程度比较(n=56)
表3 乳腺肿块多普勒血流参数比较(±s,n=56)

表3 乳腺肿块多普勒血流参数比较(±s,n=56)
肿瘤性质例数PSV(cm/s)RI良性448.94 ±4.540.63 ±0.10恶性1216.70 ±8.580.88 ±0.14 P 值>0.05<0.05
结果显示,良性肿块:形态规则,多为类圆形或椭圆形,纵横比多小于1,边界清晰,部分可有包膜或假包膜,内部回声大多均匀,后方无声衰减,部分后方回声稍增强,偶有钙化,钙化直径多≥3 mm(图1)。恶性肿块:形态不规则,部分呈“蟹足样”改变,纵横比大多≥1,边界模糊不清,无明显包膜,部分可有强回声晕征,边缘毛刺状,内回声不均质,部分可见微小钙化,钙化形态多呈针尖样(图2);部分肿块后方有声衰减。本组病例中良性肿块组微小钙化显示率为23.8%(10/42),恶性肿为71.43%(10/14)。
14 例乳腺癌患者彩色多普勒检测在肿块周围及内部检出丰富的血流信号约10 例,占总数的71.4%(图3),均为高速、高阻动脉样血流频谱(图4)。2 例周边未探及血流信号的乳腺癌最大径线均<2 cm。39 例良性肿块内部未探及血流信号,占总数的92.8%,与恶性肿块的比较,差异有统计学意义(P<0.01)。
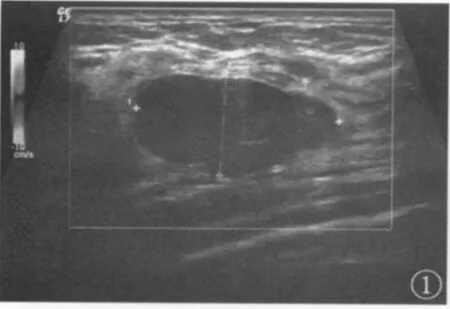
图1 乳腺纤维腺瘤
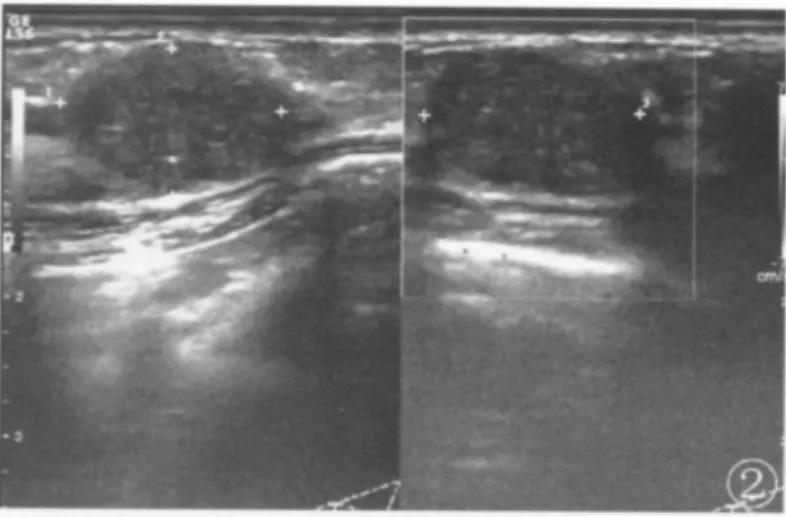
图2 浸润性导管癌(沙粒样钙化)
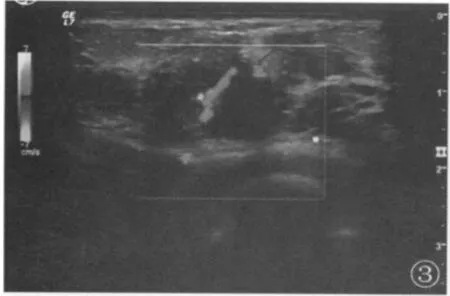
图3 浸润性导管癌(血流丰富型)
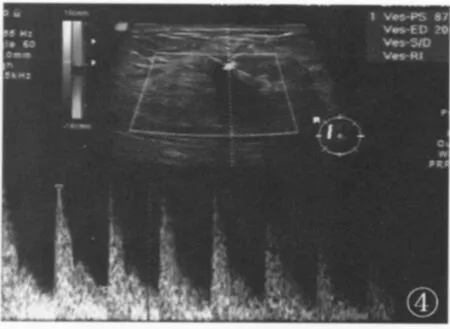
图4 浸润性导管癌(高阻力指数)
此外,良性肿块双侧腋窝有淋巴结的有10 例,占22.7%。超声表现:形态规则,包膜完整,皮髓比例正常,淋巴门显示清晰,彩色多普勒显示可见星点状血流信号。恶性肿瘤伴淋巴结转移有4 例,占28.6%。超声表现:淋巴结形态较饱满,髓质多消失,晚期呈片状融合,同时彩色多普勒显示血流信号较丰富。
3 讨论
美国每年大约有50 万女性因乳腺癌转移播散而致死[1],居妇女各类恶性肿瘤死亡率第2 位,近年来发病率呈年轻化趋势。研究表明,Ⅰ期乳腺癌5年生存率是97%;Ⅱ期乳腺癌是75.9%;Ⅲ期仅为45%[2]。目前乳腺肿块的良、恶性诊断一直是影像工作者的研究重点,传统乳腺癌多采用钼靶检查,但钼靶X 线摄影对软组织的分辨率较差,尤其是对致密型乳腺,因而在观察病变组织结构方面逊于超声显像。亚洲人乳腺癌大部分发生在绝经前,乳腺组织致密,钼靶摄影显像欠佳,而超声是一种无创、安全的检查手段,可连续观察,能反映肿块内部结构,能观察到肿块与周围组织的关系。近年来随着超声诊疗技术的发展,越来越多临床上触诊不清的病变被发现,其中25%~40%是乳腺癌[3],超声已成为诊断乳腺疾病的首选方法之一。二维超声结合彩色多普勒技术对乳腺肿块的诊断仍然是最主要的诊断方法。钱孝纲等[4-5]的资料分析采用CDFI 多项联合指标诊断乳腺癌的敏感性为90%,特异性达97.41%,准确性为95.18%。在本组临床资料研究中,笔者认为二维声像图上对乳腺良恶性肿瘤鉴别诊断特异性较强的指标为肿块的纵横比以及肿块的细小点状钙化。本组资料中恶性肿瘤的纵横比多大于1,与相关文献报道相符[6]。乳腺恶性肿瘤的微小钙化属于营养不良性钙化,是恶性肿瘤组织变性坏死和钙盐沉着所致,有文献报道微小钙化作为诊断乳癌的指标,特异性为 96.3%,准确性为84.8%,此种钙化甚至可以提示早期不可触及的乳腺癌的诊断[7]。
在乳腺肿块的彩色多普勒研究方面,国内外学者主要集中在肿块内的血流特征:如肿瘤血管丰富情况、肿瘤血管分布形态特征及肿瘤血管的血流动力学参数测定。乳腺癌在生长过程中伴有肿瘤血管生成,其血管数目及血供相对丰富,此特点对良恶性肿瘤鉴别具有一定价值。Chao 等[8]报道以RI≥0.7 为诊断恶性病变标准,其敏感度可达85%。Cosgrove 等[9]对21 例乳腺癌应用CDFI 检查,发现13 个病灶探及高速高阻血流。本组研究患者乳腺癌血管检出率略低于文献报道,考虑主要原因是肿瘤太小,如乳腺导管癌,直径均小于10 mm,CDFI 无法检测到血流信号。
在本组资料中,良恶性肿块伴有双侧腋窝淋巴结所占的比例无明显差异,但是两者之间在超声图像上的表现存在较明显差异。良性肿块的腋窝淋巴结多表现为形态规则,包膜完整,皮髓比例正常,淋巴门显示清晰,彩色多普勒显示可见星点状血流信号。恶性肿瘤转移淋巴结形态较饱满,髓质多消失,整个淋巴结呈弱回声,晚期呈片状融合,同时彩色多普勒显示血流信号较丰富。因此腋窝淋巴结声像图特征有利于乳腺肿块良恶性鉴别诊断。
综上所述,超声是早期发现乳腺肿块并对乳腺肿块良恶性鉴别的良好方法,同时超声也具有无创、操作简便、可重复性好等优点,应提倡为临床和普查乳腺疾病的首选方法。
[1]Greenlee RT,Hill-Harmon MB,Murray T,et al.Cancer statistic[J].2001.CA Cancer J Clin,2001,51:15-36.
[2]Chapman C,Murray A,Chakrabarti J,et al.Autoantibodies in breast cancer:their use as an aid to early diagnosis[J].Ann Oncol,2007,18(5):868-873.
[3]American College of Radiology(ACR):Breast imaging reporting and data system(BIRADS)[M].4th ed.Reston,Va:American College of Radiology,2003:94.
[4]钱孝纲,叶 萍,刘 娴,等.高频彩色多普勒超声在乳腺良恶性肿瘤鉴别诊断中的临床价值[J].中华医学超声杂志,2005,2(5):268-270.
[5]姜燕茹,钱晓芹.彩超对乳腺肿瘤血流频谱及形态学的分析[J].临床超声医学杂志,2006,8(2):79-82.
[6]Stavros AT,Thickman D,Rapp CL,et al.Solid breast nodules:use of sonography to distinguish between benign and malignant lesions[J].Radiology,1995,196(1):123-134.
[7]Singletary SE,Fornage BD,Sneige N,et al.Radiofrequency ablation of early-stage invasive breast tumors:an overview[J].Cancer J,2002,8(2):177-180.
[8]Chao TC,Luo YF,Chen SC,et al.Color Doppler ultrasound in breast carcinomas:relationship with hormone receptors,DNA ploidy,Sphase fraction,and histopathology[J].Ultrasound Med Biol,2001,27(3):351-355.
[9]Cosgrove DO,Bamber JC,Davey JB,et al.Color Doppler signals from breast tumors[J].Radiology,1990,176(1):175-180.

