盐酸头孢吡肟(含精氨酸)内毒素动态浊度法方法的确立
周晓华 许 苑
1.苏州大冢制药有限公司,江苏苏州215025;2.卫材中国药业有限公司,江苏苏州215021
细菌内毒素检查法主要有凝胶法和光度法,前者进行限度检查和半定量检测,后者则可以进行定量检测。光度法包括浊度法和显色基质法。浊度法系利用检测鲎试剂与内毒素反应过程中的浊度变化而测定内毒素含量的方法。浊度法分为动态浊度法和终点浊度法。动态浊度法是检测反应混合物的浊度到达某一预先设定的吸光度所需要的反应时间,或是检测浊度增加速度的方法。目前国内内毒素检测,采用凝胶法的较为普遍,而用光度法建立测试方法的不是太多。本研究旨在通过方法学验证,确定盐酸头孢吡肟(含精氨酸)内毒素动态浊度法的检测方法[1]。
1 材料与方法
1.1 检测仪器
日本和光内毒素试验仪、型号ET-5000。
1.2 检测试剂和标准品
鲎试剂——湛江安度斯(批号:0909182,灵敏度10~0.01 EU/mL)。内毒素试验用水:灭菌注射用水(山东齐都药业有限公司,批号ID09122807);内毒素标准品:中检院150601-200966[2];试验样品:盐酸头孢吡肟(含精氨酸)(意大利DOBFAR,批号:(1)440253 00019;(2)440253 00029;(3)440253 00039)。
1.3 方法
1.3.1 内毒素标准溶液制备 用内毒素标准品制成0.015 63、 0.031 25、0.625 00、0.125 00、0.250 00 EU/mL的标准溶液。
1.3.2 供试溶液制备 将头孢吡肟制成浓度为0.65 mg/mL的溶液进行测定。
1.3.3 浊度法的试验方法 浊度法系利用检测鲎试剂与内毒素反应过程中的浊度变化而测定内毒素含量的方法。本次验证的动态浊度法是检测反应混合物的浊度到达某一预先设定的吸光度所需要的反应时间的方法。测定试验在内毒素试验仪和光ET-5000中进行,温度为(37±1)℃,测定时间为90 min(反应时间也可以设置为60 min)[3]。
1.3.4 标准曲线的建立方法 (1)当使用新批号的鲎试剂或试验条件发生了任何可能会影响检验结果的改变时需进行标准曲线的可靠性试验。(2)用标准内毒素配成溶液,并制成至少3个浓度的稀释液(相邻浓度间稀释倍数不得>10),最低浓度不得低于所用鲎试剂的标示检测限。每一浓度至少做3支平行管。同时做3支阴性对照。当阴性对照的反应时间大于标准曲线最低浓度的反应时间,将全部数据进行线性回归分析。(3)标准曲线的计算方法:将浓度与反应时间分别取对数后,将两组数据用最小二乘法统计就能够拟合出直线——标准曲线。见图1。

图1 标准曲线的计算方法
1.3.5 干扰试验 供试品的最小有效稀释浓度c=λ/L,其中λ=0.015 6 EU/mL,L=0.024 EU/mg,供试品最小有效稀释浓度为0.65 mg/mL。称取头孢吡肟样品,稀释成0.65 mg/mL,作为供试品溶液。
选择标准曲线中点或一个靠近中点的内毒素浓度(设为λm),作为供试品干扰试验中添加的内毒素浓度。制备溶液A、B、C和D。其中A为稀释倍数不超过MVD的供试品溶液。B为加入了标准曲线中点或靠近中点的一个已知内毒素浓度的,且与溶液A有相同稀释倍数的供试品溶液。C为如“标准曲线的可靠性试验”项下描述的,用于制备标准曲线的标准内毒素溶液。D为阴性对照[4]。见表1。
按所得线性回归方程分别计算出供试品溶液和含标准内毒素的供试品溶液的内毒素含量Ct和Cs,再按下式计算该试验条件下的回收率(R)。
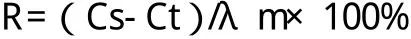
当内毒素的回收率在50%~200%之间,则认为在此试验条件下供试品溶液不存在干扰作用。当内毒素的回收率不在指定的范围内,可通过对供试品进行更大倍数的稀释或通过其他适宜的方法(如过滤、中和、透析或加热处理等)排除干扰。见表2。当鲎试剂、供试品的来源、配方、生产工艺改变或试验环境中发生了任何有可能影响试验结果的变化时,须重新进行干扰试验。1.3.6 判定标准 标准曲线的相关系数(r)的绝对值应≥0.980;用溶液B中的内毒素浓度减去溶液A中的内毒素浓度后,计算出的内毒素的回收率要在50%~200%的范围内;阴性对照的反应时间大于标准曲线最低浓度的反应时间。

表1 标准曲线各浓度的制备方法和制备个数

表2 标准曲线的可靠性试验记录

表3 干扰试验记录
2 结果
2.1 标准曲线的可靠性试验记录
5个浓度的标准溶液与反应时间分别取对数后制成的标准曲线,其相关系数在0.980以上,符合要求。见表2。
2.2 干扰试验记录
3个批次的头孢吡肟样品,其回收率都在50%~200%之间,符合要求。见表3。
3 讨论
从盐酸头孢吡肟(含精氨酸)在浓度为0.65 mg/mL时进行内毒素动态浊度法测试的数据来看,回收率都在50%~200%范围内,标准曲线的相关系数在0.980以上,且阴性对照的反应时间大于标准曲线最低浓度的反应时间。证明该方法具有较高的灵敏度和准确度,可以准确定量。
[1] 中华人民共和国药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:附录99-102.
[2] 国家食品药品监督管理局药品认证管理中心.药品GMP指南[M].北京:中国医药科技出版社,2011:209-258.
[3] 日本药局方编辑委员会.第十六改正日本药局方解说书[M].东京:广川书店,2011:附录B429-448.
[4] 美国药典委员会.美国药典[M].USP34-NF29,美国药典委员会,2011:78-81.

