重组人角质细胞生长因子在毕赤酵母中的表达、纯化及活性测定*
冯成利, 项 琪, 张齐好, 杨 艳, 柯 实, 黄亚东,, 苏志坚,△
(1陕西省动物研究所,陕西西安710032;暨南大学2广东省生物工程药物重点实验室,3基因工程药物国家工程研究中心,广东广州510632)
人角质细胞生长因子(human keratinocyte growth factor,hKGF)属于成纤维细胞生长因子(fibroblast growth factors,FGFs)超家族,是一种具有刺激胚胎发育、促进上皮细胞增殖和迁移及调节机体免疫等重要生物学功能的细胞生长因子[1-2]。hKGF由间质细胞所产生,以旁分泌方式特异性作用于上皮细胞[3]。与其它能与肝素结合的成纤维细胞生长因子不同的是,hKGF对成纤维细胞、内皮细胞及黑色素细胞没有促增殖作用[2-3]。大量的研究表明,hKGF是FGFs家族中对皮肤角质形成细胞最有效的促细胞分裂因子,其通过刺激伤口重新上皮化、增厚表皮及激活蛋白激酶B(protein kinase B,PKB)信号通道抑制细胞凋亡来预防和修复[4]。因此,现时hKGF已广泛应用于角膜损伤修复和皮肤创伤愈合,并在肺损伤修复、胃肠道修复、构建人工皮肤和辐射防护等方面具有潜在临床应用前景[5-6]。鉴于hKGF在临床应用上的多用途和重要性,因此利用基因工程方法大量制备,不仅有利于深入研究它的生物学功能,还能满足其在临床中的需要。到目前为止,科研人员已经利用大肠杆菌、植物及哺乳动物细胞中表达hKGF,但低表达量、没有充分糖基化或生产成本高昂使得hKGF规模化生产难以实现[7-11]。本研究以酵母表达偏好的密码子为基础,设计并合成编码hKGF成熟肽的DNA序列,构建重组表达载体,转化入毕赤酵母中表达并优化宿主高密度发酵条件,高效表达具糖基化修饰的重组hKGF。
1 材料
1.1 菌株与质粒 分泌型表达载体pPICZαA购自Invitrogen,Pichia pastoris菌株X-33和大肠杆菌TOP10F'菌株均为本实验室保存。
1.2 酶和试剂 各种限制性内切酶(SacⅠ、XhoⅠ和XbaⅠ)、T4 DNA连接酶及高保真Taq DNA聚合酶购自大连宝生物工程有限公司;DNA胶回收试剂盒、PCR片段纯化试剂盒及质粒小量抽提试剂盒购自上海申能博彩生物工程有限公司;hKGF抗体购自Abcam(Cat:ab9598);离子交换层析凝胶和肝素亲和层析凝胶购自安玛西亚公司;恒河猴肺上皮细胞株4MBr-5购自美国组织培养库(American Tissue Culture ColLection,ATCC;Cat:CCL-208);hKGF标准品购自Sigma-Aldrich(Cat:H6666)。用于扩增的PCR引物由上海生工生物工程有限公司合成;其余常用试剂均为市售国产分析纯产品。
2 方法
2.1 重组表达质粒的构建及鉴定 从美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中获得hKGF核苷酸序列(No.NM_002009),然后利用Lasergene PrimerSelect 7.1(DNAStar Inc.),按照毕赤酵母偏好密码子设计出14条引物,见表1。通过PCR搭桥方法(图1),最终获得编码全长hKGF蛋白的DNA片段[12]。将该片段克隆至分泌表达载体pPICZαA中,获得重组质粒pPICZαA-hKGF。将重组质粒转化感受态大肠杆菌TOP10F'中,25 mg/L Zeocin(Invitrogen;Cat:R250-01)抗性平板筛选阳性转化子。挑选重组子接种到新鲜Luria-Bertani(LB)培养基中振荡培养14~16 h后,离心收集菌体并抽提质粒,酶切鉴定后送上海生工生物工程有限公司进行测序。
材料和方法

表1 用于人工合成编码hKGF的PCR引物Table 1 .PCR primers used to construct the synthetic hKGF gene
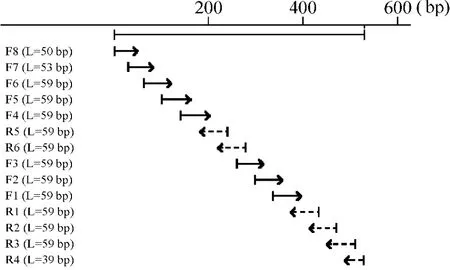
Figure 1.PCR strategy for synthesis of DNA encoding hKGF.F and R mean forward and reverse primer pairs,respectively.L means the length of PCR primer.图1 编码hKGF DNA片段的PCR人工合成策略
2.2 酵母转化和重组子的筛选 提取10 μg经测序正确的pPICZαA-hKGF重组质粒,用SacⅠ进行单酶切后回收。然后,按说明书规程将酵母菌X-33制成感受态菌,在25 μF、1.5 kV、400 Ω条件下电转化。转化产物涂布在终浓度为100 mg/L Zeocin抗性、含山梨醇的酵母浸出蛋白胨葡萄糖培养基(yeast extract peptone dextrose medium containing sorbitol,YPDS)琼脂平板上,30℃倒置培养2~3 d。挑取单菌落,接种到新鲜酵母浸出蛋白胨葡萄糖(yeast extract peptone dextrose,YPD)培养基中,振荡培养24 h,然后13 500×g离心收集菌体,并用引物F8和R4进行菌落PCR鉴定,筛选出整合有目的基因的重组子。将重组子接种到培养基中并按说明书制成感受态,然后按上述方法反复电转重组质粒,高抗性Zeocin (1 g/L)筛选重组子,从而获得含高拷贝目的基因的重组表达菌株。
2.3 表达菌株的筛选和诱导表达 挑取上述经鉴定的重组转化子,分别接种到5 mL YPD培养基中,30℃振荡培养至A600=4~6。然后按5%的比例转接到10 mL复合甘油缓冲液体培养基(buffered glycerol-complex medium,BMGY)中,于30℃、250 r/min培养16~24 h。在无菌条件下,6 000×g离心10 min收集菌体,弃上清,加入10 mL复合甲醇缓冲液体培养基(buffered methanol-complex medium,BMMY)诱导培养基重悬菌体,250 r/min培养60 h。每20 h取样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)并用薄层凝胶扫描分析。
2.4 重组表达菌高密度发酵 将筛选出来的重组子接种于5 mL YPD培养基中,30℃振荡培养16~18 h,然后按2%比例接种至200 mL BMGY中,30℃、220 r/min培养至A600= 4~6后,再按10%比例转接到2 L无机盐发酵培养基中[9]。发酵罐发酵参数设定为:溶氧含量为20%~50%,pH 6.0,通气量10 L/min,温度为28℃。在基础盐培养基中培养18~22 h后按照12.5 mL·h-1·L-1速度流加50%甘油溶液8 h,然后以6 mL·h-1·L-1速度流加1 h,再按3 mL·h-1·L-1速度流加1 h后,饥饿培养0.5 h。在调整流加甘油溶液的2 h内,同时逐步调整发酵温度至20℃。待溶氧指数稳定后,开始流加100%甲醇进行诱导,流速设定为1~12 mL·h-1· L-1,诱导时间为60 h,期间同时流加10%葡萄糖溶液及5%磷酸铵溶液,直至发酵结束。离心收集发酵上清并用12% SDS-PAGE凝胶电泳检测。
2.5 重组蛋白的分离纯化 将发酵液在4℃、13 500×g离心20 min,收集上清,然后用截留分子量为5 kD的超滤膜包(Millipore;Cat:U650600)进行浓缩,同时加入0.02 mol/L磷酸缓冲液(phosphate buffer,PB,pH 7.4)调整pH至7.4。用肝素交换层析凝胶装填层析柱,用5倍柱床体积含0.05 mol/L NaCl及0.02 mol/L PB(pH 7.4)的结合缓冲液以流速8 cm/h平衡。将浓缩后的发酵液以6 cm/h速度上样,然后用大量的结合缓冲液洗柱。最后,分别用含0.3 mol/L NaCl、0.6 mol/L NaCl、1.0 mol/L NaCl和2.0 mol/L NaCl的0.02 mol/L PB(pH 7.4)进行洗脱。收集洗脱液并进行SDS-PAGE凝胶电泳检测。
2.6 重组hKGF活性测定 用含10%胎牛血清的Ham's F-12K培养基(Sigma-Adlrich;Cat:N6908)培养4MBr-5细胞至对数生长期,然后用0.25%(W/V)的胰蛋白酶溶液消化并计数,按每孔7 000个细胞加入到96孔细胞培养板中,于37℃、5%CO2环境中培养24 h后,换入含2%血清的新鲜培养基继续培养16 h。用培养基将纯化后的重组蛋白及商品化hKGF进行系列稀释后,加入到细胞培养板中(100 μL/ well)培养48 h。培养结束后,加入20 μL MTT(5 g/L)溶液,37℃、5%CO2培养4 h。弃上清,加入二甲基亚砜100 μL,室温放置30 min后,用酶联免疫比色仪测定其吸光度,测定波长为570 nm,对照波长为630 nm。
结果
1 重组hKGF基因序列的改造及合成
按照毕赤酵母偏好密码子合成14条引物(表1),采用PCR搭桥方法(图1),获得长度约为530 bp编码hKGF蛋白的DNA片段,见图2。将该片段克隆至毕赤酵母分泌型表达载体pPICZαA中,获得重组表达质粒pPICZαA-hKGF。Xba I和Xho I双酶切重组质粒结果表明,合成编码hKGF的DNA片段大小与预期的一致,见图3。此外,测序结果也表明hKGF序列与预期是一致的(结果未显示)。
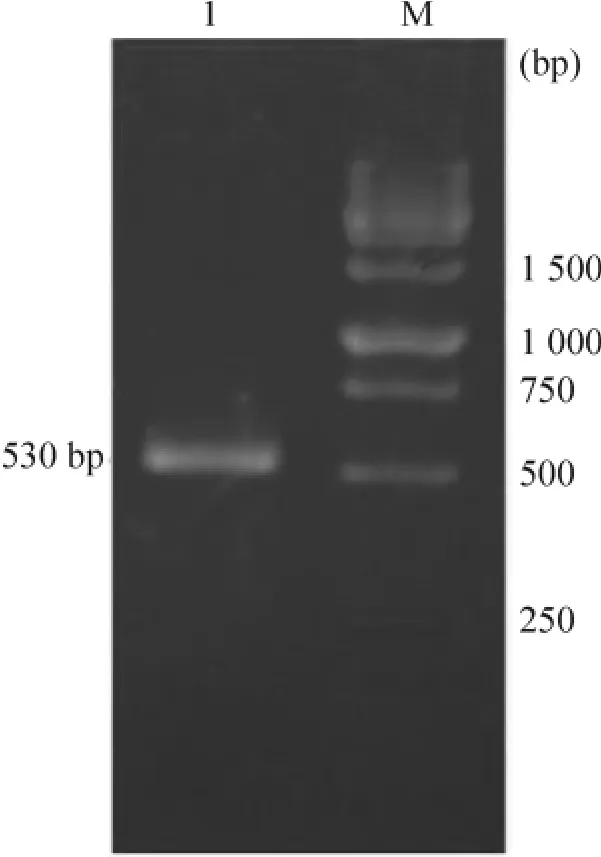
Figure 2.Electrophoresis analysis of the final PCR product.Lane 1:PCR product;M:DNA marker.图2 PCR扩增终产物的琼脂糖凝胶电泳分析
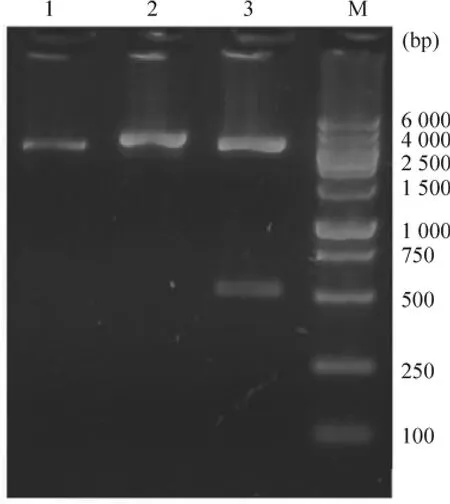
Figure 3.Recombinant plasmids digested by restricted endonucleases.Lane 1:XhoⅠ;Lane 2:Xba I;Lane 3:XhoⅠand XbaⅠ;M:DNA marker.图3 限制性内切酶消化重组质粒的琼脂糖凝胶电泳分析
2 重组酵母的获得和鉴定
通过电击法将线性化的pPICZαA-hKGF转化入宿主菌X-33中,经抗生素梯度筛选后获得高抗性表达株,挑取单克隆并振荡培养过夜。离心收集菌体,提取酵母基因组DNA,以F8和R4作为引物进行PCR鉴定,电泳结果表明,重组表达载体pPICZαA-hKGF成功整合入酵母基因组中,见图4。
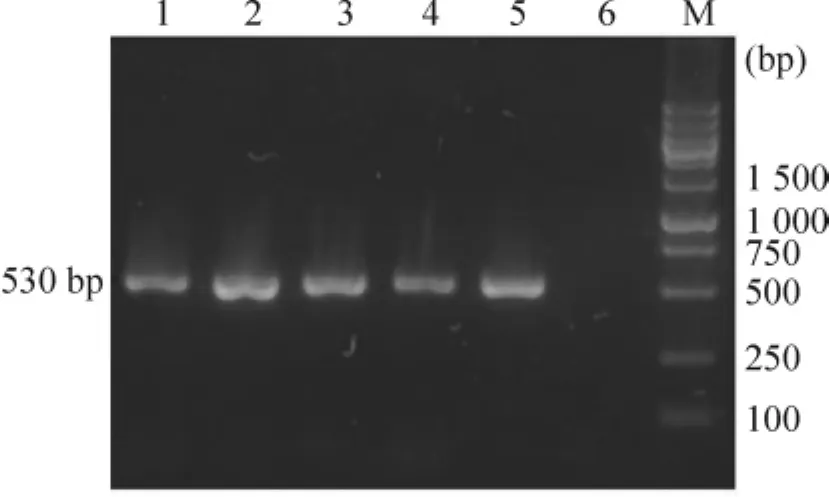
Figure 4.Identification of transformants by PCR.Lane 1~5:transformants;Lane 6:control strain;M:DNA marker.图4 PCR方法鉴定重组转化子
3 重组hKGF在酵母中的表达
重组酵母经摇瓶发酵60 h后,取上清液进行 SDSPAGE凝胶电泳,结果显示,重组菌能表达分子量约为28 kD的hKGF,与预期一致,而表达量约占上清总蛋白量的8%左右。通过优化条件后进行高密度发酵,结果表明,随着诱导时间的延长,重组蛋白的表达量也不断增加,发酵结束时,hKFG的表达量约占上清总蛋白量的14.1%,见图5、6。
4 重组hKGF的分离纯化
发酵液经超滤、肝素亲和层析及分子筛Sephardex G-25分离纯化后,收集洗脱液并进行SDS-PAGE电泳及薄层凝胶扫描分析。银染结果显示,重组蛋白的纯度达到95.0%以上,见图7,且能与hKGF单克隆抗体产生阳性反应,见图8。此外,重组蛋白还通过高效液相色谱及氨基酸N端测序鉴定其准确性,表明其与天然蛋白序列一致(资料未显示)。hKGF分离纯化的步骤以及得率如表2所示。
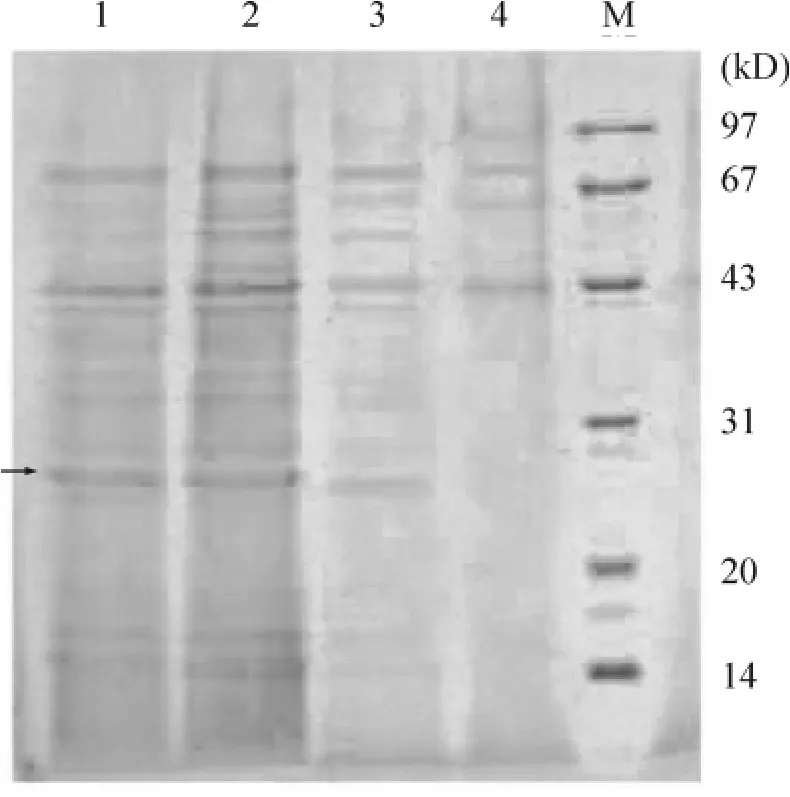
Figure 5.SDS-PAGE analysis of the expression of secretory recombinant hKGF.Lane 1~4:four individual transformants;M:protein marker.The arrow indicates hKGF (28kD).图5 重组hKGF的SDS-PAGE分析

Figure 6.SDS-PAGE analysis of recombinant hKGF expression in P.pastoris after fermentation.Recombinant yeast was grown in a high-density fermentor and hKGF was induced by methanol for 20 h(Lane 1),40 h(Lane 2)and 60 h(Lane 3).M:protein marker.The arrow indicates hKGF(28 kD).图6 优化条件后重组hKGF表达的凝胶电泳分析
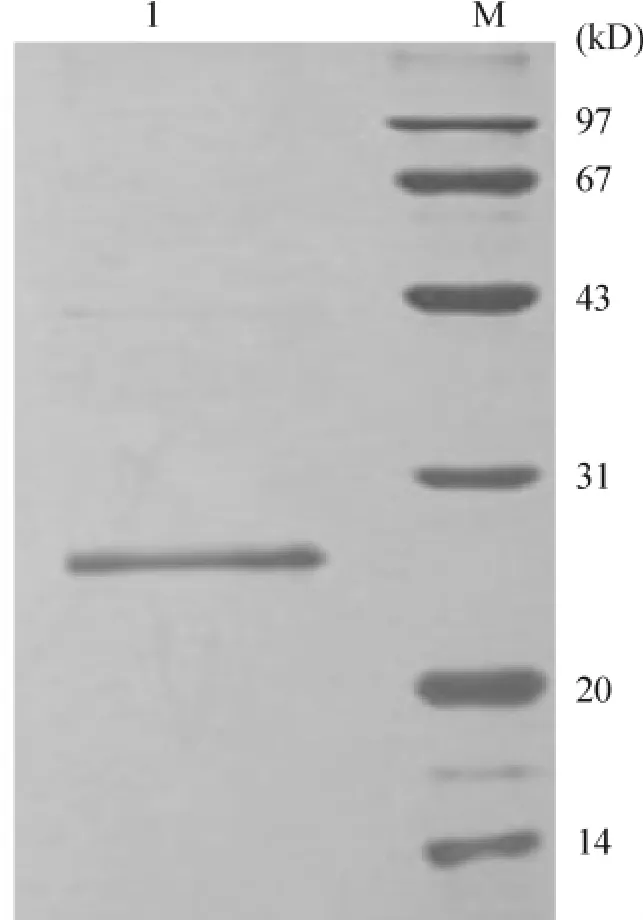
Figure 7.SDS-PAGE analysis of recombinant hKGF(sliver staining).Lane I recombinant hKGF;M:protein marker.图7 纯化后重组hKGF的凝胶电泳检测

Figure 8.Western blotting analysis of purified recombinant hKGF.Lane 1:hKGF;Lane 2:control.图8 纯化后重组hKGF的Western blotting检测
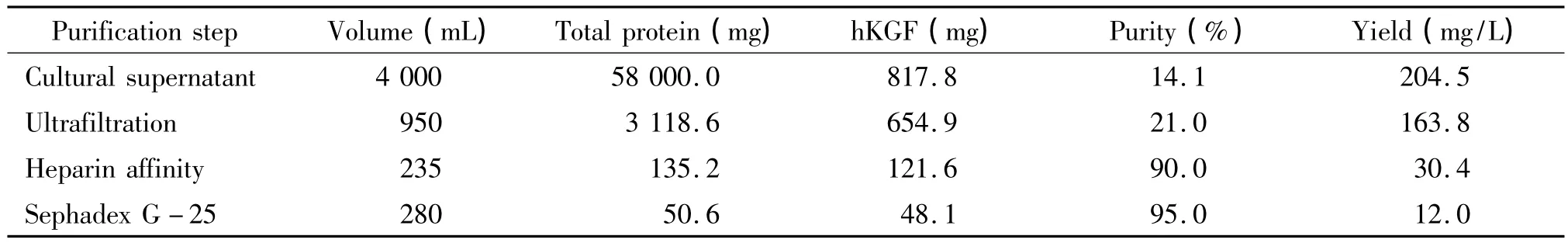
表2 重组hKGF分离纯化步骤及得率总结Table 2 .Summary of the purification of hKGF expressed in P.pastoris by fermentation
5 重组hKGF蛋白的活性测定
MTT结果表明,重组hKGF具有显著的促恒河猴肺上皮细胞增殖作用,并且呈浓度剂量依赖性,其 ED50约为57 μg/L,与标准品相比没有显著差异,见图9。

Figure 9.Pro-proliferative activeity of recombinant hKGF expressed in P.pastoris and commercial product for 4MBr-5 cells.±s.n=3.图9 重组hKGF对4MBr-5细胞促增殖活性的检测
讨论
hKGF具有广泛的生物学活性,可促进多种组织和器官上皮细胞的增殖与分化,是迄今为止对角质形成细胞最有效的促细胞分裂因子,目前已被广泛用于治疗角膜和皮肤创伤以及辐射防护等方面。
成熟的野生型hKGF为163个氨基酸残基组成的单链多肽,相对分子质量约为28 kD,具有糖基化修饰[2]。有研究表明,没有糖基化hKGF促细胞有丝分裂的活性显著高于糖基化hKGF[7,9],而我们的细胞活性测定结果也验证了这个结论。在本研究中获得的酵母表达重组hKGF的ED50约为57 μg/L,而商品化大肠杆菌表达重组hKGF的ED50一般为5~10 μg/L。目前,对于糖基化修饰影响hKGF生物活性的作用机理尚未明确,然而,结构生物学研究结果显示,糖基化修饰可能影响hKGF与上皮细胞膜受体结合能力[13]。在另一方面,糖基化修饰对hKGF结构完整性可能也有保护作用。本研究在分离纯化过程中发现,相对于原核表达的重组hKGF,糖基化hKGF不容易发生降解(资料未显示)。
迄今为止,已有研究利用基因工程方法在真核系统中表达糖基化的重组hKGF,表达量从微克级到1.1 mg/L[10-11,13]。有意思的是,在转基因植物中表达的KGF的表观分子量约为19~20 kD,似乎没有糖基化修饰或者糖基化不充分[10-11]。在本研究中,最终重组hKGF的产量达到12 mg/L,且具有糖基化修饰,可以满足实验的需求,但相对于工业化,仍有很大的差距。王希菊等[9]利用毕赤酵母表达不含糖基化位点的截断型hKGF,其纯化后产量可以达到50 mg/L,因此,我们推测蛋白糖基化的修饰过程可能是影响hKGF产量的关键因素。
总的来说,本研究合成毕赤酵母偏好密码子的hKGF基因并转化毕赤酵母中进行表达。利用肝素亲和层析和Sephardex G-25分子筛联用获得纯度为95%以上的重组蛋白,得率为12 mg/L。重组蛋白具有糖基化修饰,且能显著促进恒河猴肺上皮细胞增殖。这些结果可为日后重组hKGF的开发应用打下一定基础。
[1] Blijlevens N,Sonis S.Palifermin(recombinant keratinocyte growth factor-1):a pleiotropic growth factor with multiple biological activities in preventing chemotherapyand radiotherapy-induced mucositis[J].Ann Oncol,2007,18(5):817-826.
[2] 宗宪磊,蔡景龙,姜笃银,等.角质细胞生长因子研究进展[J].中国修复重建外科杂志,2009,23(2):188-193.
[3] Rubin JS,Bottaro DP,Chedid M,et al.Keratinocyte growth factor[J].Cell Biol Int,1995,19(5):399-411.
[4] FataJE,Mori H,Ewald AJ,et al.The MAPKERK-1,2pathway integrates distinct and antagonistic signals from TGFα and FGF7 in morphogenesis of mouse mammary epithelium[J].Dev Biol,2007,306(1):193-207.
[5] Robinson CJ,Das RG,Maile P.The World Health Organization reference reagent for keratinocyte growth factor,KGF[J].Growth Factors,2006,24(4):279-284.
[6] Hsu E,Osslund T,Nybo R,et al.Enhanced stability of recombinant keratinocyte growth factor by mutagenesis[J].Protein Eng Des Sel,2006,19(4):147-153.
[7] Ron D,Bottaro DP,Finch PW,et al.Expression of biologically active recombinant keratinocyte growth factor.Structure/function analysis of amino-terminal truncation mutants[J].J Biol Chem,1993,268(4):2984-2988.
[8] 卓山龄,孙金鹏,陈 溥,等.高密度培养大肠杆菌表达人角质细胞生长因子[J].厦门大学学报:自然科学版,2011,50(1):82-87.
[9] 王希菊,李剑凤,孙丽霞,等.重组人KGF制备工艺和活性检测方法的建立[J].生物技术,2011,21(3):47-50.
[10] 江 莺,刘秀明,马吉胜,等.转基因红花中角质细胞生长因子KGF-1的表达[J].植物学报,2011,46 (3):311-318.
[11] 杜美丽,刘秀明,江 莺,等.农杆菌介导的角质细胞生长因子-1转化油菜的研究[J].华南农业大学学报,2011,32(3):73-76.
[12] 黄亚东,苏 烨,丁长才,等.融和蛋白GST-SUMOMT在大肠杆菌中的表达、纯化及其活性研究[J].中国生物工程杂志,2007,27(12):11-16.
[13] Hsu YR,Hsu EW,Katta V,et al.Human keratinocyte growth factor recombinantly expressed in Chinese hamster ovary cells:isolation of isoforms and characterization of post-translational modifications[J].Protein Express Purif,1998,12(2):189-200.

