Egr-1介导了IL-1β诱导的小鼠软骨细胞凋亡*
叶志强, 张荣凯, 陈郁鲜, 戴海涛, 冯 辉, 杜庚衡, 曾 花, 曾 春△
(中山大学附属第三医院1急诊科,2骨科,广东广州510630;3中山大学附属第五医院骨科,广东珠海519000)
骨关节炎(osteoarthritis,OA)是一种在老年人群中最常见的退行性关节疾病,骨关节炎的病理改变通常涉及整个关节,包括滑膜、软骨及软骨下骨,最终导致关节软骨破坏和软骨下骨赘形成,整个关节发生重塑。软骨细胞是关节软骨中唯一存在的一种细胞,研究表明关节软骨内的软骨细胞发生凋亡,是骨关节炎发生过程中软骨退化的关键事件[1]。早在1998年,Hashimoto等[2]用流式细胞术检测到骨关节炎患者膝关节中软骨细胞有22.3%发生凋亡,而正常人膝关节软骨细胞的凋亡率仅为4.8%。2000年,Heraud等[3]采用TUNEL和Annexin-V标记的方法检测到髋关节骨关节炎患者中有18%~21%软骨细胞发生凋亡,而正常对照关节软骨中只检测到2%~5%软骨细胞发生凋亡。以上结果表明骨关节炎患者关节软骨细胞凋亡是广泛存在的。因此,阐明骨关节炎发生过程中软骨细胞凋亡发生的机制,发现介导软骨细胞凋亡的关键蛋白,对于确立骨关节炎的新防治靶点有重要意义。本研究采用白细胞介素1β(interleukin-1β,IL-1β)诱导软骨细胞凋亡的骨关节炎细胞模型,阐述了转录因子早期生长反应蛋白1(early growth response protein 1,Egr-1)在软骨细胞凋亡中的作用。
材料和方法
1 材料
DMEM培养基、胎牛血清、Lipofectamine RNAi MAX、Hoechst 33258等购自Invitrogen;细胞6孔培养板、24孔培养板购自 Corning;Egr-1抗体 CST 4153、caspase-3抗体CST9664、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体CST2118均购自Cell Signaling Technology;ECL试剂盒购自广州永诺生物科技有限公司;胶原酶D购自Sigma;体外重组小鼠IL-1β纯蛋白购自R&D公司;定量RT-PCR(quantitative RT-PCR,qRT-PCR)引物购自上海英骏生物技术有限公司,具体序列为:Egr-1正向5'-TATGAGCACCTGACCACAGAG-3',反向5'-GCTGGGATAACTCGTCTCCA-3';GAPDH正向 5'-TTGTCATGGGAGTGAACGAGA-3',反向5'-CAGGCAGTTGGTGGTACAGG-3'。Egr-1 siRNA片段序列为:si-Egr-1: 5'-GGACAAGAAAGCAGACAAA-3',si-Egr-2:5'-GATGAACGCAAGAGGCATA-3',对照序列为:5'-AAUCGCAUAGCGUAUGCCG-3',均购自上海吉玛制药技术有限公司。
2 方法
2.1 小鼠关节软骨细胞的体外培养 将新生小鼠麻醉后处死,手术分离股骨颈、股骨髁和胫骨平台,3 g/L胶原酶D 37℃消化45 min,回收软骨片后置于0.5 g/L胶原酶D溶液中,37℃消化过夜。回收分离的细胞悬液,用完全DMEM培养基将细胞密度稀释至4×107/L,种植在6孔板中,培养6~7 d后,细胞逐渐融合。
2.2 流式细胞术检测软骨细胞Ⅱ型胶原的表达用胰酶将贴壁培养的原代软骨细胞消化成单细胞悬液,2%甲醛固定,90%冰乙醇打孔,Ⅱ型胶原抗体室温染色1 h,Alexa 488Ⅱ抗室温染色30 min,PBS清洗后用流式细胞仪检测Ⅱ型胶原的表达情况。
2.3 Western blotting 将软骨细胞种植在6孔培养板,至细胞融合度约80%,用IL-1β处理细胞,100 μL裂解液裂解细胞,收集细胞裂解液至1.5 mL EP管,超声3次打断基因组DNA,采用Bradford方法进行蛋白定量,煮沸样本5 min,冰上冷却后10 000×g离心30 s,取上清进行SDS-PAGE,然后100 V转膜1 h,0.5%(W/V)脱脂牛奶室温封闭PVDF膜1 h,4℃Ⅰ抗孵育过夜,0.1%(V/V)TBST洗膜2次后,室温孵育Ⅱ抗1 h,洗膜3次后即用ECL显色曝光。
2.4 qRT-PCR 采用Trizol提取软骨细胞RNA,Q-PCR反应使用SsoFast EvaGreen Supermix在Bio-Rad IQ5上完成,每个反应重复3次。PCR反应条件:95℃初始变性,5 min后扩增40个循环:95℃30 s,95℃1 min,72℃ 1 min。扩增完成后,观察溶解曲线以判断信号的特异性。以GAPDH扩增信号作为内参照。mRNA相对表达量使用公式2-ΔCt计算(ΔCt=ΔCtEgr-1-CtGAPDH)。
2.5 RNA干扰 将软骨细胞种植在6孔板中,至细胞融合度约60%时准备进行转染,每个孔siRNA片段的量为200 pmol,按照Lipofectamine RNAiMAX的说明书进行操作。转染24 h后用IL-1β纯蛋白处理细胞。
3 统计学处理
结果
1 原代软骨细胞纯度的鉴定
正常软骨细胞组成性表达Ⅱ型胶原,为了检测原代软骨细胞的纯度,我们将体外分离培养的软骨细胞固定破膜后,用Ⅱ型胶原特异性标记软骨细胞,采用流式细胞仪检测软骨细胞的纯度,结果表明,软骨细胞的纯度较高,可以用于凋亡研究,见图1。

Figure 1.The purity of chondrocyte determined by flow cytometry.图1 流式细胞术检测软骨细胞的纯度
2 IL-1β诱导软骨细胞凋亡
如图2A所示,细胞发生凋亡后呈现典型的核固缩形态,对凋亡的细胞进行了计数和统计(图2B)后发现,和对照组相比,IL-1β处理软骨细胞4 h后凋亡率有轻微增加,但两组之间无显著差异,8 h和12 h后凋亡的发生率分别约为22%和43%,统计分析显示与对照组之间的差异有统计学意义,IL-1β呈时间依赖性地诱导软骨细胞凋亡。激活型caspase-3是细胞凋亡的公认指标,因此我们还用 Western blotting检测了caspase-3的表达变化,随着IL-1β处理时间增加,激活型caspase-3发生时间依赖的表达上调,见图2C。结果表明,IL-1β能诱导软骨细胞发生典型的凋亡。
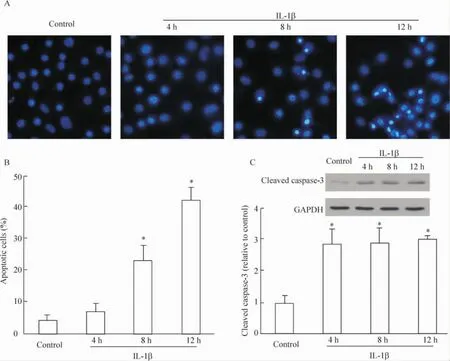
Figure 2.IL-1β induced apoptosis of chondrocytes.A:Hoechst 33258 staining of apoptotic chondrocytes(×200).B:quantitation of the results in A.At least 700 cells were counted in each group.C:IL-1β up-regulated the expression of cleaved caspase-3.±s.n=3.*P<0.05 vs control.图2 IL-1β诱导软骨细胞凋亡
3 IL-1β诱导软骨细胞凋亡中Egr-1表达上调
图3A显示伴随着细胞凋亡的发生,Egr-1 mRNA在2 h有轻微上调,4 h及8 h发生显著上调。图3B显示Egr-1蛋白在4 h及8 h有显著上调,早于软骨细胞发生显著凋亡的时间(8 h)。以上结果表明,IL-1β在诱导软骨细胞凋亡的同时,也诱导了转录因子Egr-1 mRNA及蛋白的表达上调。
4 siRNA干扰IL-1β诱导的Egr-1表达上调
2个Egr-1 siRNA片段均有效抑制了IL-1β诱导的Egr-1 mRNA及蛋白质表达上调,见图4。
5 干扰Egr-1表达保护IL-1β诱导的软骨细胞凋亡
图5A、B显示IL-1β处理软骨细胞12 h后引起约40%细胞发生凋亡,而采用2个RNA片段有效干扰Egr-1的表达后细胞的凋亡率显著降低,分别约为15%和12%,同时细胞凋亡的标志物激活型caspase-3的表达量也受到抑制,见图5C。以上结果表明干扰Egr-1的表达对软骨细胞有一定的保护作用,Egr-1参与了IL-1β诱导的体外培养软骨细胞凋亡。
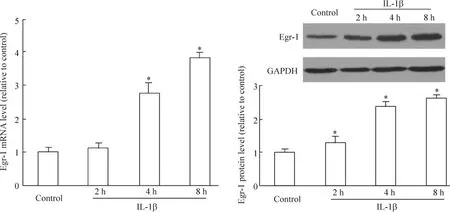
Figure 3.IL-1β induced the transcription-dependent up-regulation of Egr-1.±s.n=3.*P<0.05 vs control.图3 IL-1β诱导转录依赖性Egr-1上调
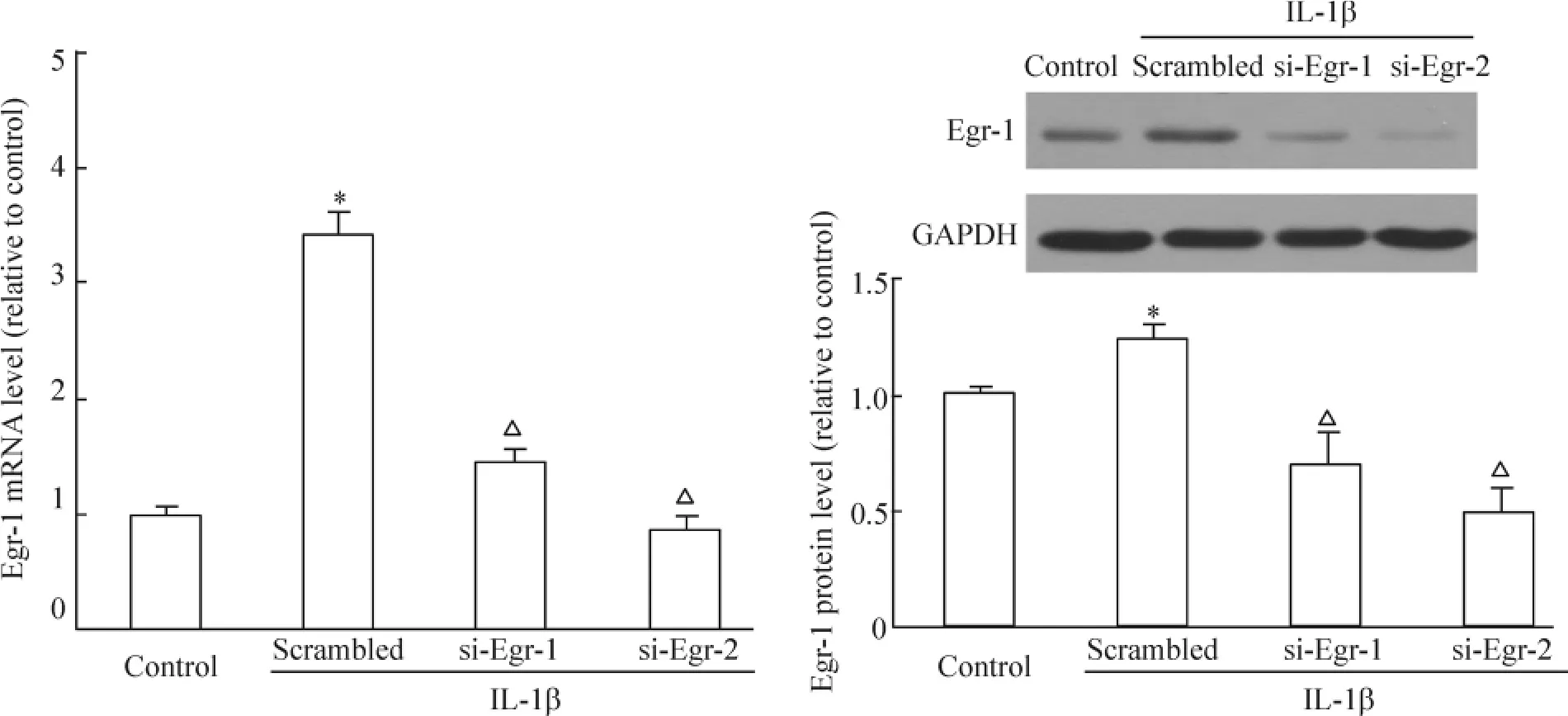
Figure 4.Effective knockdown of Egr-1 expression by siRNA.±s.n=3.*P<0.05 vs control;△P<0.05 vs scrambled.图4 siRNA抑制Egr-1表达
讨论
骨关节炎的发病率高,是目前世界上最常见的关节炎。骨关节炎的发病率与年龄密切相关,随着年龄的增长,骨关节炎的发病率显著上升[4]。世界卫生组织的统计结果表明:55岁以上人群中骨关节炎的患病率约为80%,而60岁以上的人群几乎都患有不同程度的骨关节疾病。我国是一个人口大国,而且即将迈入老年化社会,因此,骨关节炎是不可回避的一个社会问题。由于目前的研究成果对骨关节炎的发病机制缺乏从根本上的认识,因此在骨关节炎的治疗手段上依然相当保守,在疾病发展的晚期,患者最终必须接受全关节置换。因此,从分子水平上阐明骨关节炎的发病机制,寻找骨关节炎治疗的关键靶点,成为亟待解决的关键问题。
IL-1β是与骨关节炎发病密切相关的炎症因子,通过IL-1β刺激软骨细胞是广泛被认可和应用的一种骨关节炎细胞模型[5-6],然而IL-1β诱导软骨细胞凋亡的机制,目前尚不清楚。Egr-1是即刻早期基因家族中的一员,这个家族在受到外界刺激后能迅速被激活,而不依赖于任何新蛋白的合成,Egr-1的表达产物是一个转录因子,通过调控下游基因的表达从而引起细胞功能的改变,目前的研究发现至少有30多种基因的转录需要Egr-1参与,涉及细胞生长分化和凋亡、免疫刺激、炎性细胞趋化等多个方面[7]。Egr-1与细胞凋亡的发生密切相关[8],目前的研究认为Egr-1主要通过3种方式发挥促细胞凋亡作用:(1)直接转录上调抑癌基因p53的表达[9];(2)与促凋亡基因c-Jun直接相互作用并增强其促凋亡活性[10];(3)直接转录激活PTEN[11]。

Figure 5.Knockdown of Egr-1 protected chondrocytes from apoptosis induced by IL-1β.A:Hoechst 33258 staining of apoptotic chondrocyte(×200).B:quantitation of the results in A.At least 700 cells were counted in each group;C:up-regulation of cleaved caspase-3 was inhibited after knockdown of Egr-1.±s.n=3.*P<0.05 vs control;△P<0.05 vs scrambled.图5 干扰Egr-1表达保护IL-1β诱导的软骨细胞凋亡
在本研究中我们发现伴随着软骨细胞凋亡的发生,IL-1β能时间依赖性上调Egr-1的表达水平,而有效干扰Egr-1的表达后,软骨细胞对IL-1β的促凋亡作用有抵抗,细胞凋亡率从40%下降到15%左右,表明Egr-1在软骨细胞凋亡过程中发挥关键作用,可能是介导骨关节炎发生过程中的关键蛋白。但Egr-1促软骨细胞凋亡的靶基因尚未明确,进一步阐明Egr-1通过何种机制发挥促软骨细胞凋亡作用是我们下一步研究的重点。
[1] Goggs R,Carter SD,Schulze-Tanzil G,et al.Apoptosis and the loss of chondrocyte survival signals contribute to articular cartilage degradation in osteoarthritis[J].Vet J,2003,166(2):140-158.
[2] Hashimoto S,Ochs RL,Komiya S,et al.Linkage of chondrocyte apoptosis and cartilage degradation in human osteoarthritis[J].Arthritis Rheum,1998,41(9):1632-1638.
[3] Heraud F,Heraud A,Harmand MF.Apoptosis in normal and osteoarthritic human articular cartilage[J].Ann Rheum Dis,2000,59(12):959-965.
[4] Shane Anderson A,Loeser RF.Why is osteoarthritis an age-related disease?[J].Best Pract Res Clin Rheumatol,2010,24(1):15-26.
[5] Mengshol JA,Vincenti MP,Brinckerhoff CE.IL-1 induces collagenase-3(MMP-13)promoter activity in stably transfected chondrocytic cells:requirement for Runx-2 and activation by p38 MAPK and JNK pathways[J].Nucleic Acids Res,2001,29(21):4361-4372.
[6] Shakibaei M,John T,Seifarth C,et al.Resveratrol inhibits IL-1β-induced stimulation of caspase-3 and cleavage of PARP in human articular chondrocytes in vitro[J].Ann N Y Acad Sci,2007,1095:554-563.
[7] 初 令,曾庆富.转录因子Egr-1及其在肺病变中的研究进展[J].中国病理生理杂志,2004,20(2):268-272.
[8] 秦 丽,张惠华,郭淑军,等.外源性EGR1瞬时表达对骨肉瘤细胞细胞周期和凋亡的影响[J].中国病理生理杂志,2011,27(2):293-299.
[9] Nair P,Muthukkumar S,Sells SF,et al.Early growth response-1-dependent apoptosis is mediated by p53[J].J Biol Chem,1997,272(32):20131-20138.
[10] Levkovitz Y,Baraban JM.A dominant negative Egr inhibitor blocks nerve growth factor-induced neurite outgrowth by suppressing c-Jun activation:role of an Egr/c-Jun complex[J].J Neurosci,2002,22(10):3845-3854.
[11] Virolle T,Adamson ED,Baron V,et al.The Egr-1 transcription factor directly activates PTEN during irradiation-induced signalling[J].Nat Cell Biol,2001,3 (12):1124-1128.

