造血干细胞移植患者早期发生呼吸道感染的危险因素分析*
黄花荣, 张 娜, 孔 倩
(中山大学孙逸仙纪念医院儿科,广东广州510120)
人类造血干细胞(hematopoietic stem cell,HSC) 移植已成为治疗白血病、再生障碍性贫血、地中海贫血、实体瘤、自身免疫性疾病、基因缺陷、心肌梗死等疾病的重要手段之一[1-3],HSC移植早期患者机体防御力降低、基础疾病对机体的影响及移植物抗宿主病等原因,使机体易于发生各类感染,呼吸道结构脆弱、血供丰富,因而成为移植后感染发生的常见部位[4]。我们通过对接受HSCs移植的患者资料进行分析,以探讨HSC移植患者早期发生呼吸道感染的危险因素,为临床提高HSC治疗效果提供最佳的帮助。
对象和方法
1 研究对象
2000年至2010年在中山大学孙逸仙纪念医院接受HSC移植患者共168例,年龄为1~63(中位数为25.68)岁,其中<14岁儿童有101例,占60.1%,≥14岁患者67例,占39.9%,儿童与成年的比例约为1.51∶1,男性104例,占61.9%,女性64例,占38.1%,男女之比为1.6∶1。在移植早期发生了呼吸道感染者122例,无呼吸道感染者46例,两组在性别构成和原发病构成方面差异无统计学意义(P>0.05)。
2 骨髓造血重建的标准
移植后外周血中性粒细胞计数大于 0.5× 109/L,血小板计数大于20×109/L,持续超过3 d,并排除输血治疗等影响因素考虑造血功能重建[5]。
3 呼吸道感染的入选标准
3.1 移植早期呼吸道感染的定义 移植后1~30 d内发生的呼吸道感染定义为移植早期呼吸道感染,以呼吸道感染的首次诊断日作为呼吸道感染的时间[6]。移植前已存在感染者排除在外。
3.2 感染性发热 患者单次发热体温>38.3℃或38℃持续1 h以上,且除外其它原因(药物、输血及移植物抗宿主病等)所致的发热,诊断为感染性发热[6]。
3.3 上呼吸道感染 感染性发热伴有咳嗽、鼻塞、流涕、喷嚏、咽部充血2种或2种以上呼吸道症状时,排除下呼吸道感染,诊断为上呼吸道感染。
3.4 下呼吸道感染的诊断标准[7]为符合下列3项中任意1项:(1)新出现的气促伴或不伴有肺部的干湿啰音;(2)新出现的肺部渗出性改变(胸部X线或高分辨CT或二者同时提示);(3)肺活检或支气管肺泡灌洗液中发现病原体。
4 方法
按是否发生呼吸道感染分为感染组与非感染组,并进行上、下呼吸道感染分层研究。记录和分析HSC者的性别、年龄、原发病类型、干细胞来源、预处理方式、是否异基因移植、是否亲缘移植、人类白细胞抗原(human leukocyte antigen,HLA)不匹配移植、是否呼吸道感染高发季节移植、移植受体或供者是否曾有巨细胞病毒(cytomegalovirus,CMV)感染,是否有真菌性肺炎病史,移植后血象恢复时间以及是否发生移植物抗宿主病(graft-versus-host disease,GVHD)及HSC移植早期呼吸道感染的发生情况进行回顾性病例对照研究临床资料。
5 统计学处理
结果
1 HSC移植的原发病种类及其发生呼吸道感染情况
HSC移植的原发病及其发生早期呼吸道感染的情况见表1。本组患者进行HSC移植后发生早期呼吸道感染率均较高,其中血液系统恶性疾病占59.5%,地中海贫血占26.2%,两者共占85.7%。
2 HSC移植早期呼吸道感染发生总体情况
2000年至2010年在我院接受HSC移植的患者共计168例,其中122例患者在移植早期发生了呼吸道感染,占总体的72.62%,其中上呼吸道感染者74例,占总体的44.0%,下呼吸道感染48例,占总体的28.6%。
2000年至2005年接受HSC移植的患者共59例,HSC移植早期发生呼吸道感染的患者共52例,占88.1%;2006至2010接受HSC移植的患者共109例,发生呼吸道感染者共70例,占64.2%,前后5年感染率有明显差异,P<0.05。
3 HSC移植早期呼吸道感染与骨髓造血功能重建关系
HSC移植早期呼吸道感染时间的中位数为移植后第7 d,骨髓造血功能重建的平均时间为移植后第(14.5±5.4)d。发生呼吸道感染的122例患者中,99例发生于造血重建前,占81.15%;23例患者呼吸道感染发生于造血重建后,占18.85%。
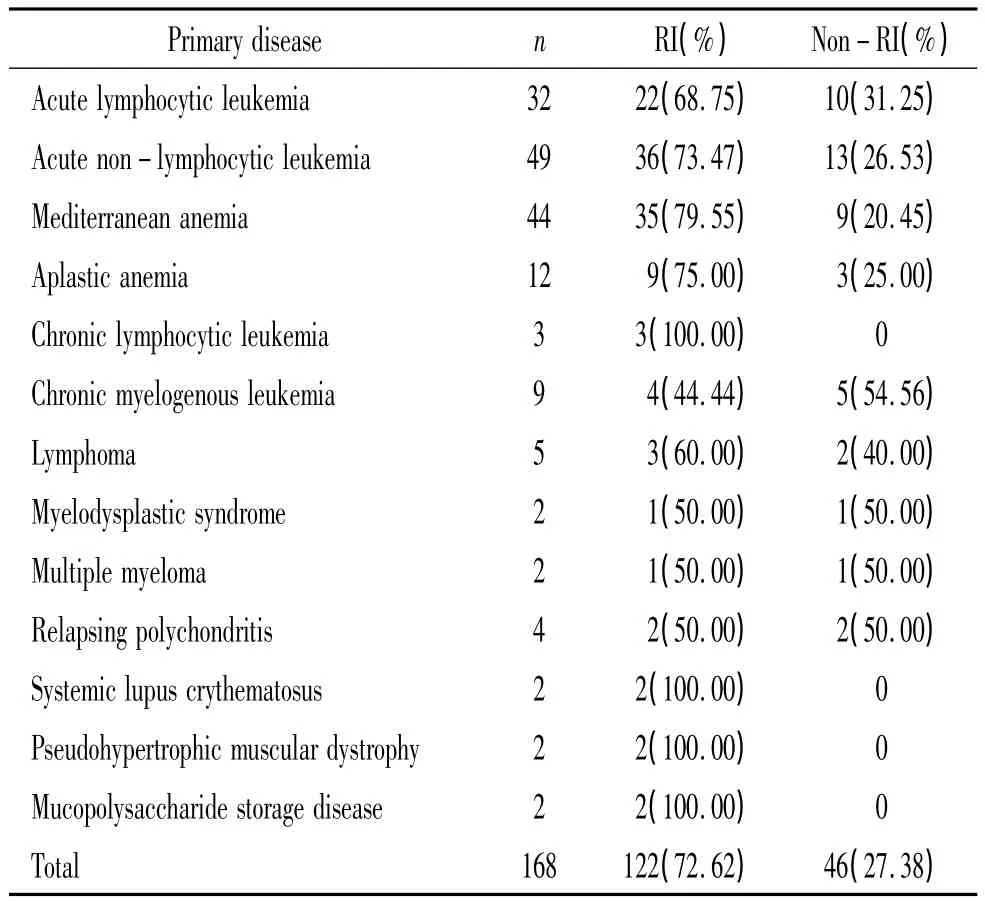
表1 168例患者的原发病类型及其发生呼吸道感染情况Table 1 .The primary diseases and pathogenesis status of respiratory infection(RI)of 168 patients with HSC transplantation
4 HSC移植早期呼吸道感染的危险因素分析
4.1 HSC移植早期呼吸道感染危险因素的单因素分析 儿童患者移植早期更易发生呼吸道感染;外周血干细胞移植(peripheral blood stem cell transplantation,PBSCT)、脐血移植(umbilical cord blood transplantation,UCBT)、骨髓移植(bone marrow transplantation,BMT)和混合移植比较,UCBT患者移植早期呼吸道感染率最高,BMT和混合移植次之,PBSCT最低;单纯使用化疗药物预处理、改良方案化疗预处理比较,单纯化疗预处理患者移植早期呼吸道感染率高;亲缘移植和非亲缘移植比较,非亲缘移植患者更易发生呼吸道感染;HLA全相合移植和不全相合移植比较,HLA不全相合移植患者HSC移植早期呼吸道感染率高;呼吸道感染组和无呼吸道感染组血象恢复时间比较,呼吸道感染组患者血象恢复时间更长。根据单因素分析,年龄、干细胞来源、预处理方式、非亲缘移植、HLA不匹配移植和血象恢复时间是移植早期呼吸道感染的危险因素,见表2。
4.2 HSC移植早期呼吸道感染危险因素的Logistic分析 选择单因素分析差异有统计意义的危险因素进行Logistic回归分析。筛选前的探索因素有:年龄、干细胞来源、预处理方式、非亲缘移植、HLA不匹配移植和血象恢复时间;经筛选后得出影响HSC移植早期呼吸道感染的独立危险因素有年龄和非亲缘移植,见表3。
5 HSC移植早期上呼吸道感染的危险因素分析
5.1 单因素分析结果 根据单因素分析,年龄、干细胞来源、非亲缘移植、HLA不匹配移植和血象恢复时间是HSC移植早期上呼吸道感染的危险因素,而性别、原发病类型、是否异基因移植、预处理方式、呼吸道疾病高发季节移植、发生GVHD、CMV感染和真菌性肺炎病史,经χ2检验P>0.05,差异无统计学意义。
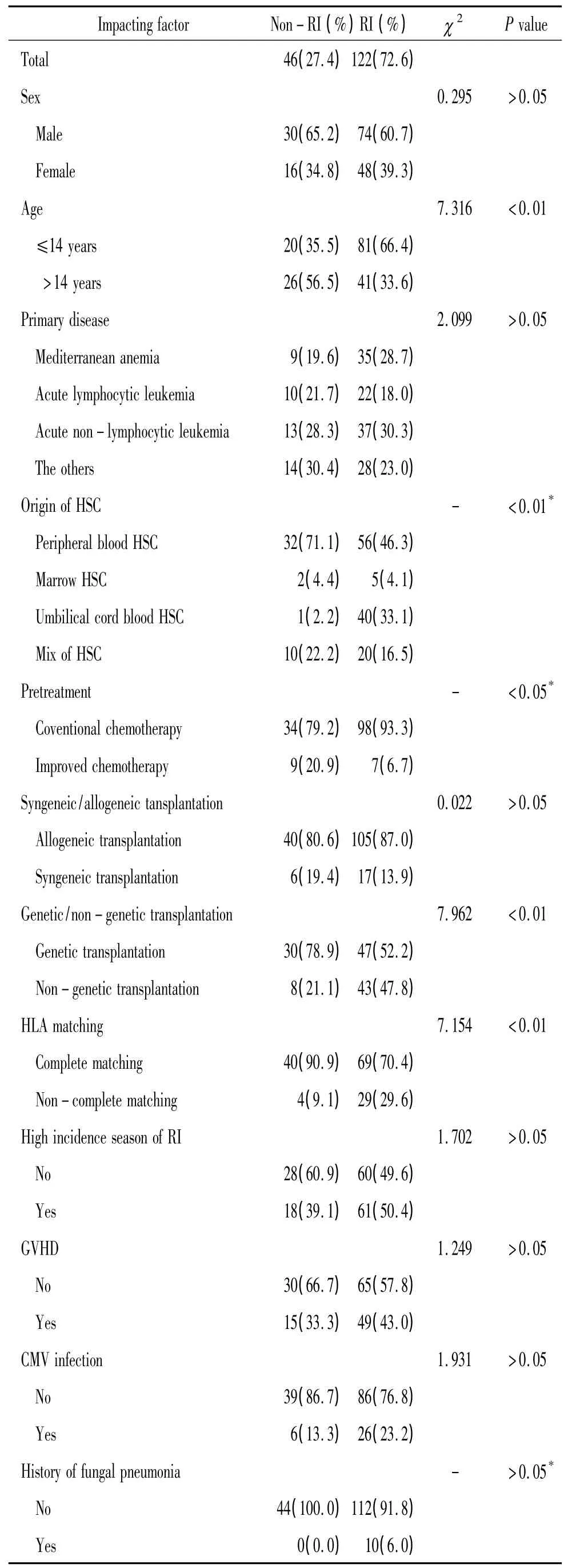
表2 HSC移植早期呼吸道感染危险因素的单因素分析结果Table 2 .Single-factor analysis of risk factors of RI in patients with HSC transplantation at early stage
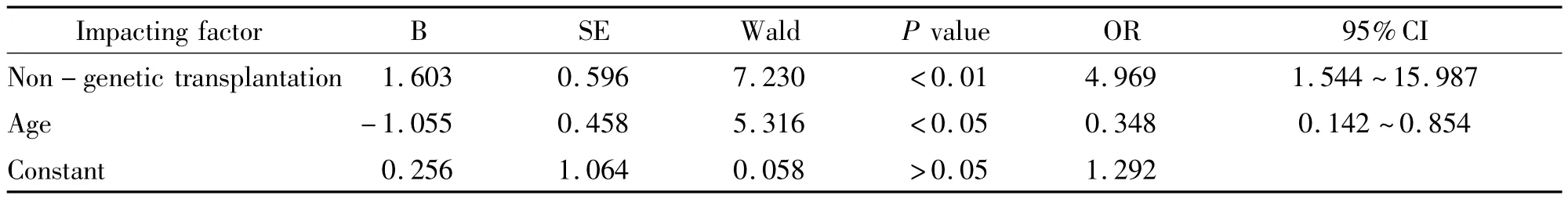
表3 HSC移植早期呼吸道感染危险因素的Logistic回归分析结果Table 3 .Logistic analysis of risk factors of RI in patients with HSC transplantation at early stage
5.2 多因素分析结果 选择单因素分析差异有统计学意义的可能危险因素进行逐步前进法Logistic回归分析。筛选前的探索因素有:年龄、干细胞来源、非亲缘移植、HLA不匹配移植和血象恢复时间;经筛选后得出影响HSC移植早期上呼吸道感染的独立危险因素有年龄和非亲缘移植。
6 HSC移植早期下呼吸道感染的危险因素分析
6.1 单因素分析结果 根据单因素分析,干细胞来源、非亲缘移植、HLA不匹配移植、真菌性肺炎病史和发生GVHD是HSC移植早期下呼吸道感染的危险因素,而性别、年龄、原发病类型、是否异基因移植、预处理方式、呼吸道疾病高发季节移植、CMV感染和血象恢复时间,经χ2检验P>0.05,差异无统计学意义。
6.2 多因素分析结果 选择单因素分析差异有统计学意义的可能危险因素进行逐步前进法Logistic回归分析。筛选前的探索因素有:干细胞来源、是否亲缘移植、HLA不匹配移植、真菌性肺炎病史和GVHD,经筛选后得出影响HSC移植早期下呼吸道感染的独立危险因素有HLA不匹配移植和真菌性肺炎病史。
讨论
既往有关HSC移植治疗的原发病对移植早期发生呼吸道感染影响的文献极少,这些原发病大部分是血液系统的恶性疾病或严重性难治性贫血,这些疾病本身就易引起呼吸道的感染。因此,其造成的HSC移植后的感染原因除与移植有关外,与疾病本身的因素亦有关。本组资料说明HSC移植后发生早期呼吸道感染率均较高,其中血液系统恶性疾病占59.5%,地中海贫血占26.2%,两者共占85.7%。
既往有关HSC移植早期呼吸道感染发病情况的资料较少见。Afessa等[8]研究示HSC移植后肺炎的发生率为40%~60%,黎阳等[9]对29例患者HSC移植早期感染的发生率为94.0%。本组资料研究显示HSC移植早期呼吸道感染率为72.6%,其中上呼吸道感染发病率为44.0%;下呼吸道感染发病率为28.6%。前5年早期发生呼吸道感染者占88.1%,后5年发生呼吸道感染者占64.2%,前后5年感染率有明显差异。这说明HSC移植早期呼吸道感染的几率较高;而近年来对HSC移植后发生的呼吸道感染的预防与诊治水平不断提高,因此,HSC移植早期呼吸道感染的发生有明显下降。
HSC移植早期呼吸道感染与造血重建关系,夏凌辉等[10]对121例干细胞移植的患者资料进行分析示:HSC移植后造血重建的时间为移植后14.2 d,HSC移植后感染的中位时间为移植后8.6 d,大多数感染发生于造血重建前。本组资料发现HSC移植后造血重建的平均时间为移植后(14.5±5.4)d;HSC移植早期呼吸道感染时间的中位数为移植后7 d,81.1%患者HSC移植早期呼吸道感染发生于造血重建前,18.9%呼吸道感染发生于造血重建后。其主要原因是移植前大剂量放、化疗导致患者造血和免疫功能破坏,骨髓造血功能恢复正常前,患者外周血细胞数低,抵抗能力差,对各种病原体易感。
HSC移植早期呼吸道感染的危险因素分析的文献较少,而进行上、下呼吸道感染的分层研究的文献就未见报道。Kato等[5]研究认为自体骨髓干细胞移植后白细胞减少是一切感染和上呼吸道感染的独立危险因素,Meyer等[6]研究外周血干细胞移植后肺炎发生的独立危险因素为男性患者与急性髓性白血病患者,而Thursky等[11]研究认为同种异基因干细胞移植后发生侵入性霉菌感染的危险因素为大剂量糖皮质激素使用、GVHD和白细胞减少。Bratton等[12]认为干细胞移植后免疫重建缓慢是患者高发呼吸道感染的主要原因。Wingard等[1]发现非亲缘移植患者T细胞、B细胞免疫重建较亲缘移植患者慢,HSC移植后发生各种感染的几率较同基因移植高。Garcia-Vidal等[13]对1 248例患者资料分析发现HLA不全相合移植更易发生深部真菌感染;王莉红等[14]在其研究中也证实:HLA不全相合的患者发生细菌感染的机率更高,感染时间更早。不少学者发现使用类固醇激素进行预处理会增加患者发生早期深部真菌感染的几率[11];Nichols等[15]发现减低化疗强度能够降低移植后肺炎的死亡率。
本组资料说明:经单因素分析移植早期呼吸道感染的危险因素是年龄、干细胞来源、预处理方式、非亲缘移植、HLA不匹配移植和血象恢复时间,进行Logistic回归分析说明HSC移植早期呼吸道感染的独立危险因素有年龄和非亲缘移植,而与患者性别、白细胞减少和原发疾病种类无关,这可能与我们严格控制感染、层流房应用和进行HSC的疾病大部分为血液恶性疾病有关。
经上、下呼吸道感染的分层研究后发现:上呼吸道感染单因素分析的危险因素为年龄、干细胞来源、非亲缘移植、HLA不匹配移植和血象恢复时间,Logistic回归分析HSC移植早期上呼吸道感染的独立危险因素仍是年龄和非亲缘移植;而下呼吸道感染的单因素分析的危险因素为干细胞来源、非亲缘移植、HLA不匹配移植、真菌性肺炎病史和发生GVHD,Logistic回归分析HSC移植早期下呼吸道感染的独立危险因素为HLA不匹配移植和真菌性肺炎病史。
HSC移植的儿童患者发生呼吸道感染的几率较成人高,这与儿童呼吸系统的解剖、生理、免疫功能特点等有关,如婴幼儿的气管、支气管较成人短和较狭窄,黏膜血管丰富,但缺乏弹力组织;肺泡数量较少且血管丰富;儿童肺活量与潮气量较小,气道阻力较大;儿童的非特异性与特异性免疫功能均较差等,使儿童患者易发生呼吸道感染。非亲缘移植与HLA不匹配移植除可能增加移植失败的风险外,可增加GVHD发生机率和受者的保护性免疫重建延迟,从而使发生感染的风险增加,并可导致移植相关死亡率的增高,对于HLA不匹配移植者预先使用抗胸腺细胞球蛋白(antithymocyte globulin,ATG)处理,去除T细胞后再进行移植,可预防GVHD的发生,使非亲缘移植与HLA不匹配的移植受者在较短时间内达到造血功能的重建[16]。
因此,在进行HSC移植时,对于儿童患者、非亲缘移植和HLA不匹配移植患者,要高度注意预防呼吸道感染。
[1] Wingard JR,Hsu J,Hiemenz JW.Hematopoietic stem cell transplantation:an overview of infection risks and epidemiology[J].Infect Dis Clin North Am,2010,24(2): 257-272.
[2] 刘宏伟,盖鲁粤,张端珍,等.骨髓干细胞动员与移植治疗心肌梗死的比较[J].中国病理生理杂志,2006,22 (4):674-677.
[3] 张敬军,刘焯霖.干细胞的应用[J].中国病理生理杂志,2004,20(8):1522-1526.
[4] 张 娜,黄花荣.干细胞移植后并发呼吸道感染的机制研究进展[J].新医学,2012,43(5):344-347.
[5] Kato H,Yamamoto K,Matsuo K,et al.Clinical impact and predisposing factors of delayed-onset neutropenia after autologous hematopoietic stem-cell transplantation for B-cell non-Hodgkin lymphoma:association with an incremental risk of infectious events[J].Ann Oncol,2010,21(8):1699-1705.
[6] Meyer E,Beyersmann J,Bertz H,et al.Risk factor analysis of blood stream infection and pneumonia in neutropenic patients after peripheral blood stem cell transplantation[J].Bone Marrow Transplant,2007,39(3):173-178.
[7] Carlisle PS,Gucalp R,Wiernik PH.Nosocomial infections in neutropenic cancer patients[J].Infect Control Hosp Epidemiol,1993,14(6):320-324.
[8] Afessa B,Peters SG.Chronic lung disease after hematopoietic stem cell transplantation[J].Clin Chest Med,2005,26(4):571-586.
[9] 黎 阳,黄绍良,方建培,等.造血干细胞移植后早期感染29例临床分析[J].中华儿科杂志,2003,7(41): 520-524.
[10] 夏凌辉,邹 萍,胡俊斌,等.造血干细胞移植后并发感染121例的临床分析[J].中华器官移植杂志,2006,26(11):685-689.
[11] Thursky K,Byrnes G,Grigg A,et al.Risk factors for post-engraftment invasive aspergillosis in allogeneic stem cell transplantation[J].Bone Marrow Transplant,2004,34(2):115-121.
[12] Bratton SL,Van Duker H,Statler KD,et al.Lower hospital mortality and complications after pediatric hematopoietic stem cell transplantation[J].Crit Care Med,2008,36(3):923-927.
[13] Garcia-Vidal C,Upton A,Kirby KA,et al.Epidemiology of invasive mold infections in allogeneic stem cell transplant recipients:biological risk factors for infection according to time after transplantation[J].Clin Infect Dis,2008,47(8):1041-1050.
[14] 王莉红,任汉云,李 渊,等.HLA相合同胞和不全相合血缘关系供者造血干细胞移植的临床对比研究[J].中华血液杂志,2008,29(8):507-511.
[15] Nichols WG,GooleyT,Boeckh M.Community-acquired respiratory syncytial virus and parainfluenza virus infections after hematopoietic stem cell transplantation:the Fred Hutchinson Cancer Research Center experience[J].Biol Blood Marrow Transpl,2001,7(Suppl):11S-15S.
[16] Lu DP,Dong L,Wu T,et a1.Conditioning including antithymocyte globulin followed by unmanipulated HLA-mismatched/haploidentical blood and marrow transplantation can achieve comparable outcomes with HLA-identical sibling transplantation[J].Blood,2006,107(8):3065-3073.

