慢病毒介导的靶向沉默胰岛素样生长因子1型受体的siRNA对人子宫内膜癌细胞迁移和侵袭能力的影响*
万 璟, 李小毛△, 舒珊荣, 张 宇
(1中山大学附属第三医院妇科,广东广州510630;2广州华侨医院妇产科,广东广州510632)
子宫内膜癌是妇科最常见的恶性肿瘤之一,近年来国内外发病率均有上升趋势。尽管多数子宫内膜癌为分化较好的腺癌,早期诊断和早期治疗预后好。但一旦发生肿瘤的侵袭和转移后,患者治疗效果和预后都明显较差,据统计,发生转移后子宫内膜癌患者的5年生存率不到25%[1]。探讨子宫内膜癌细胞转移和侵袭的机制,找到新的治疗靶点对子宫内膜癌具有十分重要的意义。
胰岛素样生长因子(insulin-like growth factor,IGF)系统在许多恶性肿瘤中起着重要的作用,并与子宫内膜癌的发生发展有关。IGF-1与其受体(insulin-like growth factor type 1 receptor,IGF-1R)结合,激发自身磷酸化,导致下游的有丝分裂原激活的蛋白激酶通路及磷脂酶-3蛋白激酶激活,进而引起细胞的增殖和肿瘤的转移。IGF-1R在一些肿瘤中过度表达。这些受体的过度表达,外源性肽类使肿瘤细胞转化为不依赖于支持物生长的类型[2]。研究发现IGF-1R与肿瘤的侵袭和转移有关,IGF-1能促进乳腺癌细胞的运动,进而促进肿瘤细胞的转移[3],采用反义技术阻断IGF-1R的表达,能够抑制鼠前列腺癌细胞的生长及转移[4]。但IGF-1R对子宫内膜癌迁移和侵袭能力的作用仍然未知。本实验旨在利用RNA干扰技术沉默IGF-1R基因的表达,观察其对子宫内膜癌细胞体外迁移和侵袭能力的影响。
材料和方法
1 细胞培养
DH5α菌株,购自Promega。HEK293T细胞、人子宫内膜癌HEC-1B细胞购自中国科学院上海细胞库,均采用含10%胎牛血清的DMEM低糖培养液(含青霉素1×105U/L和链霉素100 mg/L)培养,用含0.02%EDTA的2.5 g/L胰蛋白酶消化传代。传代后取对数生长期细胞作为实验对象。
2 主要试剂
特级胎牛血清、Opti-MEM I培养基和胰蛋白酶购于Gibco;RNA提取物Trizol购于Invitrogen;Reverse Transcription System试剂盒购于TaKaRa;PCR引物由上海生工生物工程公司合成;Matrigel购于BD;Transwell小室购于Corning;MTT购于Sigma。pGCSIL-GFP质粒载体购自上海吉凯基因化学技术有限公司,pEGFP-N1-3FLAG质粒载体购自Becton Dickinson。鼠抗人IGF-1R购自Cell Signaling Technology;鼠抗 β-actin多克隆抗体购自 Santa Cruz Biotechnology;细胞总蛋白提取试剂盒购自Pierce;蛋白分子质量Marker购自Fermentas。
3 siRNA设计、合成和筛选
根据IGF-1R基因序列和siRNA设计原则,设计5对siRNA序列。具体如下:siRNA1:5’-GCCGATGAGTGAGAAGACC-3’;siRNA2:5’-GCACGTCGAAGAATCGCAT-3’;siRNA3:5’-CGTTCTTTCAGCATCGAAC-3’;siRNA4:5’-CCATCAACAATGAGTACAA-3’;siRNA5:5’-GCATCACCGTTTACTACAA-3’。合成工作委托上海吉凯基因化学技术有限公司完成,利用工具细胞HEK293T筛选出3条片段有沉默作用,选取其中沉默效果最好的1条进行慢病毒包装扩增,并转染子宫内膜癌HEC-1B细胞,根据real-time PCR和Western blotting结果验证其沉默效果。吉凯基因慢病毒载体系统由pGC-LV载体、pHelper 1.0载体和pHelper 2.0载体3质粒组成。pGC-LV载体中携带用于研究的PTEN基因,并带有GFP标记。
4 病毒载体稳定转染
转染前1 d将细胞接种到6孔板(2×105cells/ well),待第2 d细胞密度为40%~50%进行转染;将每个6孔板中的旧培养基吸尽,用不含血清的培养基洗涤1~2次;然后每个6孔板中加入1.5 mL的无血清培养基;HEC-1B细胞按感染复数(multiplicity of infection,MOI)为50进行慢病毒转染,分别设对照组(HEC-1B-CON)、目的基因病毒转染组(HEC-1B-KD)及阴性病毒转染对照组(HEC-1B-NC);转染8 h后将无血清培养基换为含10%胎牛血清的培养基继续培养。
5 Real-time PCR检测
转染后5 d,用Trizol抽提总RNA,变性电泳,测定A260及A280值,调整总RNA浓度为1 g/L,-80℃保存备用。根据IGF-1R、基质金属蛋白酶2(matrix metalloproteinases-2,MMP-2)和基质金属蛋白酶9 (matrix metalloproteinases-9,MMP-9)序列设计合成引物,β-actin为内参照(表1)。先以总RNA为模板进行逆转录反应,然后以 cDNA为模板采用TaKaRa的real-time RT-PCR试剂盒在ABI 7700荧光PCR仪上进行real-time RT-PCR反应,PCR反应条件为预变性95℃ 10 s,95℃5 s,60℃ 30 s,40个循环。Real-time PCR扩增完毕进行熔解曲线分析,采用相对定量法以β-actin为内参照,利用Ct值计算各基因mRNA的相对量。目的基因mRNA相对表达量用2-ΔCt来表示(ΔCt由目的基因的Ct值减去β-actin的Ct值)。
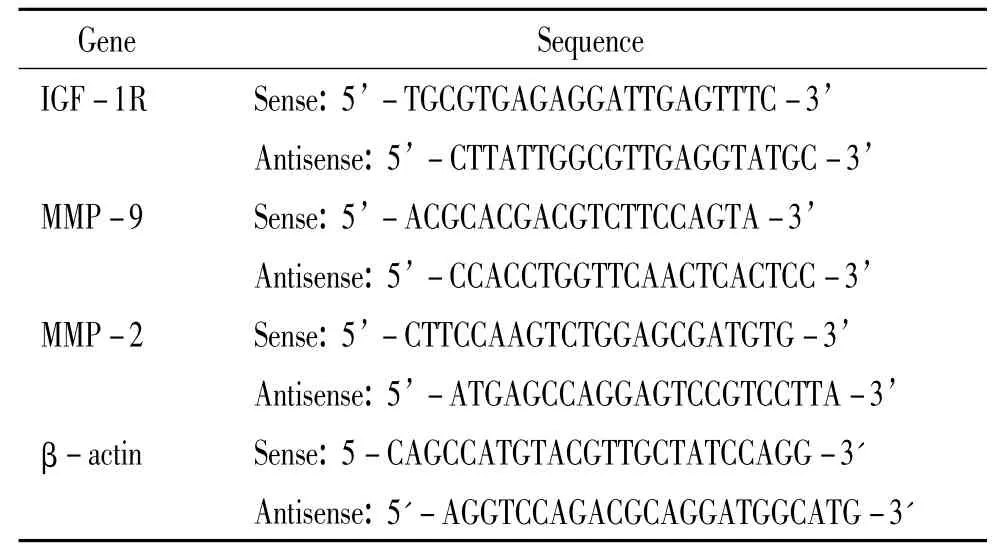
表1 IGF-1R、MMP-9和MMP-2的引物序列Table 1 .The primers for IGF-1R,MMP-9 and MMP-2
6 Western blotting检测
转染后第7 d,提取1×106个细胞的蛋白,紫外分光光度计定量,聚丙烯酰胺凝胶电泳,转印至硝酸纤维素膜上,常规进行免疫印迹实验操作,IGF-1R兔抗1∶1 000和β-actin兔抗1∶1 000稀释及羊抗兔Ⅱ抗抗体孵育,增强发光(ECL)显色。对膜上的免疫复合物条带进行分析,IGF-1R蛋白的相对表达水平为IGF-1R蛋白条带密度/β-actin条带密度。
7 平板集落形成实验
转染5 d后,将3组细胞按每个皿5 000个细胞密度接种到10 cm细胞培养皿中,置于37℃、5% CO2培养箱连续培养18 d后中止培养。细胞经甲醇固定15 min,0.1%结晶紫染色30 min,显微镜下计数细胞克隆数。实验设3个平行样品,重复3次,结果取平均值。
8 细胞迁移实验
转染后第7 d,细胞培养至对数生长期,消化细胞,用PBS和无血清培养基先后洗涤1次,用无血清培养基悬浮细胞,计数,调整浓度为1×108/L;使用Transwell小室,在下室加入600 μL含10%血清的培养基上室加入100 μL细胞悬液,继续在孵箱培养24 h;取出Transwell用PBS洗2遍,甲醇固定,室温20 min;加入结晶紫(0.1%)染色,室温0.5 h,PBS洗2遍,用棉球擦去上表面细胞,显微镜下取10个随机视野计数,每个标本重复3次。
9 细胞侵袭实验
转染第7 d,提前准备好基质胶,将冻存于-80℃冰箱的BD Matrigel 4℃过夜(24 h),变成液态;取无血清培养基,加入Matrigel(20%),混匀(冰上操作),加入上室,每孔100 μL;放入37℃培养箱中,孵育5 h;消化细胞,无血清培养基洗3次,计数,配成细胞悬液;调整浓度为5×109/L;下室中加入10% FBS条件培养基;上室每孔加入100 μL细胞悬液;37℃培养箱中,孵育24 h;取出Transwell小室用PBS洗2遍,甲醇固定,室温20 min;加入结晶紫(0.1%)染色,室温0.5 h,PBS洗2遍,用棉球擦去上表面细胞,显微镜下取10个随机视野计数,每个标本重复3次。
10 统计学处理
用SPSS 11.0统计软件进行数据分析。计量资料用均数±标准差(±s)表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结果
1 siRNA序列筛选
将HEK293T细胞作为实验筛选细胞,转染后提取RNA进行检测,结果见图1。筛选出siRNA1、2、4、5均能降低IGF-1R mRNA水平至30%以下,选取沉默效果最好的siRNA1进行慢病毒包装扩增。
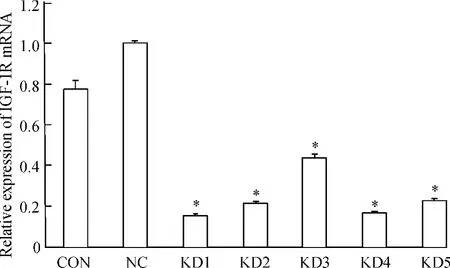
Figure 1.Expression of IGF-1R mRNA in HEK293T cells after different siRNA transfection.±s.n=3.*P<0.05 vs CON and NC.图1 转染后各组细胞IGF-1R mRNA的表达
2 细胞转染效率的检测
HEC-1B细胞转染后5 d可见较多特异性GFP绿色荧光的表达,表明我们的转染相对成功,见图2。

Figure 2.Expression of green fluorescent protein in HEC-1B cells 5 days after transfection(×100).图2 转染后5 d HEC-1B细胞绿色荧光蛋白的表达
3 转染siRNA后HEC-1B细胞中IGF-1R mRNA水平和蛋白水平的变化
在转染后第5 d,分别提取各组细胞的mRNA,进行检测验证其沉默效果,结果显示,siRNA1序列能使HEC-1B细胞的IGF-1R在mRNA水平下降81%。在转染后第7 d,提取细胞蛋白进行Western blotting检测,发现HEC-1B-KD组细胞IGF-1R蛋白水平下降91.5%(P<0.05),见图3、4。通过上述验证实验,证明靶点序列能有效降低HEC-1B细胞中IGF-1R的表达,保证后续实验的顺利进行。
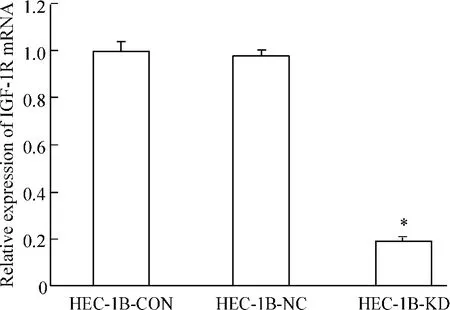
Figure 3.Expression of IGF-1R mRNA in HEC-1B cells after transfection.±s.n=3.*P<0.05 vs HEC-1BCON and HEC-1B-NC.图3 转染后HEC-1B细胞IGF-1R mRNA的表达

Figure 4.Expression of IGF-1R protein in HEC-1B cells after transfection.±s.n=3.*P<0.05 vs HEC-1BCON and HEC-1B-NC.图4 转染后HEC-1B细胞IGF-1R蛋白的表达
4 慢病毒稳定转染后HEC-1B细胞克隆形成能力的变化
稳定转染后进行平板克隆实验检测细胞克隆形成能力,结果发现HEC-1B-KD组细胞形成克隆数目(153±11)明显少于HEC-1B-CON细胞(471 ±7)和HEC-1B-NC细胞(461±11)(P<0.05),而HEC-1B-CON与HEC-1B-NC组细胞之间没有明显差异,见图5。

Figure 5.Colony formation ability of HEC-1B cells after down-regulation of IGF-1R.±s.n=3.*P<0.05 vs HEC-1B-CON and HEC-1B-NC.图5 转染后HEC-1B细胞的克隆形成能力变化
5 慢病毒稳定转染后HEC-1B细胞迁移和侵袭能力的变化
转染7 d后,HEC-1B-KD组迁移细胞相对于HEC-1B-CON组和HEC-1B-NC组明显减少(P<0.05),而HEC-1B-CON组和HEC-1B-NC组没有明显差异,见图6;HEC-1B-KD组侵袭细胞相对于HEC-1B-CON组和HEC-1B-NC组亦有明显减少(P<0.05),见图7。这些结果提示由于IGF-1R表达受到明显抑制,子宫内膜癌细胞HEC-1B的迁移和侵袭能力也受到不同程度的抑制。
6 慢病毒稳定转染后HEC-1B细胞MMP-2和MMP-9 mRNA水平的变化
慢病毒转染7 d后,HEC-1B-KD组细胞MMP-2及MMP-9 mRNA水平明显下降(P<0.05),分别下降了76%和86.5%,见图8。

Figure 6.Inhibition of HEC-1B cells migration after downregulation of IGF-1R.±s.n=3.*P<0.05 vs HEC-1B-CON and HEC-1B-NC.图6 转染后HEC-1B细胞迁移能力的变化

Figure 7.Inhibition of HEC-1B cells invasion after down-regulation of IGF-1R.±s.n=3.*P<0.05 vs HEC-1B-CON and HEC-1B-NC.图7 转染后HEC-1B细胞的侵袭能力变化
讨论
IGF是一类十分重要的生长因子,具有促进细胞增殖、分化等多种生物学活性,参与多种恶性肿瘤的发生与发展过程,如乳腺癌、前列腺癌、肝癌、结直肠癌、肾癌、黑色素瘤等[5]。IGFs系统是一个庞大的家族,包括IGF-1、IGF-2及其受体IGF-1R、IGF-2R和至少6种胰岛素样生长因子结合蛋白(IGF-binding protein,IGF-BP)。
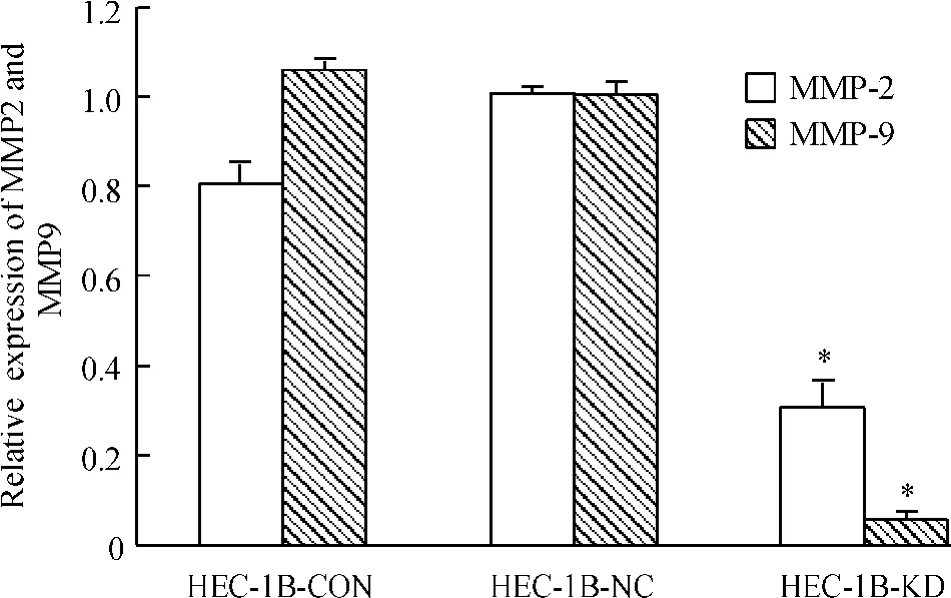
Figure 8.Inhibition of MMP-2 and MMP-9 mRNA expression in HEC-1B cells after down-regulation of IGF-1R.±s.n=3.*P<0.05 vs HEC-1B-CON and HEC-1B-NC.图8转染后HEC-1B细胞MMP-2和MMP-9的表达
IGF-1是酪氨酸激酶生长因子受体家族的成员,由细胞外的2个α亚单位及细胞内2个β亚单位通过二硫键结合形成的二聚体。一旦生长因子结合于该受体,受体β亚单位发生自身磷酸化,同时诱导胰岛素受体底物(insulin receptor substrate,IRS)家族相应衔接蛋白的募集。其中IRS1的激活与肿瘤的增殖和凋亡有关,而IRS2与肿瘤的迁移和转移有关[6]。
IGF-1在多种肿瘤的发生发展过程中起重要作用,已成为肿瘤治疗的新靶点。很多研究数据表明,IGF-IR能调节肿瘤细胞的生长、增殖、代谢。对不同肿瘤的研究发现,抑制IGF-1R水平不仅影响裸鼠肿瘤的生长,还能影响肿瘤的转移。降低结肠癌细胞中IGF-1R的表达后,在裸鼠肝脏上成瘤率明显降低。而在过表达IGF-1R的胰腺癌裸鼠模型中,肿瘤的侵袭力和淋巴转移都显著增加。降低前列腺癌中IGF-1R的表达后肿瘤的生长和转移能力都明显被抑制。在最近的一项研究当中,使用抗IGF-1R表达的抗体作用于裸鼠模型,发现在不影响原发瘤生长的情况下,可以抑制肿瘤的远处转移。上述研究均提示IGF-1R在肿瘤的转移当中起着重要的作用[7]。
IGF-1R在子宫内膜癌中同样表达异常。Mc-Campbell研究发现高表达和活化的IGF-1R与子宫内膜不典型增生和子宫内膜癌的发生密切相关[8]。Pavelié的研究发现IGF-1R在III、IV期子宫内膜癌中的表达显著高于I、II期及正常子宫内膜。提示IGF-1R可能与子宫内膜癌的发展有关[9]。本课题组先前研究过沉默IGF-1R表达对子宫内膜癌有增殖抑制作用,并能增加细胞凋亡[10],但沉默IGF-1R是否能影响子宫内膜癌的侵袭和转移仍然未知。本实验采用RNA干扰技术,使用慢病毒载体,稳定沉默IGF-1R基因的表达,观察了IGF-1R水平降低对子宫内膜癌细胞侵袭能力的影响。结果提示,在细胞迁移实验中,KD组的细胞迁移能力显著下降,在基质侵袭实验中,转染组穿膜细胞较未转染组和载体对照组明显减少,具有显著意义。表明沉默IGF-1R表达可明显降低子宫内膜癌细胞的迁移和侵袭能力。
MMPs是一类依赖Zn2+和Ca2+并可降解细胞外基质 (extracellular matrix,ECM)的蛋白水解酶类[11]。其中MMP-2、MMP-9是MMPs超家族的重要成员,属明胶酶类,能降解明胶、Ⅳ型胶原、纤维连接蛋白、弹力纤维等,其能通过蛋白水解酶的作用降解间质结缔组织和基底膜成份,还可以对生长因子、细胞表面受体、细胞黏附分子或趋化因子的剪切作用来影响肿瘤细胞的生物学行为,在肿瘤侵袭转移过程中发挥重要作用[12-13]。MMP-2和MMP-9与子宫内膜癌的的侵袭转移有十分密切的关系,且随病理分级增高、肌层浸润加深及临床分期升高而呈增加趋势[14-15]。在我们的实验中,同时KD组中与侵袭转移能力相关的MMP-2和MMP-9水平明显下降,提示IGF-1R可能通过影响MMPs的水平来调节子宫内膜癌细胞的侵袭能力。
综上所述,特异靶向IGF-1R的干扰片段能有效抑制子宫内膜癌HEC-1B细胞内源性IGF-1R的表达,降低IGF-1R的表达能抑制子宫内膜癌的迁移和侵袭能力,同时能影响MMP-2和MMP-9的水平。IGF-1R可能成为抑制子宫内膜癌发生、发展、侵袭的的分子治疗靶点。
[1] Jemal A,Siegel R,Xu J,et al.Cancer statistics[J].CA Cancer J Clin,2010,60(5):277-300.
[2] Santern RJ,Fan P,Zhang Z,et al.Estrogen signals via an extra-nuclear pathway involving IGF-1R[J].Steroids,2009,74(7):586-594.
[3] Fagan DH,Yee DJ.Crosstalk between IGF-1R and estrogen receptor signaling in breast cancer[J].Mammary Gland Biol Neoplasia,2008,13(4):423-429.
[4] Baserga R.Customizing the targeting of IGF-1 receptor[J].Future Oncol,2009,5(1):43-50.
[5] Freude S,Schilbach K,Schubert M.The role of IGF-1R receptor and insulin receptor signaling for the disease[J].Curr Alzheimer Res,2009,6(3):213-223.
[6] Gibson SL,Ma Z,Shaw LM.Divergent roles for IRS-1 and IRS-2 in breast cancer metastasis[J].Cell Cycle,2007,6(6):631–637.
[7] Sachdev D,Zhang X,Matise I,et al.The type I insulinlike growth factor receptor regulates cancer metastasis independently of primary tumor growth by promoting invasion and survival[J].Oncogene,2010,29(2):251–262.
[8] McCampbell AS,Broaddus RR,Loose DS,et al.Overexpression of the insulin-like growth factor I receptor and activation of the Akt pathway in hyperplastic endometrium[J].Clin Cancer Res,2006,12(21):6373-6378.
[9] Pavelic J,Radakovic B,Pavelic K,et al.Insulin-like growth factor 2 and its receptors(IGF 1R and IGF 2R/ mannose 6-phosphate)in endometrial adenocarcinoma[J].Gynecol Oncol,2007,105(3):727–735.
[10]Su S,Li X,Yang Y,et al.Inhibitory effect of siRNA targeting IGF-1R on endometrial carcinoma[J].Int Immunopharmacol,2011,11(2):244-249.
[11]戴 琪,黄亚军,高义军.基质金属蛋白酶及其抑制剂与子宫内膜癌[J].国际生殖健康/计划生育杂志,2009,28(3):194-197.
[12]方 茅,杜 彬,钟雪云,等.EGCG通过下调COX-2和MMP-2表达抑制人脑胶质瘤细胞的迁移和侵袭[J].中国病理生理杂志,2010,26(10):1890-1894.
[13]Graesslin O,Cortez A,Uzam C,et al.Endometrial tumor invasiveness is related to metalloproteinase 2 and tissue inhibitor of metalloproteinase 2 expressions[J].Int J Gynecol Cancer,2006,16(5):1911-1917.
[14]Karahan N,Guney M,Baspinar S.Expression of gelatinase (MMP-2 and MMP-9)and cyclooxygenase-2(COX-2)in endometrial carcinoma[J].Eur J Gynaecol Oncol,2007,28(3):184-188.
[15]Weigel MT,Kramer J,Schem C,et al.Differential expression of MMP-2,MMP-9 and PCNA in endometriosis and endometrial carcinoma[J].Eur J Obstet Gynecol Reprod Biol,2012,160(1):74-78.

