miR-21通过下调PTEN增强人脑胶质瘤细胞对卡莫司汀耐药*
胡 婷, 陈梅香, 翁泽平, 谢思明, 钟雪云
(暨南大学医学院病理学系,广东广州510632)
脑胶质瘤是脑内最常见的原发性肿瘤,侵袭性强、恶性进展快,目前,主要采取外科手术联合放、化疗的综合策略进行治疗。卡莫司汀[carmustine,1,3 -bis(2-chloroethyl)-1-nitrosourea,BCNU]是一种烷化剂,属于亚硝基脲类药物,因其高脂溶性和易于通过血脑屏障的特性,被公认为是治疗脑胶质瘤的标准化疗药物[1]。然而,原发性耐药和获得性耐药的产生已成为其化疗失败的主要原因。原发性耐药和获得性耐药的机制复杂且不尽相同,目前相关研究多集中在原发性耐药方面,获得性耐药的具体机制尚不太清楚。
近年来,发现了一类具有转录后调控作用的小分子、非编码的微小RNA(microRNA,miRNA)在肿瘤中异常表达,并能以癌基因或抑癌基因角色参与肿瘤发生发展。人类成熟miRNA至少调控着30%的人类蛋白质编码基因。miRNA在胶质瘤的发生、发展以及耐药等过程中也具有重要作用。具有原癌基因作用的微小RNA-21(microRNA-21,miR-21在脑胶质瘤中常呈过度高表达状态[2],其能影响细胞增殖能力及细胞对多种化疗药物的敏感性,但miR-21在人脑胶质瘤耐BCNU过程中的作用和机制尚不清楚。另外,本实验室从人脑胶质瘤细胞系SWO38中克隆出两株亚系SWOZ1(BCNU原发性耐药株)和SWOZ2(BCNU敏感株),并通过BCNU诱导SWOZ2获得了SWOZ2-BCNU细胞株(BCNU获得性耐药株)[3-4]。本研究通过实时荧光定量 PCR (real-time fluorescence quantitative PCR,RFQPCR)检测SWOZ2及SWOZ2-BCNU细胞中miR-21表达水平并分析其与细胞对BCNU敏感度的关系;通过转染上调SWOZ2中miR-21的表达,进一步探讨miR-21在脑胶质瘤对BCNU产生获得性耐药过程中可能的作用及机制。
材料和方法
1 材料
1.1 主要材料和试剂 BCNU为天津药业公司产品;CCK-8(Cell Counting Kit-8)为日本同仁公司产品;Trizol试剂为Invitrogen产品;PrimeScriptTM逆转录试剂盒、SYBR Premix Ex TaqTM荧光定量PCR试剂盒均为TaKaRa产品;miR-21和U6 snRNA的Bulge -LoopTMmiRNA qRT-PCR Primer Set为广州锐博公司产品;miR-21 mimics和miRNA mimics negative control为上海吉玛公司产品;jetPRIMETMTransfection
Reagent为Polyplus Transfection产品;第10号染色体同源缺失性磷酸酶及张力蛋白(phosphatase and tensin homology deleted on chromosome ten,PTEN)和磷酸化蛋白激酶B(phosphorylated protein kinase B,p -Akt)兔抗人单克隆抗体均为Cell Signaling产品;P -糖蛋白(P-glycoprotein,P-gp)鼠抗人单克隆抗体、0.45 μm硝酸纤维素膜皆为Millipore产品;β-肌动蛋白(β-actin)鼠抗人单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔IgG和 HRP标记山羊抗鼠 IgG均为 Protein Tech Group产品;BCA法蛋白质定量试剂盒为海门碧云天公司产品;ECL底物发光检测试剂盒为Pierce产品。1.2 主要仪器和设备 二氧化碳培养箱为Harris产品;倒置相差显微镜为Olympus产品;ELx800自动酶标仪为Bio-Tek产品;MiniOpticon Real-Time PCR System、垂直电泳仪和电转移仪均为Bio-Rad产品。
2 方法
2.1 细胞培养 人脑胶质瘤细胞株SOWZ2与SWOZ2-BCNU由本实验室建株并冻存保藏[3-4],用含10% 胎牛血清(fetal bovine serum,FBS)的RPMI -1640培养基在37℃、5%CO2、饱和湿度的细胞培养箱中培养,0.25%胰酶+0.02%EDTA消化传代。
2.2 RFQ-PCR检测细胞中miR-21的表达 提取RNA:应用Trizol提取细胞的总RNA,经分光光度计检测,A260/A280值为1.8~2.1的用于cDNA合成。首先,逆转录反应:按说明进行,用PrimeScriptTM逆转录试剂盒,反应体系20μL,62.5 nmol/L miR-21及U6 Bulge-LoopTMmiRNA RT Primer各2 μL,反应条件为37℃ 15 min,85℃ 5 s。其次,RFQPCR:反应体系20 μL,SYBR Premix Ex TaqTM10 μL,5 μmol/L Bulge-LoopTMmiR-21或U6 snRNA上、下游引物各1 μL,cDNA 1 μL,无酶水7 μL,反应条件为95℃预变性20 s,95℃ 10 s,60℃ 20 s,70℃30 s,扩增40个循环。最后,所得数据用2-ΔΔCt评定不同细胞株miR-21相对表达量,ΔCt=CtmiR-21-CtU6,ΔΔCt=ΔCt实验组-ΔCt对照组。
2.3 CCK-8检测BCNU处理后胶质瘤细胞的存活率 将SWOZ2及SWOZ2-BCNU两种细胞在不含药物的培养基中培养48 h,以3 000 cells/well接种于96孔板中,每孔200 μL,24 h后待细胞贴壁加入BCNU,设7个呈2倍递增梯度浓度(2~128 mg/L)、1个不加药物的对照孔,各种药物浓度做3个平行孔。培养72 h后,加入10 μL CCK-8试剂,继续培养4 h后在酶标仪上检测各孔对波长为450 nm的吸光度(A),计算细胞存活率,其计算公式为:存活率= (实验孔A值/对照孔A值)×100%,并通过软件计算出药物作用的半数抑制浓度(the half-maximal inhibitory concentration,IC50)。实验重复3次。
2.4 转染miR-21 mimics 取状态良好、对数生长期的SWOZ2细胞消化、计数,以平均每孔5.0×105个细胞种植于6孔板中。实验组加30 nmol/L miR-21 mimics、200 μL jetPRIMETMBuffer及4 μL jetPRIMETMReagent(命名为转染组或SWOZ2-miR-21 mimics);阴性对照组是将实验组中miR-21 mimics换为同浓度的miRNA mimics negative control,余同实验组(命名为对照组或SWOZ2-miR-control mimics);两组皆用含5%FBS的RPMI-1640。液调至2 mL。24 h后将培养液更换为含10%FBS的RPMI-1640,转染步骤严格按说明书执行。转染48 h后,提取各组细胞总RNA用RFQ-PCR检测miR-21表达量,或提取各组细胞总蛋白用Western blotting检测相关蛋白表达情况;或在转染24 h后消化细胞,并按3 000 cells/well接种于96孔板培养12 h,按以上方法用梯度浓度BCNU处理细胞48 h后用CCK-8检测各组细胞的存活率并计算IC50。
2.5 Western blotting检测胶质瘤细胞相关蛋白的表达 收集细胞,用RIPA细胞裂解液提取蛋白质样品。用BCA法在酶标仪上用570 nm波长测定总蛋白浓度。样本经过SDS-PAGE电泳后,再用电转仪以350 mA恒流1 h转印至硝酸纤维素膜,5%脱脂奶粉室温封闭1 h,分别加入PTEN(1∶1 000)、p-Akt (1∶1 000)、P-gp(1∶500)、内参照 β-actin (1∶2 000),4℃摇床孵育过夜,TBST洗膜3次,每次10 min。再加HRP标记Ⅱ抗(1∶5 000)室温孵育1 h,TBST洗膜3次,每次10 min。ECL化学发光试剂盒显影。
3 统计学处理
结果
1 miR-21在细胞中的表达
1.1 miR-21的表达 SWOZ2和SWOZ2-BCNU细胞中miR-21的表达量分别为1.000±0.079、2. 070±0.138,SWOZ2-BCNU细胞中miR-21的表达量明显高于SWOZ2细胞(P<0.01),见图1。
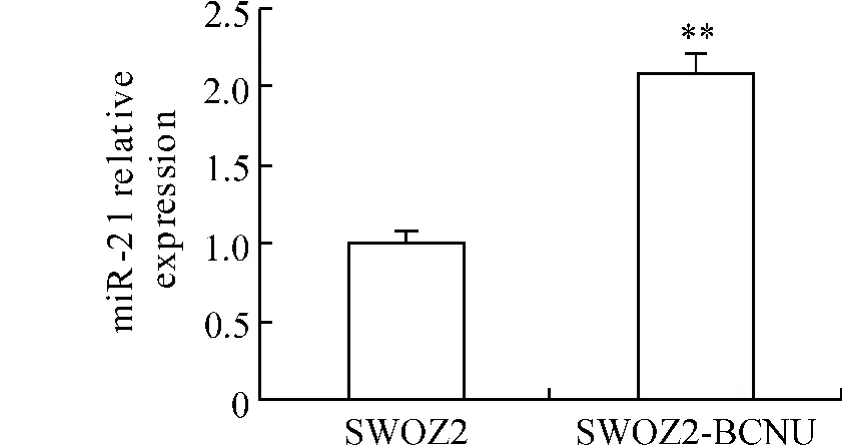
Figure 1.The relative expression of miR-21 in SWOZ2 and SWOZ2-BCNU cells detected by RFQ-PCR.±s.n=3.**P<0.01 vs SWOZ2.图1RFQ-PCR检测SWOZ2和SWOZ2-BCNU细胞中miR-21的表达
1.2 SWOZ2细胞转染miR-21 mimics后miR-21的表达 转染组miR-21的相对表达量(2 112.390 ±273.446)明显高于对照组(1.000±0.069)(P<0.01),见图2。

Figure 2.The relative expression of miR-21 in SWOZ2 cells transfected with miR-21 mimics or miR-control mimics for 48 h detected by RFQ-PCR.±s.n= 3.**P<0.01 vs miR-control mimics(control).图2RFQ-PCR检测SWOZ2细胞转染miR-21 mimics或miR-control mimics 48 h后miR-21的表达
2 细胞对BCNU的敏感性
2.1 SWOZ2-BCNU细胞对BCNU的耐药性高于SWOZ2BCNU处理后SWOZ2-BCNU细胞的存活率高于SWOZ2细胞,见图3;BCNU对SWOZ2和SWOZ2 -BCNU细胞的IC50分别为(25.160±2.604)mg/L和(58.800±9.264)mg/L,SWOZ2-BCNU细胞对BCNU的耐药指数为2.34,明显高于SWOZ2细胞(P<0.05),见图4。
2.2 SWOZ2细胞转染miR-21 mimics后对BCNU耐药性的变化 转染组细胞的存活率高于对照组,见图5;BCNU对转染组和对照组细胞的IC50分别为(48.020±0.698)mg/L和(35.460±1.796)mg/L,转染组细胞对BCNU的耐药性明显高于对照组(P<0.01),见图6。

Figure 3.The viability of SWOZ2 and SWOZ2-BCNU cells treated with BCNU for 72 h detected by CCK-8 assay.±s.n=3.图3CCK-8检测BCNU处理72 h后SWOZ2和SWOZ2-BCNU细胞的存活率

Figure 4.The IC50of BCNU for SWOZ2 and SWOZ2-BCNU cells 72 h after treatment detected by CCK-8 assay.±s.n=3.*P<0.05 vs SWOZ2.图4CCK-8检测BCNU处理72h后SWOZ2和SWOZ2-BCNU的IC50
3 Western blotting检测细胞中相关蛋白的表达
3.1 SWOZ2和SWOZ2-BCNU细胞中PTEN、p-Akt和P-gp蛋白的表达 与SWOZ2细胞相比,SWOZ2-BCNU细胞中PTEN蛋白表达量明显下降(P<0.01),而 p-Akt的表达量明显升高(P<0.05),P-gp的表达量也明显升高(P<0.01),见图7。

Figure 5.The viability of SWOZ2 cells transfected with miR-21 mimics or miR-control mimics 48 h after BCNU treatment detected by CCK-8 assay.±s.n=3.图5 CCK-8检测BCNU处理转染miR-21 mimics或miR-control mimics的SWOZ2细胞48 h后细胞的存活率

Figure 6.The IC50of BCNU for SWOZ2 cells transfected with miR-21 mimics or miR-control mimics 48 h after treatment detected by CCK-8 assay..n=3.**P<0.01 vs miR-control mimics.图6 CCK-8检测BCNU处理48 h后对转染了miR-21 mimics或miR-control mimics的SWOZ2细胞的IC50

Figure 7.The relative expression of PTEN,p-Akt and P-gp in SWOZ2 and SWOZ2-BCNU cells detected by Western blotting. s.n=3.*P<0.05,**P<0.01 vs SWOZ2.图7 Western blotting检测SWOZ2和SWOZ2-BCNU细胞中PTEN和p-Akt的表达
3.2 转染miR-21 mimics对SWOZ2细胞中PTEN、p-Akt和P-gp表达的影响 与对照组相比,转染组细胞中PTEN蛋白表达量明显降低 (P<0.01),而p-Akt的表达量则明显升高(P<0.01),P-gp的表达量也明显升高(P<0.01),见图8。
该结果表明,在miR-21表达上调的细胞中PTEN蛋白表达下降,而p-Akt和P-gp蛋白表达增加。

Figure 8.The relative expression of PTEN,p-Akt and P-gp in SWOZ2 cells transfected with miR-21 mimics or miR-control mimics for 48 h detected by Western blotting.±s.n=3.**P<0.01 vs miR-control mimics.图8 Western blotting检测转染miR-21 mimics或miR-control mimics 48 h后SWOZ2细胞中PTEN和p-Akt的表达
讨论
化疗是治疗人脑胶质瘤的一种重要手段,耐药性的产生是其治疗的重大障碍。肿瘤细胞的耐药性包括原发性耐药和获得性耐药。细胞耐药的主要机制包括:(1)多种糖蛋白介导的药物外排泵机制,包括P-gp、多药耐药相关蛋白(multidrug resistance associated protein,MRP)、肺耐药相关蛋白(lung resistance-associated protein,LRP)、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)等,这些蛋白均为能量依赖性药物外排泵,可将细胞内的药物转运出细胞,导致细胞内药物浓度减低而产生耐药。(2)酶介导的耐药机制,包括谷胱甘肽S-转移酶(glutathione S-transferases,GST),能催化药物与谷胱甘肽结合,形成水溶性较高的复合物,促进药物从体内排泄。拓扑异构酶Ⅱ(topoisomorasesⅡ,TopoⅡ),能与药物结合,促进DNA断裂。蛋白激酶C能诱导多药耐药基因1(multidrug resistance-1,mdr1)表达,促进P-gp磷酸化。(3)凋亡调控基因介导的耐药,其中与耐药相关的基因有B淋巴细胞瘤2(B -cell lymphoma,bcl-2)、生存素(survivin)、骨髓细胞瘤癌基因(myelocytomatosis oncogene,c-myc);抑癌基因p53及PTEN等抑癌基因。(4)信号转导通路异常介导的耐药,如磷酸肌醇-3激酶/蛋白激酶B (phosphoinositide 3-kinase/protein kinase B,PI3K/ Akt)通路及核因子κB(nuclear factor kappa B,NF-κB)信号转导通路激活导致的细胞多药耐药[5]。但有关耐药方面的研究多没有严格区分原发性耐药或是获得性耐药,有关脑胶质瘤对BCNU产生获得性耐药的机制依然不甚清楚。
新近的研究发现,具有转录后调控作用的小分子、非编码miRNA在细胞的分化、增殖、凋亡、胚胎发育等生命活动中具有重要作用,在肿瘤的发生、发展、侵袭、耐药以及诊断和预后等方面也具有重要作用。自1993年发现lin-4以来,目前,miRNA基因序列数据库(http://www.mirbase.org/Release 18: November 2011)已收录了动植物及病毒等成熟miRNA 18 226条,其中人类的为1 527条。
与小干扰RNA完全互补的作用方式不同,miRNA与靶mRNA的相互作用是以完全互补或部分互补的方式相结合的,一种miRNA可作用于多种mRNA,多个miRNA也可协同作用于同一个mRNA[6]。miRNA可能是基因调控网络的关键节点、可能是肿瘤治疗的有效新靶点。
在脑胶质瘤中,miR-21、miR-125b、miR-221、miR-222和miR-10b等17个miRNA呈过度高表达,而miR-7、miR-181a/b/c、miR-124、miR -137和 miR-128等33个 miRNA的表达下调[7-8]。具有原癌基因活性的miR-21位于染色体的脆性区域17q23.2。miR-21在乳腺癌、肝癌以及脑胶质瘤等多种恶性肿瘤中高表达,与肿瘤的恶性分级正相关。在不同级别胶质瘤中,胶质母细胞瘤(glioblastoma,GBM)中miR-21的表达上调最明显,miR-21可作为GBM的独立预后指标[9]。敲除GBM细胞中的miR-21,细胞生长受抑、凋亡增强、侵袭能力减弱并可抑制肿瘤的发生。本研究通过RFQ-PCR分析发现,SWOZ2-BCNU细胞(BCNU获得性耐药株)中 miR-21的表达量较其亲本SWOZ2细胞(BCNU敏感株)明显升高。为进一步观察miR-21在胶质瘤细胞对BCNU耐药过程中的作用,本研究将miR-21 mimics和阴性对照序列分别转入SWOZ2细胞,继而用RFQ-PCR检测两组细胞miR-21的表达,发现:与对照组相比,转染组SWOZ2-miR-21-mimics细胞中,miR-21的表达显著上调,转染组细胞对BCNU的耐药性亦明显升高。这些结果表明,miR-21表达上调后可介导脑胶质瘤细胞对BCNU产生获得性耐药。相关研究也发现了类似的结果:Li等[10]在多形性胶质母细胞瘤中发现,抑制miR-21的功能可上调靶因子富亮氨酸重复序列相互作用蛋白1(leucine-rich repeat flightless-interacting protein 1,LRRFIP1)的表达,进而导致NF-κB的活化,导致胶质瘤细胞对化疗药物替尼泊甙敏感性增强;Shi等[11]在U87MG中发现,过表达miR-21可降低Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)和半胱氨酸蛋白酶 3 (caspase-3)的表达、降低Bax/Bcl-2的比值,进而抑制替莫唑胺诱导的凋亡。这些结果表明,脑胶质瘤中miR-21表达的上调可介导细胞对化疗药物耐药。
在遗传背景相同的细胞中,miR-21可能是通过转录后调控某些蛋白的表达进而介导细胞对BCNU发生获得性耐药。有研究发现,在肝细胞癌、乳腺癌等多种肿瘤中,抑癌因子PTEN是miR-21的直接靶标[12]。在脑胶质瘤,特别是高级别的脑胶质瘤中,PTEN基因常发生突变或缺失、PTEN蛋白表达常呈下调或缺失状态。PTEN蛋白是PI3K/Akt通路的负性调节因子,PTEN可参与引起脑胶质瘤对药物耐药[13]。本研究通过Western blotting分析发现,相对于亲本细胞SWOZ2而言,在miR-21高表达且耐BCNU的SWOZ2-BCNU细胞中,PTEN蛋白的表达明显下调,而p-Akt和P-gp的表达却明显上调。本研究进一步通过转染和相关分析,发现:与对照组相比,上调miR-21表达后的转染组细胞,不仅对BCNU的耐药性明显增强,而且其细胞中PTEN蛋白表达明显下调、p-Akt和P-gp蛋白表达明显上调。PTEN蛋白是PI3K/Akt通路的负性调节因子,转染组细胞PTEN蛋白表达下调后可激活PI3K/Akt通路并导致p-Akt表达上调。相关研究也发现:在乳腺癌、白血病中,miR-21能下调PTEN蛋白的表达进而引起细胞对化疗药物耐药[14-15];激活p-Akt可上调P-gp进而引起胃癌细胞的多药耐药[16]。本研究结果和相关资料表明,在脑胶质瘤细胞中,上调miR-21可降低PTEN蛋白的表达、激活PI3K/Akt通路,继而上调P-gp表达,进而介导细胞对BCNU耐药。
BCNU上调miR-21表达的具体机制尚不清楚。BCNU可上调脂多糖(lipopolysaccharide,LPS)进而增加细胞因子白细胞介素6(interleukin 6,IL-6)等的释放[17-18];信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)在多种恶性肿瘤以及脑胶质瘤中高表达,IL-6可通过激活的STAT3靶向上调miR-21促进多发性骨髓瘤细胞的存活[19]。这些资料表明,BCNU或许可通过上调LPS、增加IL-6的释放继而激活STAT3,进而上调miR-21的表达。但在BCNU诱导耐药的SWOZ2-BCNU细胞中,miR-21的表达上调是否由LPS/IL-6/STAT3调控尚需进一步研究。
在胶质瘤中,miR-21还可靶向作用于基质金属蛋白酶抑制因子Kazal基序逆向诱导半胱氨酸丰富蛋白(reversion-inducing-cysteine-rich protein with Kazal motifs,RECK)、金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase,TIMP)、程序性细胞死亡因子4、异质核核糖核蛋白K、转录激活型p63(transcription activation p63,TAp63)和LRRFIP1,参与调节p53、转化生长因子β(transforming growth factor beta,TGF-β)、线粒体凋亡、NF-κB、Bcl-2、表皮生长因子受体(epidermal growth factor receptor,EGFR)通路等[20]。总之,作为一种致癌基因的miR -21可参与调节多条信号通路中多种肿瘤相关蛋白的表达,进而促进细胞生长、抑制凋亡、提高肿瘤的耐药性;miR-21可能是基因调控网络中的关键节点,靶作用于miR-21或许能发挥“单击多靶”效应,miR-21可能是脑胶质瘤等恶性肿瘤治疗的一个有效靶标。然而,miR-21在细胞内的分子调控网络是错综复杂的,细胞调控miR-21表达的具体机制仍有待深入探究。
[1] Wen PY,Kesari S.Malignant gliomas in adults[J].N Engl J Med,2008,359(5):492-507.
[2] Conti A,Aguennouz M,La Torre D,et al.miR-21 and 221 upregulation and miR-181b downregulation in human grade II-IV astrocytic tumors[J].J Neurooncol,2009,93(3):325-332.
[3] Lin CL,Wang MH,Qin YF,et al.Differentiation of SWO-38 glioma cells induced by CDA-2 is mediated by peroxisome proliferator-activated receptor gamma[J].J Neurooncol,2009,95(1):29-36.
[4] Xie SM,Fang M,Guo H,et al.Silencing of MGMT with small interference RNA reversed resistance in human BCNU-resistant glioma cell lines[J].Chin Med J(Engl),2011,124(17):2605-2610.
[5] 成志勇,梁文同,底胜峰,等.PTEN信号转导通路与肿瘤的多药耐药[J].中国肿瘤生物治疗杂志,2009,16 (4):413-417.
[6] Lim LP,Lau NC,Garrett-Engele P,et al.Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs[J].Nature,2005,433 (7027):769-773.
[7] Godlewski J,Nowicki MO,Bronisz A,et al.Targeting of the Bmi-1 oncogene/stem cell renewal factor by microRNA-128 inhibits glioma proliferation and self-renewal[J].Cancer Res,2008,68(22):9125-9130.
[8] Silber J,Lim DA,Petritsch C,et al.miR-124 and miR -137 inhibit proliferation of glioblastoma multiforme cells and induce differentiation of brain tumor stem cells[J]. BMC Med,2008,6(14):1-17.
[9] Zhi F,Chen X,Wang S,et al.The use of hsa-miR-21,hsa-miR-181b and hsa-miR-106a as prognostic indicators of astrocytoma[J].Eur J Cancer,2010,46 (9):1640-1649.
[10] Li Y,Li W,Yang Y,et al.MicroRNA-21 targets LRRFIP1 and contributes to VM-26 resistance in glioblastoma multiforme[J].Brain Res,2009,1286:13-18.
[11] Shi L,Chen J,Yang J,et al.MiR-21 protected human glioblastoma U87MG cells from chemotherapeutic drug temozolomide induced apoptosis by decreasing Bax/Bcl-2 ratio and caspase-3 activity[J].Brain Res,2010,1352:255-264.
[12] Roy S,Khanna S,Hussain SR,et al.MicroRNA expression in response to murine myocardial infarction:miR-21 regulates fibroblast metalloprotease-2 via phosphatase and tensin homologue[J].Cardiovasc Res,2009,82 (1):21-29.
[13] Panner A,Crane CA,Weng C,et al.A novel PTEN-dependent link to ubiquitination controls FLIPS stability and TRAIL sensitivity in glioblastoma multiforme[J]. Cancer Res,2009,69(20):7911-7916.
[14] Gong C,Yao Y,Wang Y,et al.Up-regulation of miR -21 mediates resistance to trastuzumab therapy for breast cancer[J].J Biol Chem,2011,286(21):19127-19137.
[15] Bai H,Xu R,Cao Z,et al.Involvement of miR-21 in resistance to daunorubicin by regulating PTEN expression in the leukaemia K562 cell line[J].FEBS Lett,2011,585(2):402-408.
[16] Han Z,Hong L,Han Y,et al.Phospho Akt mediates multidrug resistance of gastric cancer cells through regulation of P-gp,Bcl-2 and Bax[J].J Exp Clin Cancer Res,2007,26(2):261-268.
[17] Haddad JJ,Land SC.Redox signaling-mediated regulation of lipopolysaccharide-induced proinflammatory cytokine biosynthesis in alveolar epithelial cells[J].Antioxid Redox Signal,2002,4(1):179-193.
[18] 石 榴,李 理,袁伟峰,等.RNAi沉默NF-κB p65对小鼠巨噬细胞细胞因子表达的影响[J].中国病理生理杂志,2011,27(7):1264-1269.
[19] Löffler D,Brocke-Heidrich K,Pfeifer G,et al.Interleukin-6 dependent survival of multiple myeloma cells involves the Stat3-mediated induction of microRNA-21 through a highly conserved enhancer[J].Blood,2007,110(4):1330-1333.
[20] 胡 婷,钟雪云.MicroRNA在脑胶质瘤中的作用[J].中国病理生理杂志,2011,27(7):1431-1437,1444.

