煤质活性炭对Cr(Ⅵ)和As(Ⅲ)的吸附及其影响因素
吴云海,蒋 力,戴 琦,朱 亮,刘敏敏
(1.河海大学环境科学与工程学院,江苏 南京 210098; 2.南京大学宜兴环保科技研发中心,江苏 宜兴 214200)
目前冶炼、电解、医药、油漆、合金和电镀制造等行业每年排放大量含有铬、砷离子的工业废水[1]。这些废水中的铬、砷离子其化合物能在鱼类及其他水生生物体内富集,通过饮水和食物链对人类和周围的生态环境造成严重的危害[2-3]。因此,减少铬、砷污染危害,一直是国内外工业界与环保部门的重点研究课题[4-5]。
活性炭作为一种非极性吸附剂,来源丰富,是目前水处理中应用最广的吸附剂之一[6-7]。它具有良好的吸附性能和稳定的化学性质,可以耐强酸、强碱,能经受水浸、高温和高压作用,吸附效果良好,同时还可以活化再生[8-10]。
笔者采用煤质活性炭作为吸附剂,研究了在不同pH值、温度条件下对铬、砷吸附效果的影响,并且将两者的实验结果进行比较,旨在为铬、砷水溶液处理研究提供一些依据。
1 实验部分
1.1 实验材料
重铬酸钾、丙酮、浓硫酸(V=98%)、磷酸(V=85%)、二苯基碳酰二肼、三氯甲烷、二乙基二硫代氨基甲酸银、氯化亚锡、碘化钾、乙酸铅、三乙醇胺,以上试剂均为分析纯。
将煤质活性炭(购于溧阳竹溪活性炭有限公司,粒径300~600μm,比表面积(1000±50)m2/g,表观密度0.5~0.6)用蒸馏水煮沸20min后冷却至室温,然后放置在105℃的烘干箱内干燥24h,冷却得到洗净的煤质活性炭,备用。
1.2 实验仪器
UV-1201紫外分光光度计(北京瑞利分析仪器公司)、SKF-6A超声清洗器(上海科导超声仪器有限公司)、电热恒温干燥箱(南京实验仪器厂)、pH计(6010型) 、电子天平、水浴恒温振荡器。
1.3 实验方法
1.3.1 pH值影响实验
a. 取100mL质量浓度为10mg/L 的Cr(Ⅵ)水溶液置于5个250mL锥形瓶中,分别调节pH为2、4、5、6、8,加入0.2g煤质活性炭,在温度为30℃、振荡速率130r/min条件下振荡。6h后,取样测定上清液中Cr(Ⅵ)的质量浓度。
b. 取100mL质量浓度为0.5mg/L 的As(Ⅲ)水溶液置于5个250mL锥形瓶中,分别调节pH值为2、4、5、6、8,加入0.2g煤质活性炭,在温度为30℃、振荡速率130r/min条件下振荡。6h后,取样测定上清液中As(Ⅲ)的质量浓度。
1.3.2 温度影响实验
a. 取100mL质量浓度为10mg/L的Cr(Ⅵ)水溶液置于5个250mL锥形瓶中,加入0.2g活性炭,在转速为130r/min、pH=2、温度为20℃、25℃、30℃、35℃、40℃的条件下震荡。6h后,测定上清液中Cr(Ⅵ)的质量浓度。
b. 取100mL质量浓度为0.5mg/L的As(Ⅲ)水溶液置于5个250mL锥形瓶中,加入0.2g活性炭,在转速为130r/min、pH=5、温度为20℃、25℃、30℃、35℃、40℃的条件下震荡。6h后,测定上清液中As(Ⅲ)的质量浓度。
1.3.3 等温吸附实验
a. 取100mL质量浓度为10mg/L的Cr(Ⅵ)水溶液放置于5个250mL锥形瓶中,分别向其中投加不同量的活性炭(0.1g、0.2g、0.3g 、0.4g 、0.5g),在振荡速率为130r/min、pH=2、温度分别为25℃、30℃、35℃的条件下震荡至吸附平衡。测定5个锥形瓶上清液中的Cr(Ⅵ)质量浓度。
b. 取100mL质量浓度为0.5mg/L 的As(Ⅲ)水溶液放置于5个250mL锥形瓶中,分别向其中投加不同量的活性炭(0.1g、0.2g、0.3g 、0.4g 、0.5g),在振荡速率为130r/min、pH=5、温度分别为25℃、30℃、35℃的条件下震荡至吸附平衡。测定5个锥形瓶上清液中的As(Ⅲ)质量浓度。
1.3.4 动力学实验
a. 取100mL质量浓度为10mg/L 的Cr(Ⅵ)水溶液置于5个250mL锥形瓶中,加入0.2g活性炭,在转速为130r/min、pH=2、温度分别为25℃、30℃、35℃的条件下震荡。 分别在60min、120min、240min、300min、360min、420min、480min时取样,测定上清液中Cr(Ⅵ)的质量浓度。
b. 取100mL质量浓度为0.5mg/L的As(Ⅲ)水溶液置于5个250mL锥形瓶中,加入0.2g活性炭,在转速为130r/min、pH=5、温度分别为25℃、30℃、35℃的条件下震荡。分别在20min、40min、60min、120min、240min、300min、360min时取样,测定上清液中As(Ⅲ)的质量浓度。
1.4 分析方法
实验中Cr(Ⅵ)质量浓度的测定方法采用GB7466—87《二苯碳酰二肼分光光度法》,As(Ⅲ)质量浓度的测定采用GB7485—87《二乙基二硫代氨基甲酸银分光光度法》。
Cr(Ⅵ) 和As(Ⅲ)的平衡吸附量按下式计算:
(1)
式中:qe为平衡时的固相质量比,mg/g;V为水溶液体积,L;ρ0为金属离子的初始质量浓度,mg/L;ρe为离子吸附平衡时的质量浓度,mg/L;M为吸附剂的质量,g。
2 结果讨论与分析
2.1 pH的影响

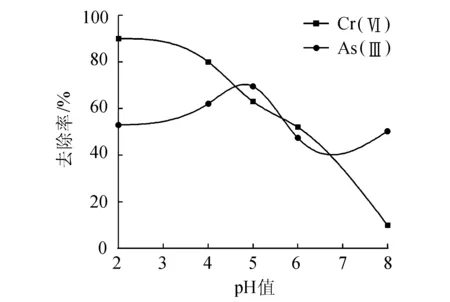
图1 pH值对Cr(Ⅵ)和As(Ⅲ)吸附的影响
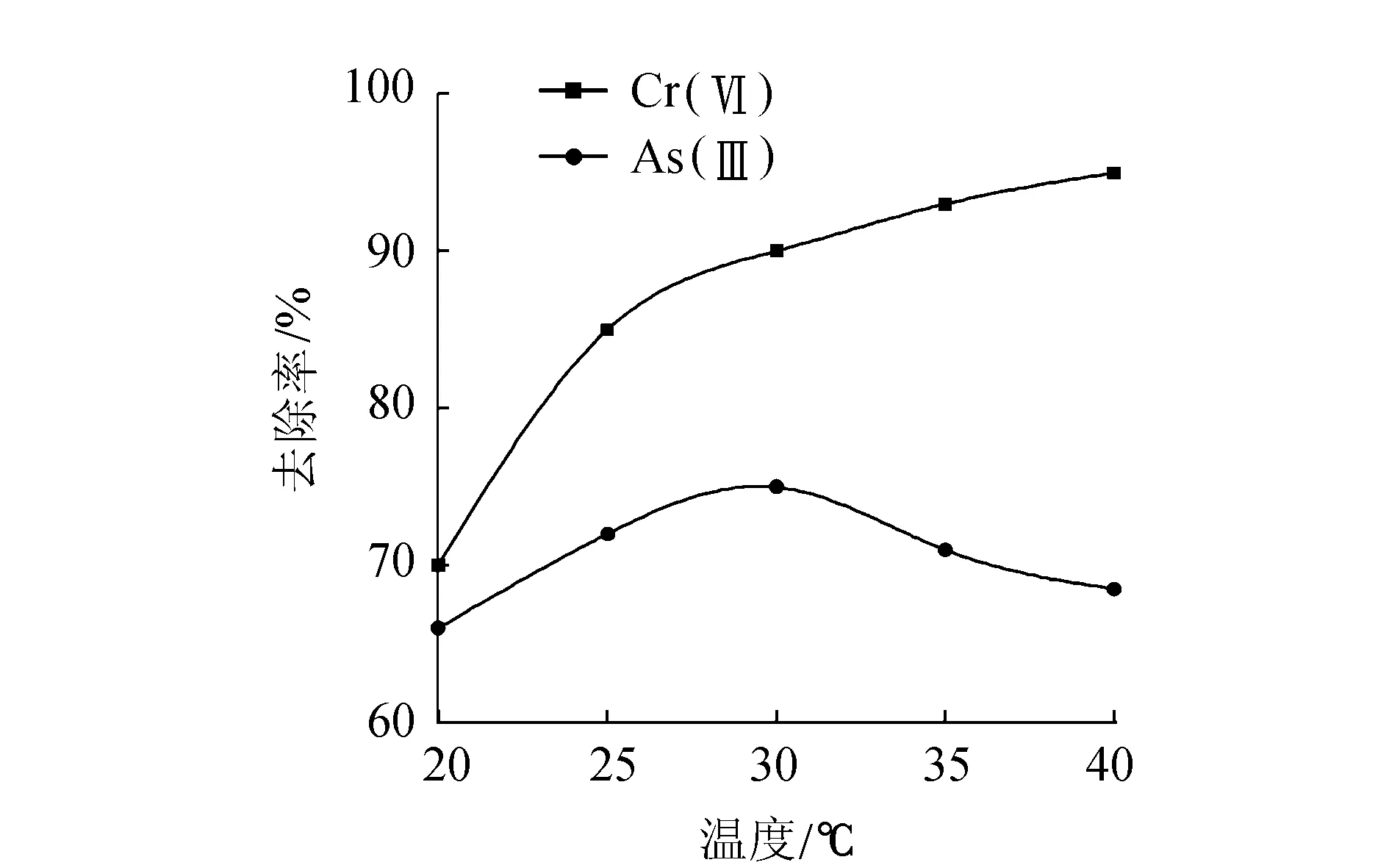
图2 温度对Cr(Ⅵ)和As(Ⅲ)吸附的影响
从图1中曲线可以看出:溶液pH值在2~5.5范围内,砷的去除率较好,在pH=5时达到峰值73.5%。在酸性条件下,溶液中的砷是以HAsO2型体为主要存在形态的,当pH=2~5.5时,活性炭对砷有很好的吸附效果,活性炭吸附的主要是溶液中的AsO2-[18]。当pH>5时,吸附量开始降低,当pH值升高至7时,去除率降到最低点,这可能由于As(Ⅲ)的存在形式发生变化,导致对活性炭的亲和力下降造成的。pH值继续升高至弱碱性条件下,砷的去除率小幅升高,但总体低于pH值较低时的去除率。这是因为在碱性条件下,OH-与活性炭的亲和力要比AsO2-好,活性炭表面的吸附位置被OH-占据,导致吸附效果变差[19]。
2.2 温度的影响
温度对重金属的吸附过程有着重要影响[6]。如图2所示,初始质量浓度为10mg/L的Cr(Ⅵ)水溶液在温度从20℃升至40℃时,随着温度升高,吸附率也随之增加。在较高温下,吸附剂与被吸附物之间发生了化学反应,生成了新的吸附位点或是提高了Cr(Ⅵ)扩散到吸附剂微孔内的速率[17]。
对于As(Ⅲ),当溶液温度在20℃至40℃之间变化时,活性炭对As(Ⅲ)的吸附率先增加,随后逐渐减少,在温度为30℃时,吸附量最大,达到了75%。这可能是由于pH值为5时,溶液中的As(Ⅲ)主要以H3AsO3形态存在,溶质和活性炭表面之间的范德华力起主要作用[20],溶质分子并没有被固定在活性位点上,而是在分界面处做平移运动。当温度在从20℃增加至30℃的时候,由于温度的升高,溶液中吸附质的活动逐渐加剧,导致更多吸附质与活性炭表面接触,从而使溶质与活性炭表面的相互作用的几率增加,吸附量升高[21]。但当温度过高时,溶质活动将过于活跃,导致一部分质子挣脱与活性炭表面的范德华力作用,使得解吸附速率逐渐变大,吸附量反而有所降低。
2.3 吸附等温线
描述水溶液中吸附过程等温线通常有Langmuir吸附等温模型和Freundlich吸附等温模型[10]。两种模型的表达式如下:
Langmuir吸附等温式(单分子层吸附)
(2)
Freundlich吸附等温式
qe=KFρen
(3)
式中:Q0为构成单分子层吸附时的饱和吸附量,mg/g;b为Langmuir等温线常数,L/mg;KF为与温度、吸附剂比表面积等因素有关的常数,(mg/g)·(L/mg)n。
由图3及表1可知,Langmuir吸附等温式拟合所得的相关系数R2要大于Freundlich等温式,因此,Langmuir吸附等温式能更好地拟合本实验所得的数据,,同时也表明Cr(Ⅵ)和As(Ⅲ)的吸附是单分子层吸附。由Langmuir吸附等温式计算得出Cr(Ⅵ)和As(Ⅲ)的饱和吸附质量比分别为7.5656mg/g 和0.3371mg/g,这表明活性炭对Cr(Ⅵ)的吸附能力要远远大于对As(Ⅲ)的吸附能力。Freundlich等温式中n值的大小表明吸附过程是否顺利,从拟合结果可以看出,Cr(Ⅵ)和As(Ⅲ)拟合结果的n值均大于1,说明吸附过程是自然顺利进行的。
2.4 吸附动力学
重金属在煤质活性炭颗粒表面的吸附动力学数据使用以下两种动力学模型进行拟合[11-12]。
a. Pseudo-first-order模型。
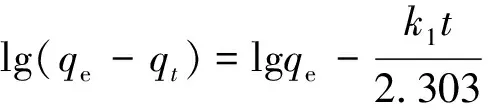
(4)
式中:qt为时间t时吸附量;k1为一级吸附速率常数。
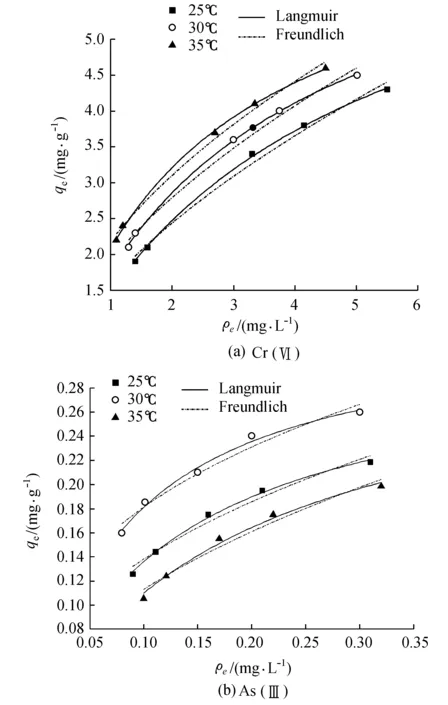
图3 吸附等温线
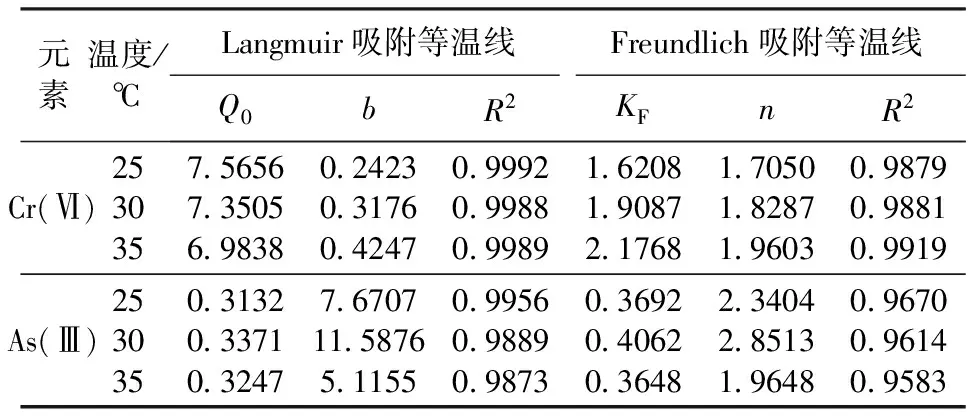
表1 Langmuir和Freundlich吸附等温线的拟合参数和相关系数
b. pseudo-second-order模型。
(5)
式中:k2为二级吸附速率常数。
拟合回归数据见表2。
由表2数据可以看出,两种模型对动力学数据都有较好的适用性(R2>0.9)。同时也可以发现,活性炭用Pseudo-second-order吸附速率方程回归的线性相关系数(R2>0.99)明显大于用Pseudo-first-order吸附速率方程回归的线性相关系数,煤质活性炭对Cr(Ⅵ)和As(Ⅲ)的吸附过程更符合Pseudo-second-order动力学方程,这表明Cr(Ⅵ)和As(Ⅲ)在活性炭表面的吸附是以化学吸附为主的过程[18]。
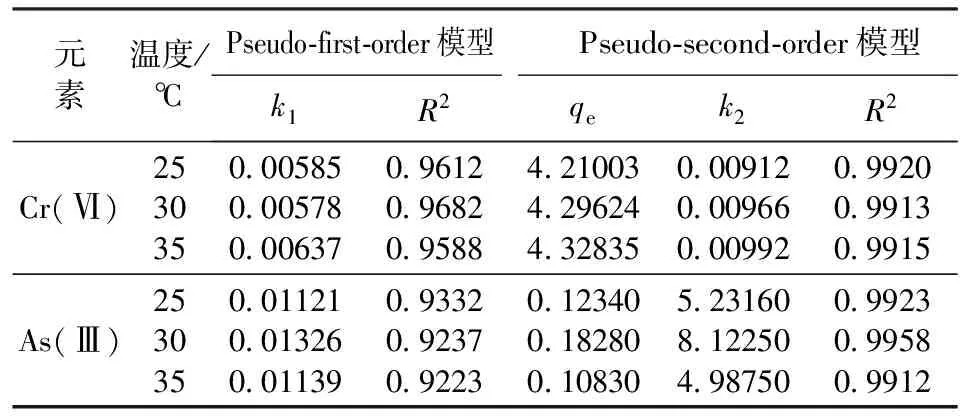
表2 Pseudo-first-order速率方程和Pseudo-second-order速率方程回归拟合参数和相关系数
2.5 热力学参数
热力学参数ΔG°、ΔH°和ΔS°的的相互关系表达式如下:
(6)
ΔG°=-RTlnK0
(7)
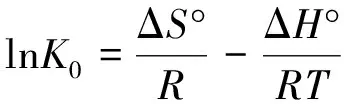
(8)
式中:R为摩尔气体常数,R=8.314510J/(mol·K);T为热力学温度,K;K0为平衡常数;ρad和ρe分别为吸附后溶液减少的质量浓度和平衡质量浓度,mg/L;ΔH°和ΔS°分别为lnK0对1/T线性关系图的斜率和截距。其数据拟合结果见图4和表3。
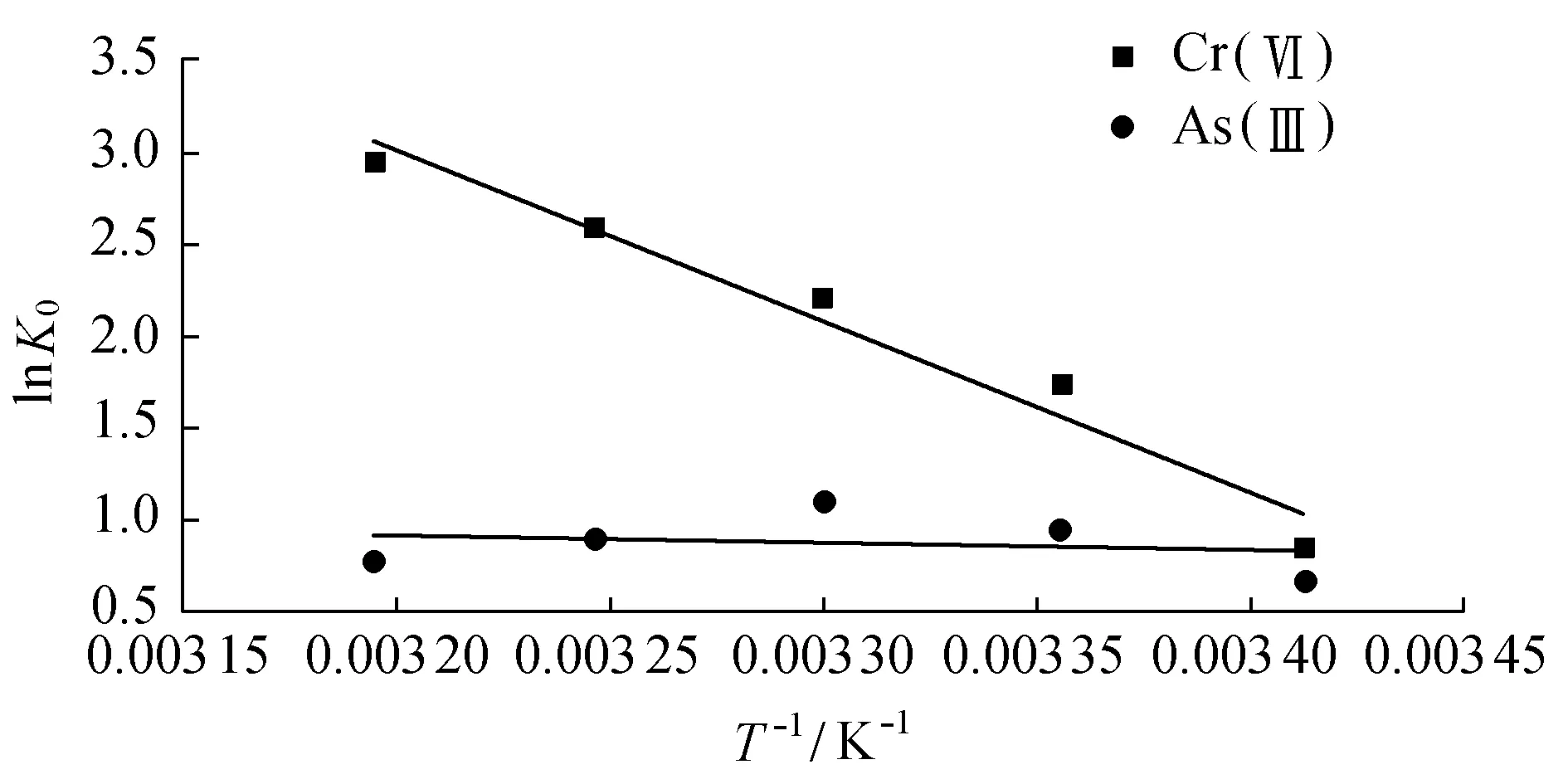
图4 lnK0对1/T的热力学参数估计
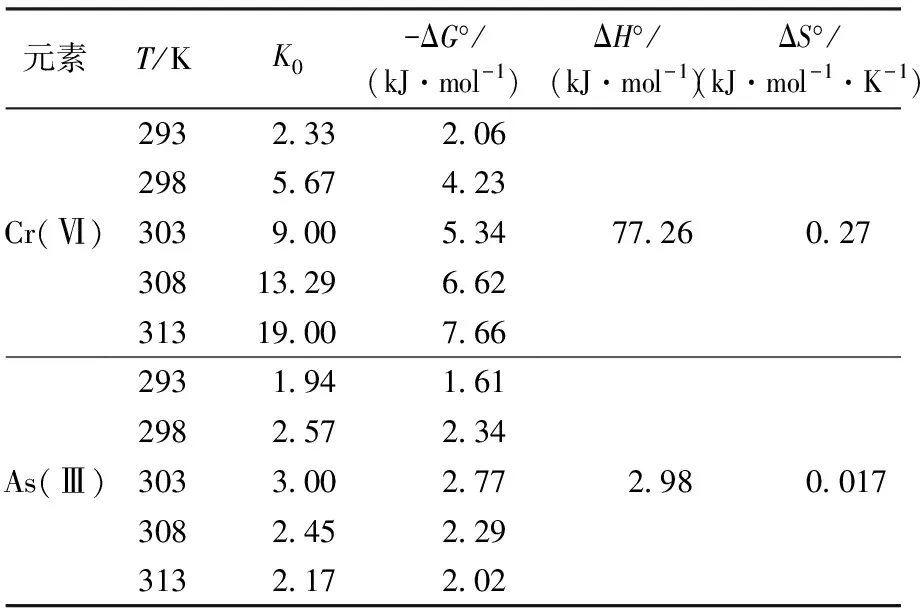
表3 活性炭吸附Cr(Ⅵ)和As(Ⅲ)的热力学参数
由表3可知,ΔG°为负值表明吸附过程是自发进行的,并且负值随着温度的增加而逐渐增加说明温度的升高有利于吸附过程的进行。ΔS°为正值表明了在吸附过程中,系统固液面吸附的随机性是随着吸附过称的进行而逐渐增加的。ΔH°为正值则表明了该吸附是一个自然吸热的过程[22]。
3 结 论
a. 主要考察活性炭吸附Cr(Ⅵ)和As(Ⅲ)的影响因子为pH值、温度和吸附时间。活性炭对Cr(Ⅵ)有较好的吸附作用,温度对Cr(Ⅵ)吸附率的影响较大,而As(Ⅲ)则能在较短的时间内达到吸附平衡。
b. 活性炭对Cr(Ⅵ)和As(Ⅲ)的吸附过程可用Pseudo-second-order模型较好地描述。活性炭吸附Cr(Ⅵ)和As(Ⅲ)符合Langmuir吸附等温式,这表明活性炭对Cr(Ⅵ) 和As(Ⅲ)的吸附是单分子层吸附。
c. 活性炭对Cr(Ⅵ)和As(Ⅲ)的吸附是一个自发进行的自然吸热过程。
[1] 施红,吴云海,杜冰,等.活性炭吸附法去除水溶液中重金属的研究进展[J].江苏环境科技,2006,19(2):110-113.
[2] 王心成.活性炭及其应用[J].酿酒科技,2004(4):99-100.
[3] 于洪斌,丁蕴铮.活性炭在水处理中的应用方法研究与进展[J].工业水处理,2003,23(8):12-16.
[4] JAIN M,GARG V K,KADIRVELU K.Chromium(Ⅵ) removal from aqueous system using Helianthus annuus(sunflower) stem waste[J].Journal of Hazardous Materials,2009,162:365-372.
[5] SINGH T S,PANT K K.Equilibrium,kinetics and thermodynamic studies for adsorption of As(Ⅲ) on activated alumina[J].Separation and Purification Technology,2004,36:139-147.
[6] HUANG Guo-lin,SHI J X,LANGRISH T A G.Removal of Cr(Ⅵ) from aqueous solution using activated carbon modified with nitric acid[J].Chemical Engineering Journal,2009,152:434-439.
[7] DEMIRAL H,DEMIRAL I,TUMSEK F,et al.Adsorption of chromium(Ⅵ) from aqueous solution by activated carbon derived from olive bagasse and applicability of different adsorption models[J].Chemical Engineering Journal,2008,144:188-196.
[8] RAO M,PARWATE A V,BHOLE A G.Removal of Cr6+and Ni2+from aqueous solution using bagasse and fly ash[J].Waste Manage,2002,22:821-830.
[9] GUPTA S,BABUB V.Removal of toxic mental Cr(Ⅵ) from aqueous solutions using sawdust as adsorbent:Equilibrium,kinetics and regeneration studies[J].Chemical Engineering Journal,2009,150:352-365.
[10] MOHAN D,CHANDER S.Single component and multi-component adsorption of metal ions by activated carbon[J].Colloids and Surfaces,2001,177:183-196.
[11] BARAL S S,DAS S N.Adsorption of Cr(Ⅵ) using thermally activated weed Salvinia cucullata[J].Chemical Engineering Journal,2008,139:245-255.
[12] ERTUGAY N,BAYHAN Y K.Biosorption of Cr(Ⅵ) from aqueous solutions by biomass of Agaricus bisporus[J].Journal of Hazardous Materials,2008,154:432-439.
[13] SHARMA Y C.Effect of temperature on interfacial adsorption of Cr(Ⅵ) on wollastonite[J].J Colloid Interface Sci,2001,233:265-270.
[14] SELⅥ K,PATTABHI S,KADIRVELU K.Removal of Cr(Ⅵ) from aqueous solution by adsorption onto activated carbon[J].Bioresour Technol,2001,80:87-89.
[15] HEZAMI L K,CAPART R.Removal of chromium(Ⅵ) from aqueous solution by activated carbons:kinetic and equilibrium studies[J].J Hazard Mater,2005,123:223-231.
[16] MOHAN D,SINGH K P,SINGH V K.Using low-cost activated carbons derived from agricultural waste materials and activated carbon fabric cloth[J].Ind Eng Chem Res,2005,44:1027-1042.
[17] SHARMA Y C,WENG C H.Removal of chromium(Ⅵ) from water and wastewater by using riverbed sand:kinetic and equilibrium studies[J].Journal of Hazardous Materials,2007,142:449-454.
[18] SINGH,T S,PANT K K.Equilibrium,kinetic and thermodynamic studies for adsorption of As(Ⅲ) on activated alumina[J].Separat Purif Technol,2004,36(2):139-147.
[19] THIRUNAVUKKARASU O S,RARAHAVAN Ⅵ T,SUBRAMANIAN K S,et al.Arsenic removal in drinking water-impacts and novel removal technologies[J].Energy Sour,2005,27:209-219.
[20] GUPTA V K,SAINI V K,JAIN N.Adsorption of As(Ⅲ) from aqueous solutions by iron oxide-coated sand[J].J Colloid Interface Sci,2005,288:55-60.
[21] SRIVASTAVA S K,GUPTA V K,MOHAN D.Removal of lead and chromium by activated slag:a blast-furnace waste[J].J Environ Eng,1997,123(5):469-478.
[22] GOLDBERG S,JOHNSTON C T.Mechanisms of arsenic adsorption on amorphous oxides evaluated using macroscopic measurements,vibrational spectroscopy,and surface complexation modelling[J].J Colloid Interface Sci,2001,234(1):204-216.

