γ-氨基丁酸对断喙雏鸡血清细胞因子含量及脾脏中Bcl-2和Fas基因mRNA表达量的影响
谢婉莹 侯新燕 闫峰宾 韩瑞丽 孙桂荣 康相涛
(河南农业大学牧医工程学院,河南省家禽种质资源工程研究中心,郑州450002)
断喙是集约化生产条件下控制鸡群互相咬啄伤害和防止饲料浪费的有效措施之一,断喙后鸡羽毛生长良好,死亡率降低[1]。然而,随着动物行为学和动物福利学说的产生,断喙问题成为了人们争论的焦点。Gentle等[2-3]发现断喙所导致的组织及神经损伤会给雏鸡带来急性或长期的疼痛。组织损伤能够引起炎性反应、细胞因子的表达及细胞凋亡[4-6]。孙桂荣等[7]研究发现,断喙应激可导致鸡胸腺细胞凋亡,且有降低细胞凋亡抑制基因B细胞淋巴瘤/白血病2(B-cell lympoma/leukemia-2,Bcl-2)在胸腺细胞内表达量的趋势。研究证明,断喙会造成雏鸡强烈应激[8],应激在启动凋亡通路,引起细胞凋亡的同时又能抑制免疫,这种应激性免疫抑制是生产实践中许多疾病发生发展的基础。目前,缓解断喙应激对雏鸡的不利影响,进而提高经济效益已成为研究热点。γ-氨基丁酸(GABA)是中枢神经系统中一个主要的抑制性神经递质,它不仅广泛分布于动物的中枢神经系统中,而且也分布于外周神经和非神经组织的细胞中,在非神经组织中发挥激素或营养因子的功能[9]。GABA极易溶于水,作为一种镇痛剂,在人类及动物中广泛应用[10]。此外,Cherubini等[11]研究发现GABA具有缓解应激、改善食欲、提高营养利用率的作用。迄今为止,GABA在断喙应激中所发挥的作用还未有涉及。因此,本试验拟通过研究不同水平GABA对断喙应激条件下雏鸡生长性能、血清细胞因子含量及脾脏细胞凋亡相关基因Bcl-2和Fas基因mRNA表达量的影响,并分析Bcl-2和Fas基因与细胞因子的关系,探讨其作用的机理,旨在为其生产应用提供理论依据。
1 材料与方法
1.1 试验动物与试验设计
选取1日龄体重均匀的健康固始鸡公雏360只,随机分为A、B、C、D、E 5个组,每组6个重复,每个重复12只鸡。其中A、B、C组断喙,饮水中分别添加40、60和80mg/kg GABA;D组不断喙,不添加GABA;E组断喙,不添加GABA。试验基础饲粮参照NRC(1994)配制,基础饲粮组成及营养水平见表1。鸡舍温度控制在28~30℃,自由采食和饮水。每天记录死亡率。于断喙后第1、3、5、7天记录体重(BW)和采食量(FI)。GABA由上海源聚生物技术有限公司提供,纯度>99.7%。
1.2 样品制备
雏鸡于7日龄时断喙,于断喙后第1、3、5、7天从每重复中各取1只鸡心脏采血,分离出血清,于-20℃保存,用于血清炎性因子含量的检测,处死后迅速摘取约100g脾脏,于液氮速冻后转移至-70℃保存,用于提取总RNA。
1.3 血清细胞因子含量的测定
酶联免疫吸附剂(ELISA)法检测血清白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)含量,严格按鸡的 ELISA试剂盒(R&D Systems,上海江莱生物科技有限公司)说明书操作,每样品做2个复孔。按绘制的标准曲线,换算出3种细胞因子的含量。
1.4 脾脏Bcl-2和Fas基因mRNA表达量的检测
1.4.1 总RNA的提取和cDNA的合成
取50~100mg脾脏组织样,采用Trizol法提取组织总RNA。琼脂糖凝胶电泳检测RNA的完整性,利用NanoDrop 2000紫外分光光度计检测其浓度,根据OD260/OD280的比值(R值)判定RNA的纯度。按照PrimeScript cDNA第一链合成试剂盒(宝生物工程有限公司,大连)操作说明反转录得到cDNA。
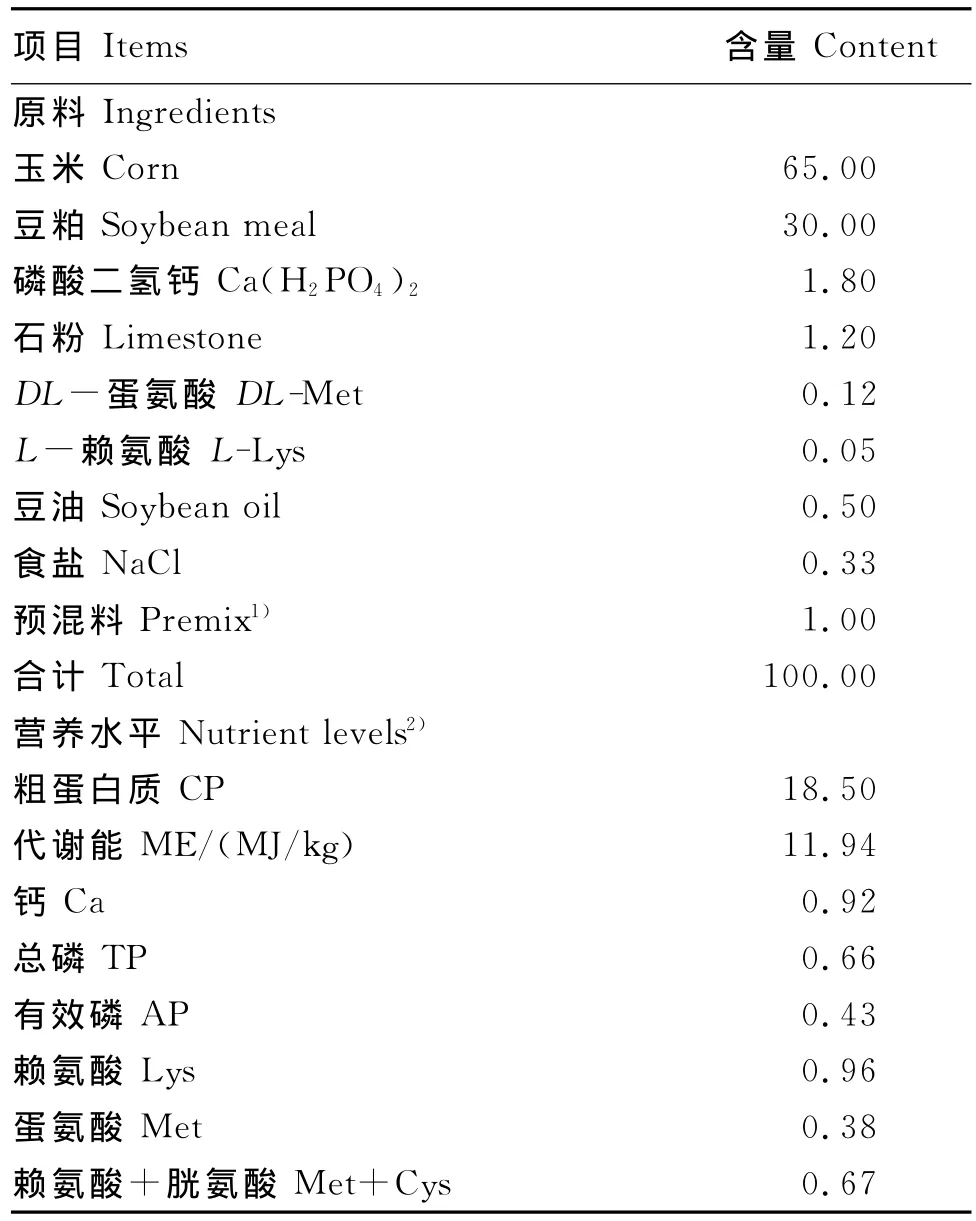
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient level of the basal diet(air-dry basis) %
1.4.2 目的基因引物设计
根据GenBank上公布的鸡的Bcl-2和Fas基因mRNA序列,使用Primer 5.0软件设计,由上海生工生物工程技术服务有限公司合成,引物序列及参数见表2。
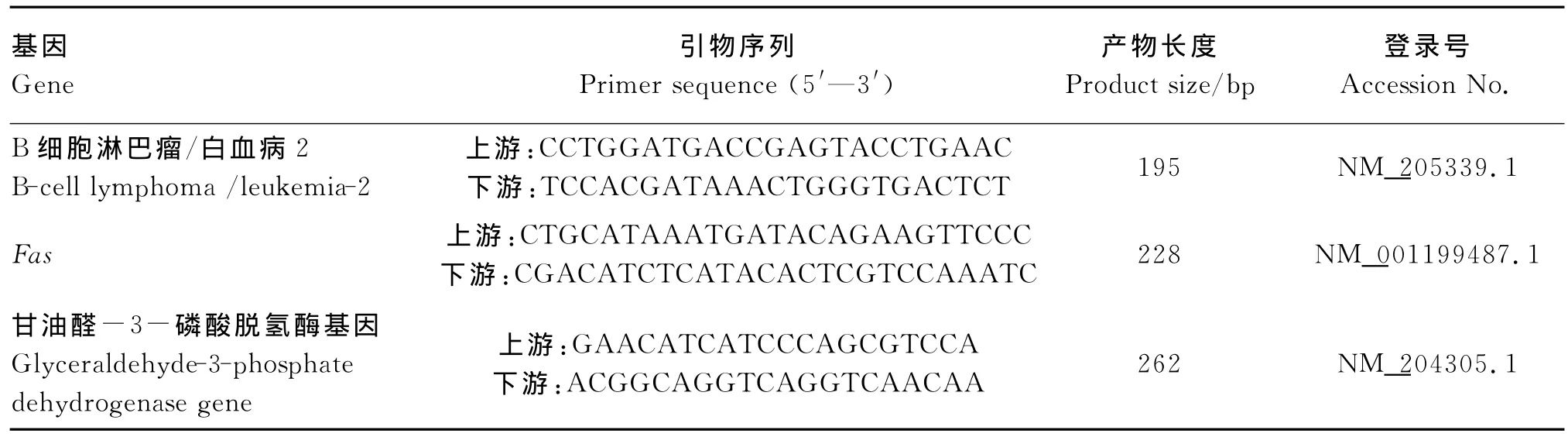
表2 PCR引物序列及参数Table 2 Primers sequences and parameters
1.4.3 PCR反应
用EasyTaq DNA Polymerase试剂盒对反转录产物进行PCR反应,反应体系为25μL:1μL cDNA;1μL目的基因上、下游引物;2.5μL,10×EasyTaq Buffer;2μL 2.5mmol/L dNTPs;0.25 μL EasyTaq DNA Polymerase;17.25μL dH2O。反应程序为:94 ℃预变性5min;94 ℃,30s;50~55℃,30s;72℃,30s;共35个循环;最后72℃延伸10min。
1.4.4 PCR产物的回收及测序
将PCR产物进行琼脂糖凝胶电泳,目的片段用EasyPure Quick Gel Extraction Kit凝胶回收试剂盒纯化。纯化产物送至宝生物工程有限公司测序。
1.4.5 实时荧光定量PCR反应
采用SYBR Green染料法在ABI StepOne-PlusTM实时荧光定量PCR扩增仪上进行扩增。反应体系:SYBR Premix Ex Ⅱ10.0μL,Forward Primer 0.8μL,Reverse Primer 0.8μL,cDNA模板2.0μL,加dH2O至20μL。反应程序:95℃预变性3min;95℃变性15s,60℃退火40s,72℃延伸15s,40个循环;72℃延伸10min。反应结束后进行熔解曲线分析,判定引物的特异性。
1.5 数据分析
以GAPDH 管家基因作为内参,对Bcl-2和Fas基因进行相对定量分析。试验数据以平均值±标准差(mean±SD)表示。采用2-△△Ct法对荧光定量结果进行计算。数据分析采用SPSS 17.0软件的一般线性模型(GLM)进行双因素方差分析和Duncan氏法多重比较。以P<0.05为显著性标准。
2 结果与分析
2.1 GABA对断喙应激条件下雏鸡生长性能的影响
由表3可见,断喙后第1天各组之间雏鸡体重并没有显著差异(P>0.05),然而,在断喙后第3天,与未断喙组(D组)相比,断喙应激导致雏鸡体重显著下降,添加80mg/kg GABA组雏鸡体重显著高于断喙未添加GABA组(P<0.05)。断喙后第5、7天,断喙未添加GABA组雏鸡体重显著低于断喙添加 GABA组(P<0.05),且添加40、60、80mg/kg GABA 组 之 间 差 异 不 显 著 (P>0.05)。
与未断喙组相比,断喙应激导致雏鸡采食量显著下降(P<0.05),添加GABA缓解了这一应激状况,在断喙后第5、7天,断喙未添加GABA组雏鸡采食量显著低于添加80mg/kg GABA组(P<0.05)。此外,整个试验结束后对死亡率的统计结果显示,C组雏鸡死亡率最低,为2.8%,其次为D(4.2%)、B(6.9%)、A 组(8.3%),E组雏鸡死亡率最高,为12.9%。
2.2 GABA对断喙应激条件下雏鸡血清中细胞因子含量的影响
由表4可见,断喙应激刺激了IL-1β、TNF-α和IL-6 3种细胞因子的分泌,断喙后第1、5天血清IL-1β含量显著高于未断喙组(P<0.05)。与断喙未添加GABA组相比,添加80mg/kg GABA显著降低了血清IL-1β含量(P<0.05),而添加40 mg/kg GABA组效果不显著(P>0.05)。
与未断喙组相比,断喙后第1天血清TNF-α含量显著 升高(P<0.05),添 加60、80mg/kg GABA组血清TNF-α含量显著低于断喙未添加GABA组 (P<0.05);断 喙 后 第 7 天,添 加80mg/kg GABA 显著降低了血清 TNF-α含量(P<0.05)。
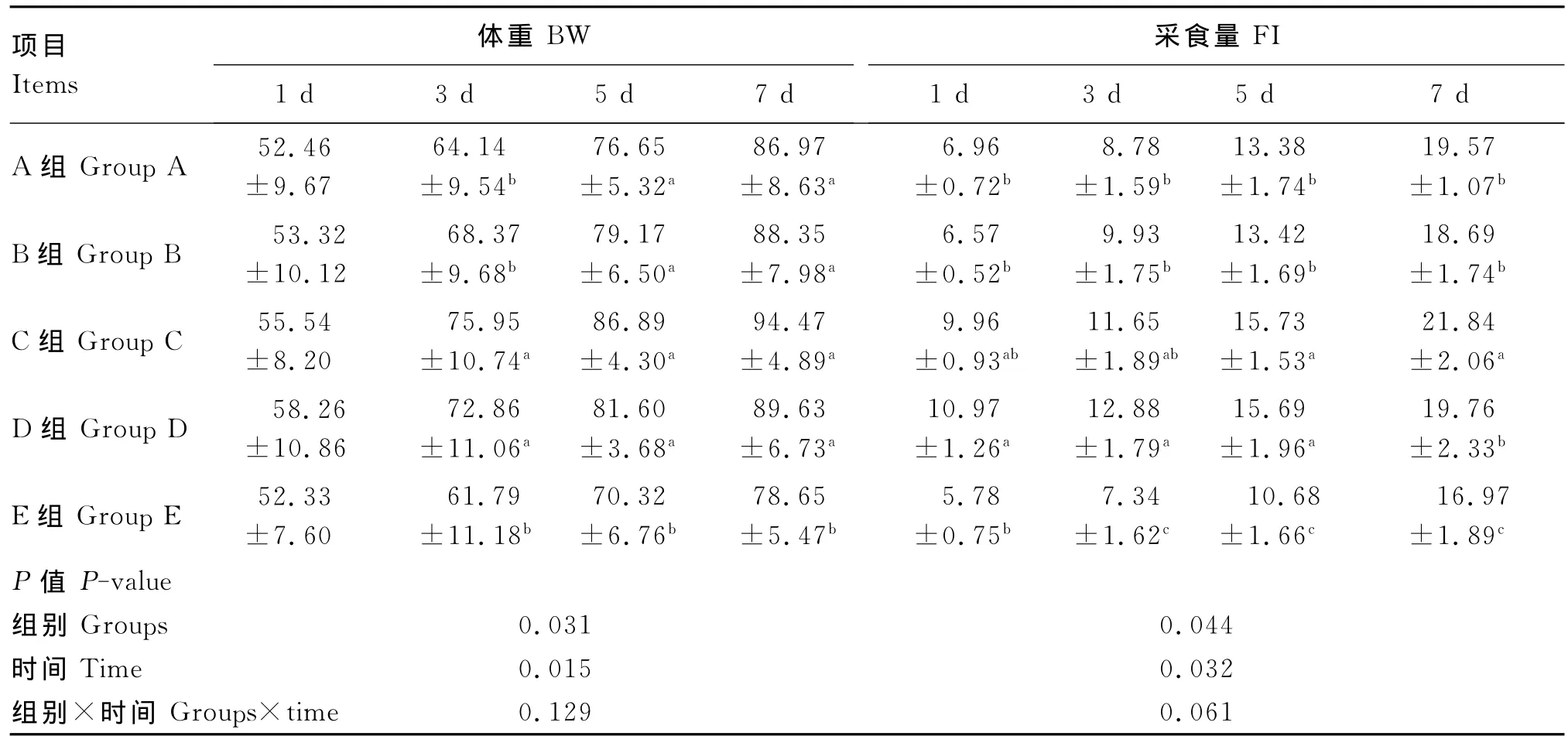
表3 GABA对断喙应激条件下雏鸡体重和采食量的影响Table 3 Effects of GABA on body weight and feed intake of chicks under beak trimming stress g
断喙后第1、7天IL-6含量显著高于未断喙组,添加80mg/kg GABA显著抑制了体内IL-6的分泌(P<0.05)。
以上结果表明,断喙刺激了体内细胞因子的释放,且呈现先上升后下降的趋势。添加80mg/kg GABA能够显著降低断喙应激所致的鸡血 清 IL-1β、TNF-α和 IL-6 含 量 的 升 高 (P<0.05)。
2.3 Fas和Bcl-2基因引物特异性
本试验利用实时荧光定量PCR法检测了Fas和Bcl-2基因在鸡脾脏中的表达,Fas、Bcl-2和内参基因GAPDH熔解曲线见图1,可以看出,PCR扩增的熔解曲线为单峰,没有引物二聚体及其他非特异性扩增产物,结合琼脂糖电泳结果目的片段位置(结果未列出),表明相关引物具有较高的特异性,所得结果可用于后续分析。
2.4 GABA对断喙应激条件下雏鸡脾脏中Bcl-2和Fas基因mRNA表达量的影响
由图2可见,与未断喙组相比,断喙应激后脾脏中促凋亡基因Fas mRNA表达量升高,添加GABA后下降,在断喙后第1、3、7天效果显著,且随GABA剂量加大而进一步降低,添加80mg/kg GABA组Fas mRNA表达量显著低于断喙未添加GABA组(P<0.05)。
各组间脾脏内Bcl-2mRNA的表达量差异不显著(P>0.05)。断喙后1周脾脏内Bcl-2mRNA的表达量变化趋势缓和,但是在断喙未添加GABA组脾脏内相对同期对照组有降低趋势,添加80mg/kg GABA有轻度上调抗凋亡基因Bcl-2 mRNA表达量的趋势,但没有达到显著水平(P>0.05)。
3 讨 论
3.1 GABA对断喙应激条件下雏鸡生长性能的影响
试验结果显示断喙应激导致雏鸡体重下降、采食量减少,添加GABA可以缓解这一症状,且添加80mg/kg GABA组缓解效果较好。这与前人报道基本一致。Fan等[12]研究表明GABA在改善动物生长性能方面具有良好效果,可以显著促进其体内生长激素的分泌。采食作为一个复杂的行为活动,主要受中枢神经系统中饱中枢和摄食中枢的调节。研究证实GABA能够促进胃酸及消化酶的分泌,同时抑制胆囊收缩素(CCK)分泌,减弱消化道食糜对采食的负反馈作用,抑制胃膨胀及饱中枢,从而提高动物采食量[13-14]。此外,Shuye等[15]研究发现将一定剂量范围的GABA注射于动物的不同脑区,可显著促进动物摄食,并具有剂量依赖效应。鸡的采食量对鸡的健康、生长发育和生产潜能的发挥具有重要意义。本试验显示,添加GABA显著提高了断喙应激雏鸡体重,GABA可能是通过其受体作用于中枢神经系统,抑制饱中枢的活动引起雏鸡采食增加,从而影响其生长发育。
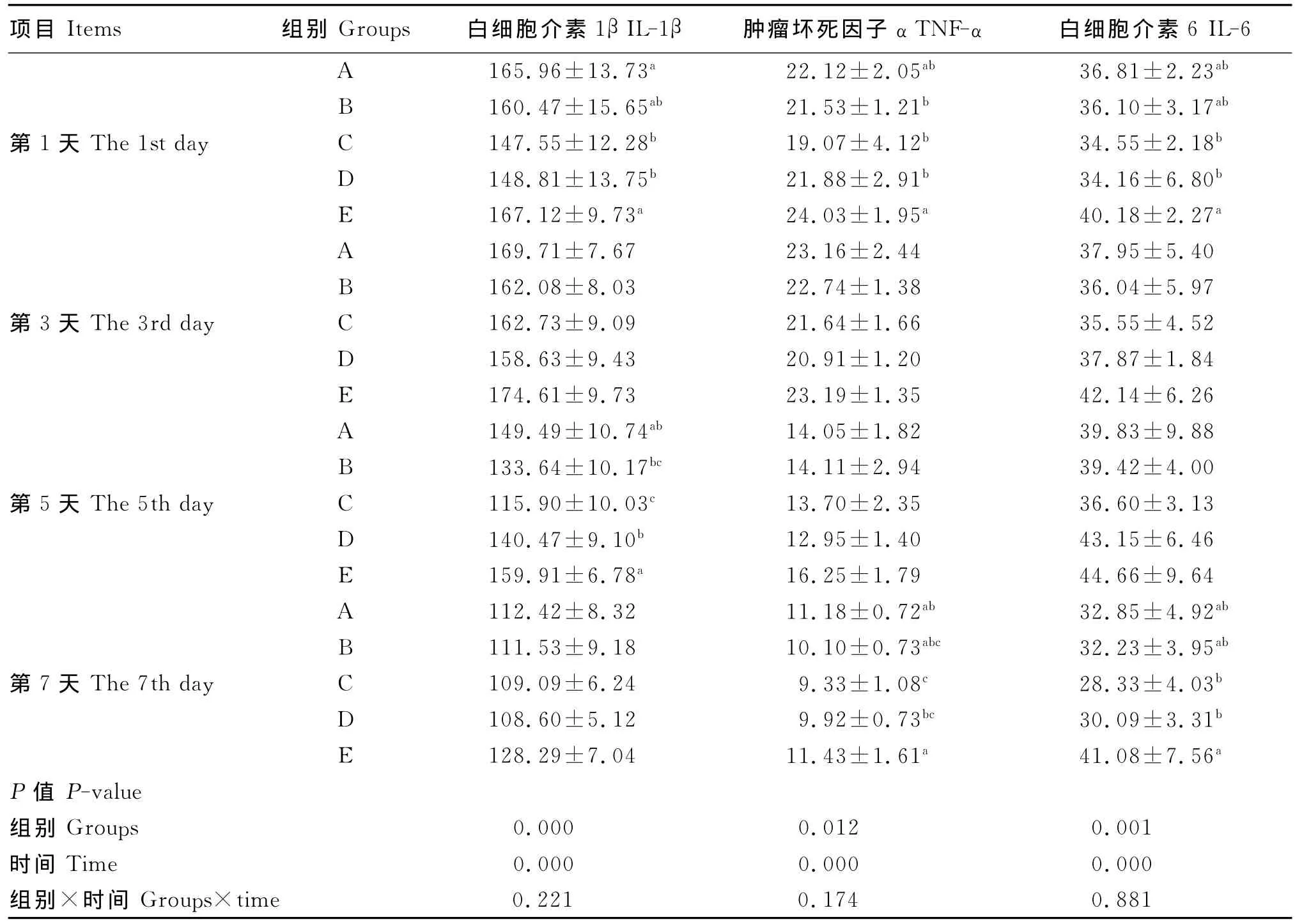
表4 GABA对断喙应激条件下雏鸡血清细胞因子含量的影响Table 4 Effects of GABA on serum cytokines contents of chicks under beak trimming stress ng/L
3.2 GABA对断喙应激条件下雏鸡血清细胞因子含量的影响
免疫系统对外界刺激是非常敏感的。在神经、内分泌及免疫系统之间存在着紧密的联系,细胞因子是神经、内分泌系统与免疫系统之间信息交流的重要介质[16]。应激导致的免疫抑制的发生是各种激素和细胞因子作用的结果。Cunha等[17-19]研究表明在损伤的组织中,炎症可能会导致三磷酸腺 苷(ATP)、前 列 腺 素、IL-1β、IL-6 和TNF-α等化学物质的释放,与前人报道一致,本试验结果显示,断喙应激刺激了IL-1β、IL-6和TNF-α 3种细胞因子的分泌。Spangelo等[20]研究发现,GABA可抑制IL-1β诱导产生IL-6。Joseph等[21]报道GABA能够显著抑制IL-6的合成。本试验结果表明,添加GABA有效抑制了应激导致的细胞因子的分泌,降低了血清中IL-1β、IL-6和 TNF-α3种细胞因子的含量,且添加80mg/kg GABA时效果显著。据此推测,GABA可能是通过抑制细胞因子的分泌而起到了缓解应激的效果。然而,GABA抑制细胞因子的机理还有待进一步研究。
此外,本试验还发现,断喙后第1、3、5、7天,血清中IL-1β、IL-6和 TNF-α3种细胞因子的含量均呈先上升后下降的趋势,其中IL-1β和TNF-α在断喙后第3天达到峰值,随后逐渐下降。断喙对鸡体来说是一种不良刺激,鸡体为了应对这种刺激,除了进行行为等物理调节外,还必须改变血清中某些化学物质水平以加强化学调节。血清中IL-1β、IL-6和 TNF-α3种细胞因子含量升高正是鸡体应对应激刺激的生理反应。随后,血清中细胞因子含量呈下降趋势说明此时鸡体逐渐由以化学调节为主转变为以物理调节为主,应激逐渐缓解。
图1 GAPDH,Fas及Bcl-2基因的熔解曲线图Fig.1 Melt curves of GAPDH,Fas and Bcl-2genes
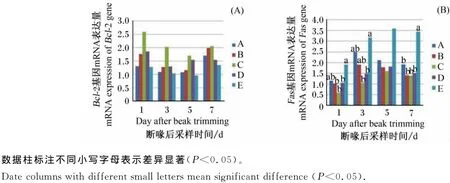
图2 GABA对断喙应激条件下雏鸡脾脏中Fas和Bcl-2基因mRNA表达量的影响Fig.2 Effects of GABA on splenetic mRNA expression levels of Fas and Bcl-2genes of chicks under beak trimming stress
3.3 GABA对断喙应激条件下雏鸡脾脏中Bcl-2和Fas基因mRNA表达量的影响
细胞凋亡的发生受多种基因表达的调控,凋亡刺激基因Fas与凋亡抑制基因Bcl-2被认为与细胞凋亡关系密切[22-23]。当促凋亡因素减轻或去除时,凋亡细胞可转化为正常细胞,反之凋亡细胞则可转化为坏死细胞[24]。本研究结果显示,与未断喙组相比,断喙应激后第1、3和7天雏鸡脾脏中促凋亡基因Fas mRNA表达量显著升高,抗凋亡基因Bcl-2mRNA表达量有下降趋势,说明断喙应激导致了鸡脾脏细胞凋亡。
引起细胞凋亡的因素很多,研究表明炎性反应及其细胞因子的分泌表达均会引起细胞凋亡[25]。断喙后体内的炎性反应及分泌表达的细胞因子IL-1β、IL-6和 TNF-α等与细胞凋亡的关系越来越引起人们的关注。Holmin等[26]给大鼠脑内注入IL-1β和TNF-α发现,注入IL-1β可诱导短暂的炎性细胞反应和细胞凋亡,并发现促凋亡基因的表达量显著高于抗凋亡基因的表达量。Mayne等[27]则在大鼠脑出血24h内检测到TNF-α的表达,且发现使用TNF-α拮抗剂后,凋亡细胞的数目显著减少。本研究结果显示,与未断喙组相比,断喙应激后脾脏中促凋亡基因Fas mRNA表达量显著升高,与此同时,断喙后血清中IL-1β、TNF-α和IL-6含量显著高于未断喙组。随着血清中IL-1β、TNF-α和IL-6含量的下降,促凋亡基因Fas mRNA表达量也逐渐下降,说明IL-1β、TNF-α和IL-6与细胞凋亡有密切关系。添加GABA后显著下调了Fas mRNA表达量,轻度上调了抗凋亡基因Bcl-2mRNA表达量,此调节作用与GABA添加剂量间存在显著的量效关系,进一步显示GABA对细胞凋亡时凋亡相关基因的mRNA表达量尚有一定影响,这种影响可能是通过调控体内细胞因子的分泌而实现的,该作用机理还有待进一步证实。
4 结 论
① 断喙应激导致雏鸡体重下降、采食量减少,添加GABA可以缓解这一症状。
② 断喙应激后雏鸡免疫器官脾脏中促凋亡基因Fas mRNA表达量显著升高,血清中细胞因子含量显著升高,推测 GABA可通过抑制IL-1β、TNF-α和IL-6 3种细胞因子的分泌减轻炎性反应,间接抑制细胞凋亡加剧,以缓解断喙应激对雏鸡的不良影响,且添加80mg/kg GABA效果较好。
[1] HESTER P Y,SHEA-MOORE M.Beak trimming egg-laying strains of chickens[J].World’s Poultry Science,2003,59:458-474.
[2] GENTLE M J,WADDINGTON D,HUNTER L H,et al.Behavioural evidence for persistent pain following partial beak amputation in chickens[J].Applied Animal Behaviour Science,1990,27:149-157.
[3] GENTLE M J,HUNTER L N,WADDINGTON D.The onset of pain related behaviours following partial beak amputation in the chicken[J].Neuroscience Letters,1991,128:113-116.
[4] GONG C,HOFF J T,KEEP R F.Acute inflammatory reaction following experimental intracerebral hemorrhage in rat[J].Brain Research,2000,871(1):57-65.
[5] CASTILLO J,OAVALOS A,ALVAREZ-SABIN J,et al.Molecular signatures of brain injury after intracerebral hemorrhage[J].Neurology,2002,58(4):624-629.
[6] 吴家幂,马领松,周向阳,等.补体在脑出血后脑组织损伤机制中的作用[J].中华神经医学杂志,2006,5(2):152-154.
[7] 孙桂荣,李燕,康相涛,等.断喙应激对雏鸡胸腺细胞凋亡及相关凋亡蛋白表达的影响[J].畜牧兽医学报,2011,42(7):1000-1006.
[8] GENTLE M J.Cutaneous sensory afferents recorded from the nervus intramandibularis of Gallus gallus var domesticus[J].Comparative Physiology A,1989,164:763-774.
[9] XU X G,YANG Z F,HUANG S H,et al.Promotive effects of GABA on acid secretion from isolated mouse stomach in vitro[J].Acta Zoologica Sinica,2001,47:170-175.
[10] ZAKUSOV W,OATROVSKAYA R U,BULAYEV V M.GABA-opiates interactions in the activity of analgesics[J].Archives Internationales de Pharmacodynamie et de Therapie,1983,265:61-75.
[11] CHERUBINI E,GAIARSA J L,BEN-ARI Y.GABA:an excitatory transmitter in early postnatal life[J].Trends in Neurosciences,1991,12:515-519.
[12] FAN Z Y,DENG J P,LIU G H,et al.Effects ofγaminobutyric acid on the performance and internal hormone levels in growing pigs[J].Chinese Journal of Animal Nutrition,2007,19(4):350-356.
[13] PIGUERAS L,VICENTE M.Peripheral GABA-β agonists stimulate gastric acid secretion in mice[J].British Journal of Pharmacology,2004,142:1038-1048.
[14] KATO S,ARAKI H,KAWAUCHI S.Body temperature dependence in baclofen-induced gastric acid secretion in rats relation to capsaicin sensitive affront neurons[J].Life Sciences,2001,68:1951-1963.
[15] SHUYE P U,JAIN M R,HORVATH T L.Interactions between neuropeptide Y and γ-ammobutyric acid in stimulation of feeding:a morphological and pharmacological analysls[J].Endocrinology,1999,140:933-940.
[16] KHANSARI D N,MURGO A J,FAITH R E.Effects of stress on the immune system[J].Immunol Today,1990,11:170-175.
[17] CUNHA F Q,FERREIRA S H.Peripheral hyperalgesic cytokines[J].Advances in Experimental Medicine and Biology,2003,521:22-39.
[18] ARRUDA J,SWEITZER L S,RUTKOWSKI M D,et al.Intrathecal anti-IL-6antibody and IgG attenuates peripheral nerve injury-induced mechanical allodynia in the rat:possible immune modulation in neuropathic pain[J].Brain Research,2000,879:216-225.
[19] FRISEN J,RISLING M,FRIED K.Distribution and axonal relations of macrophages in a neuroma[J].Neuroscience,1993,55:1003-1013.
[20] SPANGELO B L,HORRELL S,GOODWIN A L,et al.Somatostatin and gamma-aminobutyric acid inhibit interleukin-1β-stimulated release of interleukin-6from rat c6glioma cells[J].Neuroimmunomodulation,2004,11:332-340.
[21] JOSEPH D,ROACH J D,AGUINALDO G T,et al.γ-aminobutyric acid inhibits synergistic interleukin-6 releases but not transcriptional activation in astrocytoma cells[J].Neuroimmunomodulation,2008,15:117-124.
[22] ITOH N,NAGATA S.A novel protein domain required for apoptosis[J].Biological Chemistry,1993,268:10932-10939.
[23] WILLIAMS G T,SMITH C A.Molecular of apoptosis:genetic controls on cell death[J].Cell,1993,74:777-779.
[24] 胡书超,张建祥.脑出血后的神经细胞凋亡机制及治疗策略[J].国外医学脑血管疾病分册,2004,12(7):524-526.
[25] XUE M,DELBIGIOL M R.Acute tissue damage after injections of thrombin and plasmin into rat striatum[J].Stroke,2001,32(9):2164-2169.
[26] HOLMIN S,MATHIESAN T.Intracerebral administration of interleukin 1beta and induction of inflammation,apoptosis and vasogenic edema[J].Neurosurg,2000,92(1):108-120.
[27] MAYNE M,NI W,YAN H J,et al.Antisense oligodeoxynucleotide inhibition of tumor necrosis factoralpha expression is neuropotective after intraerbral hemorrhage[J].Stroke,2001,32(1):240-248.

