池养乌苏里拟鲿雌雄鱼生长及周年性激素与性腺发育研究
(苏州大学 医学部 基础医学与生物科学学院,苏州大学 水产研究所,江苏 苏州 215123)
乌苏里拟鲿(Pseudobagrus ussuriensis)隶属于鲇形目(Silurformes)、鲿科(Bagridae)、拟鲿属(Pseudobagrus),分布于我国黑龙江至珠江的各水系以及我国长江和淮河水系的太湖、洪泽湖等水域,其肉质细嫩、味道鲜美,价格昂贵,但近年来其资源量锐减。因此,开展其人工繁殖和商品鱼养殖以及基础生物学研究十分必要。有关乌苏里拟鲿的研究报道仅见于人工繁殖技术及分子生物学等方面的初步研究[1-6],对其性别发育及生殖生理方面研究还较少。作者在对该鱼进行人工繁殖的基础上,开展了池塘养殖条件下该雌、雄鱼生长规律以及性成熟鱼周年性腺发育与性激素变化特性的研究。以期为探明该雌、雄鱼的生长和性成熟规律提供基础资料,也为开展该鱼的种质资源保护和商品鱼养殖实践提供理论依据。
1 材料与方法
1.1 材料来源
从2009年6月份至2011年11月份,在池塘中将人工繁殖的乌苏里拟鲿鱼苗分别按夏花鱼种培育、一龄鱼种培育、商品鱼养殖和亲鱼培育环节,按照常规鱼类雌、雄鱼同一池塘单一品种养殖的模式进行人工配合饲料投喂饲养。每月25日对池养雌、雄鱼的体长和体质量生长情况进行跟踪检测。在2010年12月份(2龄)和2011年4、5、6、10月份(3龄)的每月25日随机取样雌、雄鱼各 20尾,在测量体长、体质量的同时使用一次性注射器采血1mL于离心管内,以用于性激素测定;称取性腺质量,用于计算成熟度;并将性腺置于 4%甲醛溶液中固定,用于组织学观察。
1.2 材料制备与实验方法
1.2.1 生长数据统计
对现场测得的乌苏里拟鲿各月份体长和体质量数据进行统计,获得体长、体质量与生长时间的关系,并利用W=aLb模型对体质量和体长的关系进行拟合,分别获得雌、雄鱼体长和体质量拟合曲线。
1.2.2 丰满度与成熟度测量
根据乌苏里拟鲿雌、雄成鱼不同月份平均体长、体质量和性腺质量,分别计算雌、雄鱼的丰满度和成熟度。计算公式为:
丰满度=[体质量/ (体长3)]× 100%;成熟度= (性腺质量/体质量) × 100%。
1.2.3 激素测定
分别将采集到的乌苏里拟鲿雌、雄成鱼新鲜血液,于4℃静置4 h,10 000 rpm离心10 min,取上清液获得血清样本,利用 I125放射免疫试剂盒(购自北京科美生物技术公司)以及γ放免计数器检测各样本的雌二醇(E2)和睾酮(T)激素含量。
1.2.4 组织学观察
用固定液充分固定性腺组织,水洗后转入梯度乙醇中脱水,二甲苯透明,石蜡包埋,使用轮转式切片机切片8 nm,贴片并采用苏木精-伊红染色,中性树脂封片,光学显微镜检并拍照。12月份、4月份和10月份的卵巢组织内部黏连性比较好,采用整体石蜡包埋后横切面观察,5月份和6月份卵巢中卵子之间黏连性较差,因此采用包埋单个卵子切片观察的方法。
2 实验结果
2.1 乌苏里拟鲿雌、雄鱼生长规律
2.1.1 乌苏里拟鲿雌、雄鱼的体质量和体长生长比较
如图1所示,1龄乌苏里拟鲿雌、雄生长曲线基本相似,随着生长时间的推移,雌、雄鱼的体长和体质量差异逐渐增大,从2龄开始,雄性乌苏里拟鲿体长和体质量生长增长值显著大于雌性鱼(P<0.05),池塘养殖3龄雄性乌苏里拟鲿11月份时的体质量和体长分别是雌性鱼的235.2%和150.3%。图2分别显示乌苏里拟鲿雌、雄鱼的体质量体长关系曲线,拟合曲线的模型为:W=aLb。雌性鱼的体长体质量关系式为:W=0.182 5L1.9646(R2=0.944 5);雄性鱼的体长体质量关系式为:W=0.188 1L2.005(R2=0.961 8)。
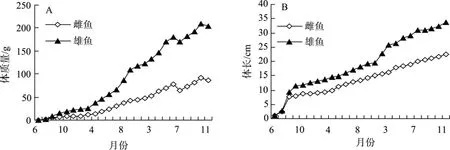
图1 乌苏里拟鲿雌、雄鱼体质量(A)和体长(B)生长比较Fig.1 Growth comparison of female and male Pseudobagrus ussuriensis
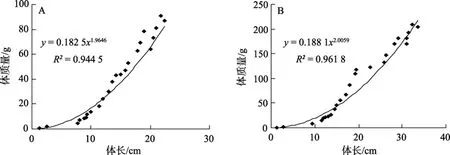
图2 乌苏里拟鲿雌性(A)和雄性(B)体质量和体长关系拟合曲线Fig.2 Curve fitting of female and male Pseudobagrus ussuriensis’s weight and length
2.1.2 乌苏里拟鲿雌、雄成鱼周年丰满度变化
如图3所示,乌苏里拟鲿雄性成鱼的丰满度从2010年12月份到翌年3月份逐渐降低,4到6月份保持同一水平,7月份又下降至低谷,而8到10月份则有所上升。雌性成鱼各月份的丰满度均高于雄性成鱼(P<0.05),且随月份而变化的趋势与雄成鱼基本相似,只是翌年3月份的丰满度并未下降,且处于最高水平。
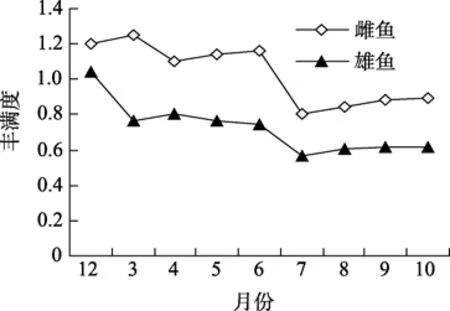
图3 乌苏里拟鲿雌、雄鱼周年丰满度Fig.3 Seasonal changes in relative fatness of female and male Pseudobagrus ussuriensis
2.2 乌苏里拟鲿雌、雄成鱼周年性类固醇激素水平
2.2.1 雌、雄成鱼周年雌二醇(E2)水平
如图4显示,雌、雄乌苏里拟鲿成鱼E2水平的周年变化均呈现先升高后降低的规律,且最高值均出现在5月份;除12月份以外的各月份,雌性成鱼的E2水平均显著高于雄性成鱼(P<0.05),尤其在5月份和4月份(P<0.01)。
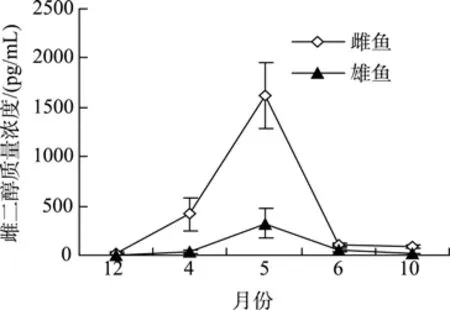
图4 乌苏里拟鲿不同月份雌、雄鱼E2水平Fig.4 Seasonal changes in E2 level of female and male Pseudobagrus ussuriensis
2.2.2 雌、雄成鱼周年睾酮(T)水平
由图5可知,除12月份以外的各月份,雌性乌苏里拟鲿成鱼 T水平均显著高于雄性成鱼(P<0.05),且其周年变化趋势与 E2基本相似,在5月份出现最高值,4月份次之;而雄性成鱼T的最高值出现在4月份,5月份出现显著下降(P<0.05)。
2.3 乌苏里拟鲿雌、雄成鱼周年性腺发育情况
2.3.1 乌苏里拟鲿雌、雄成鱼周年成熟度变化
如图6显示,乌苏里拟鲿雌、雄成鱼周年成熟度的变化趋势基本一致,均从12月份到翌年6月份逐渐上升,在 10月份时下降;其中,雌性成鱼成熟度的周年变化幅度显著高于雄性,尤其从4月至6月份的性腺发育成熟季节成熟度出现了快速上升。
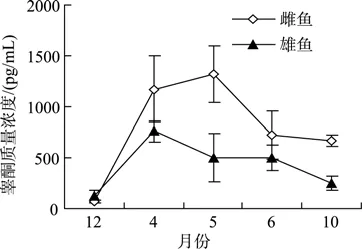
图5 乌苏里拟鲿不同月份雌、雄鱼T水平Fig.5 Seasonal changes in T level of female and male Pseudobagrus ussuriensis
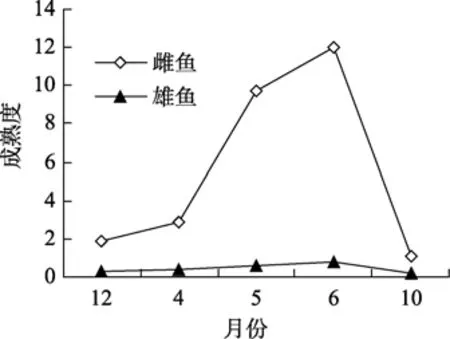
图6 乌苏里拟鲿不同月份雌、雄鱼成熟度水平Fig.6 Seasonal changes in gonad maturity of female and male Pseudobagrus ussuriensis
2.3.2 卵巢发育形态及组织学
将乌苏里拟鲿腹部从泄殖孔剪开至鳃部,取出内脏团后,靠近背部显露出成对出现的卵巢,呈长囊形,在末端连接至泄殖孔。对各月份卵巢的外观和组织学观察后,根据我国一般采用六期划分法以及黄颡鱼等近源物种的性腺分期特征[7-8],对乌苏里拟鲿卵巢的观察和分期结果见图7。
12月25日卵巢呈淡红色,外膜上有血管分布,肉眼可隐约看到卵粒, 图版Ⅰ-1示卵巢中已有卵黄开始形成的第Ⅲ期卵母细胞,也有部分Ⅰ、Ⅱ时相的卵母细胞,据此判断,12月份卵巢已达到第Ⅲ期。
4月25日卵巢呈淡黄色,比12月份卵巢膨大一倍,卵巢壁开始透明,肉眼可见内部卵粒,图版Ⅰ-2示卵巢中大部分卵细胞已沉积较多卵黄物质,还有一小部分处于Ⅱ期的细胞,此时卵巢处于Ⅳ期的早期(Ⅳ+)。
5月25日卵巢体积膨大,占据整个腹腔的大部分,外膜血管退去,膜中卵粒饱满密集,但卵粒还黏连在一起,组织学观察已经出现成熟卵细胞,由此可推断此时的卵巢处于第Ⅳ期的晚期(Ⅳ+++),图版Ⅰ-3示已出现的第Ⅴ期卵母细胞,细胞核消失,内部充满卵黄物质。
6月25日雌性卵巢体积膨大,占据整个腹腔的大部分,外观淡黄色,外膜上未见血管,膜中充满卵粒,比5月份时更饱满些,卵粒间黏连减少,出现游离的卵粒;成熟卵细胞的横切片(图版Ⅰ-4)可见卵膜包裹的卵黄,靠近卵黄膜的周围有空泡。由此可推断6月底卵巢处于第Ⅴ期。
10月25日雌性卵巢体积明显缩小,部分前端为淡红色,其余为黄白色,按压卵巢时触感松软,组织学观察卵巢内部是中空的,有部分未排出的卵细胞和大部分处于第Ⅱ时相的卵母细胞,由此可推断该月份卵巢处于第Ⅵ期。图版Ⅰ-5示卵巢横切面,示中空的卵巢、未排出的卵细胞和第Ⅱ时相卵母细胞。
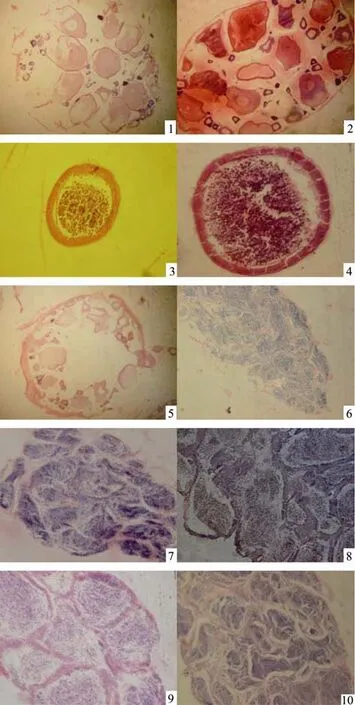
图7 乌苏里拟鲿卵巢的观察和分期Fig.7 Observation and phase division of Pseudobagrus ussuriensis ovary
2.3.3 精巢发育形态及组织学
乌苏里拟鲿精巢为小叶型,前端两分支在中部汇合后连接泄殖孔,整体呈“Y”字形,每个分支上都分化出许多细叶状结构。本实验截取单个细叶状分支横截面进行观察,观察和分期结果如下:
12月25日精巢外形较细小,黄白色,如图版Ⅰ-6显示,组织切片内部一致为被染色较浅的初级精母细胞,此时精巢发育至第Ⅲ期。
4月25日精巢体积开始变大,颜色由黄色开始变白,如图版Ⅰ-7显示,精小叶中的初级精母细胞开始发育为次级精母细胞,此时精巢处于第Ⅳ期的初期。
5月25日精巢体积继续变大,颜色比4月份时更白,体积膨大一倍。如图版Ⅰ-8显示,精小叶中充满了次级精母细胞以及精子,此时精巢处于第Ⅳ期的后期。
6月25日精巢外观更加膨大,乳白色,如图版Ⅰ-9显示,精小叶中的精小囊开始破裂,释放精子于精小叶中,该时期精巢已达到第Ⅴ期。
10月25日精巢恢复为12月份大小,颜色开始泛黄,如图版Ⅰ-10显示,精小叶中空隙较大,此时精巢已经退化,但可见部分初级精母细胞,此时精巢处于第Ⅵ期,即将进入第Ⅲ期开始下一周期的发育。
3 讨论
3.1 鱼类生长规律与雌、雄鱼生长的差异
池塘养殖鱼类中,雌、雄鱼体型和生长差异较大的情况比较普遍,如鲤鱼和鲫鱼的雌性鱼比雄性鱼生长速度快,雌、雄鳜鱼的体长/体高差异很显著[9]。本实验结果显示,乌苏里拟鲿雄鱼随着生长时间的推移,生长速度明显大于雌鱼。3龄雄性乌苏里拟鲿在养殖池塘中11月份时的体质量和体长分别是雌性鱼的235.2%和150.3%,表明该种鱼类的性别生长差异非常突出。雌、雄鱼体长体质量关系式W=aLb中b值均小于 3,由此推断雌、雄鱼生长均呈异速生长,即体长生长速度大于体质量生长速度[10]。将生长曲线与丰满度曲线对比发现,随着体质量和体长的快速增加,雌、雄成鱼的丰满度却逐渐下降,这进一步表明了该种鱼类具有体长生长快于体质量生长的异速生长特性。这一现象在雄性成鱼中尤为明显,成年雄鱼体态较细长,丰满度低于成年雌鱼,随着年龄的增长,其体型也越显细长。
3.2 鱼类性激素水平与性腺发育的关系
本实验对池养乌苏里拟鲿捕捞后现场及时采血,尽量避免了长距离运输导致的应激反应对激素分泌产生的影响,并采用I125放射免疫方法测量血清中的性激素含量,具有快速、准确、灵敏度高的特点。但由于鱼类的激素水平容易受到环境等因素的影响,其平行样本间的差异仍然较大,这在相关研究中也有类似现象[11-13]。尽管如此,本研究结果显示乌苏里拟鲿雌、雄鱼的E2和T水平在不同月份间仍具有显著的统计学差异。
从本研究结果(图4和图5)也可看出,雌性鱼在E2和T水平上均明显高于雄性鱼,雌、雄鱼E2水平和雌鱼T水平的最高值均在5月底,此时卵巢和精巢均发育达到第Ⅳ期后期(Ⅳ+++)。因此,雌鱼和雄鱼E2的高水平均可直接促进卵巢和精巢的发育[14];而雌鱼 T的高水平现象可能是因为 E2是由 T转化而来,雌性鱼在卵巢发育中,需要分泌大量 T作为合成 E2的前体,因此本实验检测也发现乌苏里拟鲿雌、雄鱼的T 水平出现显著升高的时间均比E2要早,且维持较高水平的时间较长,暗示T在雌、雄鱼在性腺发育和繁殖等生理活动中发挥着重要作用。在对国内外硬骨鱼类性类固醇激素的研究中,普遍认为性激素的水平直接影响着雌、雄鱼的繁殖活动。海鲈(Dicentrarchus labraxL.)血浆中E2和T水平在繁殖期达到高峰,T水平在繁殖期后的2~3个月时又一次达到高峰,可能是为下一次的发育做准备[15]。露斯塔野鲮(Labeo rohita)血浆E2和T水平在4月份达到高峰,5月份产生成熟卵泡时降低[16];与乌苏里拟鲿同属鲶形目的印度鲇鱼、革胡子鲇、斑点叉尾等血浆中的 E2水平随着卵黄的积累而不断上升,在产卵发生的后期下降[11];乌塘鳢在卵巢发育至Ⅴ期时 E2水平急速下降[17],这些研究结果与本实验结果相符。值得注意的是,一方面雄性乌苏里拟鲿全年除12月份以外的各月份的性激素(E2和 T)水平均显著低于雌鱼(P<0.05);另一方面雄性鱼的T含量水平在4月底达到最高,此时精巢发育处于第Ⅳ期的初期,而当 5月底精巢发育达到第Ⅳ期后期时,T水平比4月底反而显著降低(P<0.01),并且此时 E2的水平也显著低于雌性鱼(P<0.01)。因此,该雄性鱼的性腺较难成熟。作者在该鱼的人工繁殖生产中也发现,雄性乌苏里拟鲿的成熟度较雌性鱼要差,人工催产后的雌性鱼能很好地排卵和产卵,而雄性鱼即使人工催产后也难以顺利地排精和产精,目前实际生产上一般只能采用杀鱼取精的方法才能完成人工授精。所以,如何通过技术手段提高雄性鱼自身性激素的分泌量,或通过改进人工催产技术适时、适量地注射外源性激素,促使雄鱼自然排精,值得进一步研究。
[1]何华敏,黄鹤忠,范皖苏,等.乌苏里拟鲿的不可逆点-窒息点及其对五种常见渔药的敏感性研究[J].海洋科学,2011,35(4):26-32.
[2]徐汗福,黄鹤忠,范皖苏,等.乌苏里拟鲿野生群体和人工养殖群体遗传多样性的比较研究[J].海洋科学,2011,35(3):17-22.
[3]尹洪滨,姚道霞,孙中武,等.黑龙江鲶形目鱼类的肌肉营养组成分析[J].营养学报,2006,28(5):438-441.
[4]潘伟志,陈军,王鹏,等.乌苏里拟鲿人工繁育技术研究[J].水产学杂志,2006,19(1):31-35.
[5]潘伟志,尹洪滨,孙中武,葛学亮,柯冬蕾.乌苏里拟鲿(Pseudobagrus ussuriensis)同工酶分析[J].东北林业大学学报,2006,34(6):66-69.
[6]秦钦,蔡永祥,许志强,等.长江下游 4属 6种鲿科鱼类线粒体16S rDNA部分序列的比较分析[J].江苏农业学报,2010,26(2):373-376.
[7]陈伟兴,范兆廷,杨洁.黄颡鱼性腺的组织学观察[J].东北农业大学学报,2006,37(2):194-198.
[8]孙大江,曲秋芝,王丙乾,马国军.施氏鲟不同年龄性腺发育与性类固醇激素浓度关系[J].中国水产科学,2004,11(4):307-312.
[9]王晓清,李传武,谢中国,等.鳜雌雄生长差异的研究[J].淡水渔业,2006,36(3):34-37.
[10]杨杰泉,马玉亮,陈洋,王东晖.池养青海湖裸鲤鱼、幼鱼生长初步研究[J].河北渔业,2011,(8):12-14.
[11]杨春玲,刘楚吾.红笛鲷血清性类固醇激素周年变化的初步研究[J].广西农业科学,2010,41(2):174-176.
[12]张照斌,牛翠娟,朱华,胡红霞.室内饲育西伯利亚鲟的血清类固醇激素的周年变化[J].北京师范大学学报,2003,39(4):519-524.
[13]沈卓坤,郑剑辉,陈怀定,赵会宏.双棘黄姑鱼血清性类固醇激素的周年变化[J].广东海洋大学学报,2007,27(3):16-19.
[14]Hess R A,Dabid B,Janice B.Oestrogen,its receptors and function in the male reproductive tract-a review[J].Molecular and Cellular Endocrinology.2001,178(1-2):29-38.
[15]Prat F,Zanuy S,Carrillo M,et al.Seasonal changes in plasma levels of gonadal steroids of sea bass,Dicentrarchus labraxL.[J].General and Comparative Endocrinology,1990,78(3):361-373.
[16]Utpal S,Dola M,Bhattacharyya S P,et al.Seasonal changes in plasma steroid levels in Indian major carpLabeo rohita:influence of homologous pituitary extract on steroid production and development of oocyte maturational competence[J].General and Comparative Endocrinology,2002,128(2):123-134.
[17]洪万树,吴秋艳,张其永.中华乌塘鳢血清性类固醇激素含量与性腺发育的关系及季节变化[J].厦门大学学报(自然科学版),2009,48(2):274-277.
——乌苏里白鲑
