流式细胞术检测虾类血细胞活性氧含量方法的建立
(华南师范大学 生命科学学院,广东省水产健康安全养殖重点实验室,广东省高等学校生态与环境科学重点实验室,广东 广州 510631)
细胞在吞噬过程中,伴随有大量活性氧(Reactive oxygen species,简称ROS)产生的过程称为呼吸爆发。这些活性氧是细胞毒氧化剂,包括超氧阴离子(O2-)、过氧化氢(H2O2)和羟自由基[·OH]等,在杀灭和消化病原微生物的免疫防御中起着十分重要的作用[1-2]。在虾类营养免疫学研究中,呼吸爆发活力常作为反映虾体免疫状况的重要指标。ROS含量也极易受外界胁迫环境的诱导,盐度、pH、温度、重金属等环境应激均会导致 ROS的大量上升,因此ROS含量也是反映虾类是否受到不良因素胁迫的重要指标[3]。这些 ROS在生物体内的寿命很短,建立一种更加快速、灵敏的ROS检测方法尤为重要。
流式细胞术(Flow cytometry,简称FCM)是一种快速、灵敏、准确和检测量大的细胞水平的检测技术,现已逐渐应用到一些贝类的研究中[4-7]。2′,7′-二氢二氯荧光黄双乙酸钠(DCFH-DA)是活性氧的特异探针,它本身不发荧光,可自由穿过细胞膜进入到细胞内,被胞内的酯酶分解为 DCFH而保留在胞内,各类ROS会氧化DCFH为发强绿色荧光的DCF,利用流式细胞仪检测胞内的DCF荧光强度即可反映细胞的ROS水平。此方法在高等哺乳动物的细胞研究中已被广泛应用,但在虾类细胞研究中的应用仍未见报道。由于虾类血细胞和高等动物细胞存在较大的差异,因此本研究对FCM检测虾类血细胞ROS含量的方法中的染料浓度和孵育时间进行优化确定,以期为FCM在虾类细胞学和免疫学研究中的应用推广打下一定的基础。
1 材料和方法
1.1 材料
斑节对虾(Penaeus monodon)购于广东省珠海市某养殖场,体长5~8cm。对虾在实验室驯养一周后,选取附肢完整、无病患、活力强、处于蜕皮间期的个体作为实验用对虾。DCFH-DA和碘化丙锭(PI)均购自Sigma公司。
1.2 方法
1.2.1 血细胞悬液的制备
用 1mL一次性注射器吸取预冷的抗凝剂(葡萄糖20.5 g/L,柠檬酸钠8 g/L,氯化钠4.2 g/L,pH 7.5),然后从虾的围心腔抽取等量的血淋巴。获得足量的血淋巴后,再用预冷的抗凝剂调整细胞浓度约为1×106个/mL。取200 µL测定细胞活性,剩下的血淋巴进行分装4管,每管1.6 mL。
1.2.2 流式细胞仪
实验所用流式细胞仪是美国 BD(Becton Dickinson)公司生产的FACSCalibur,应用CellQuest软件(Becton Dickinson Immunocytometry Systems,San Jose,CA) 进行实验数据的获取和分析。每个样品均获取 10 000个细胞。检测细胞的前向角散射光(Forward light scatter,简称 FSC)和侧向角散射光(Side light scatter,简称SSC),FSC显示细胞的大小,SSC显示细胞的颗粒复杂度。第一荧光通道检测DCF荧光强度,第二荧光通道检测PI荧光强度。
1.2.3 染料浓度和孵育时间对细胞DCF荧光量的影响
以二甲基亚砜(DMSO)为溶剂把DCFH-DA稀释为不同浓度(0.01,0.1,1和10 mmol/L)的工作液,每管血淋巴中分别加入 16 µL各浓度的染料工作液,以获得染料的终浓度分别为0.1,1,10和100 μmol/L。加入染料后在室温下避光孵育,在加入染料后的第0,15,30,45和60分钟分别取200 µL,用200目筛网过滤后上机检测。结果以 DCF荧光量为横坐标,细胞数量为纵坐标的单参数直方图显示,分析 DCF平均荧光量。
1.2.4 染料浓度和孵育时间对细胞形态的影响
在检测DCF荧光量的同时,在FSC为横坐标、SSC为纵坐标的散点图中获取细胞的FSC和SSC数据。比较各组与0 h时的FSC-SSC散点图,分析细胞的形态特征是否受到染料浓度和孵育时间的影响。
1.2.5 染料浓度和孵育时间对细胞活性的影响
为确定不同浓度的染料以及孵育时间是否会对细胞产生毒性,以 PI作为探针,对细胞的活性进行检测。在加入DCFH-DA后第30和60分钟,分别各取200 µL细胞悬液加入10 µg/mL的PI,避光孵育10 min后,200目筛网过滤后上机检测。另设一个不加DCFH-DA的空白对照组。结果以PI荧光量为横坐标,细胞数量为纵坐标的单参数直方图显示。PI是核酸特异性染料,活细胞对 PI低染,死细胞因细胞膜不完整而对 PI高染,在 PI直方图上以标尺(Marker)划定死、活细胞的区域,分析死、活细胞的比例(图1)。

图1 斑节对虾血细胞PI染色直方图Fig.1 PI staining histogram of Penaeus monodon haemocytes
1.3 统计分析
实验重复3次。实验数据利用SPSS 11.5进行统计分析,结果显示为平均值±标准差(Mean ± SD),P<0.05确认为差异性显著,P<0.01确认为差异性极显著。
2 结果
2.1 不同染料浓度和孵育时间的细胞 DCF荧光强度
结果如图2所示,染料浓度为0.1、1和10 μmol/L时,随着孵育时间的延长,细胞 DCF荧光均不断地增强。0.1和1 μmol/L组的细胞DCF荧光强度一直低于10 μmol/L组。10 μmol/L组在前 30 min荧光量急剧上升,30 min后上升较缓。100 μmol/L组在前15 min荧光量高于10 μmol/L组,15 min后上升缓慢并且低于10 μmol/L组,45 min后荧光量下降。

图2 不同DCFH-DA浓度下斑节对虾血细胞DCF平均荧光量随时间的变化Fig.2 DCF mean fluorescence of Penaeusmonodon haemocytes incubated with different concentration of DCFH-DA
2.2 不同染料浓度和孵育时间的细胞形态的影响
如图3-1,DCFH-DA染色的斑节对虾新鲜血细胞通过 FSC-SSC散点图能很好地区分为 3类细胞:透明细胞(R1),半颗粒细胞(R2)和颗粒细胞(R3)。0.1、1和10 μmol/L染料组在60 min内细胞的形态没有明显的变化,能较好地区分 3类细胞。100 μmol/L染料孵育30 min开始细胞呈现固缩现象,部分小颗粒细胞和大颗粒细胞的FSC下降至与透明细胞相似。60 min时细胞固缩现象加剧,有更多的颗粒细胞偏离原来区域,部分细胞SSC下降(图3-2)。
2.3 不同染料浓度和孵育时间的细胞活性的影响
由图4可见,细胞的最初活性为96.3±1.1%。在添加 DCFH-DA 30 min 后,0.1、1、10 和 100 μmol/L组的活细胞比例分别为93.2%、91.5%、92.5%、79.7%,100 μmol/L组显著低于其他组(P<0.05);60 min后,活细胞比例分别为 92.5%、92.2%、86.6%和62.0%,100 μmol/L 组显著低于其他组(P<0.05)。
3 讨论
对于不同的细胞,可能由于细胞表面积、染料的细胞膜透过性和细胞的活性氧含量等因素的不同,其适宜的染料浓度会有所不同。在人类嗜中性粒细胞的研究中,常用的浓度为10 μmol/L[8-9],大鼠巨噬细胞使用 500 μmol/L[10],小鼠成纤维细胞使用 20 μmol/L[11],在一些海洋无脊椎动物的研究中也较常用 10 μmol/L[4,6-7,12],也有的研究使用 5 μmol/L[5],在酵母研究中只使用了10-4μmol/L[13]。理想的染料浓度和孵育时间应符合以下的条件:应在最短的孵育时间内与活性氧较充分地反应并发出荧光;避免对细胞的形态和活性产生影响。因此,染料浓度必须足够,但不能过高,以免对细胞产生毒性影响;孵育时间应尽量缩短,尽量减少血细胞因离体时间过长而导致的各种变化。
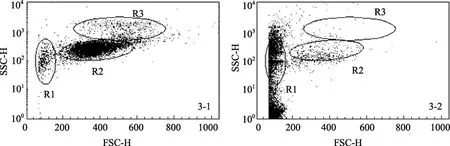
图3 斑节对虾血细胞FSC-SSC散点Fig.3 FSC-SSC dot plot of Penaeus monodon haemocytes
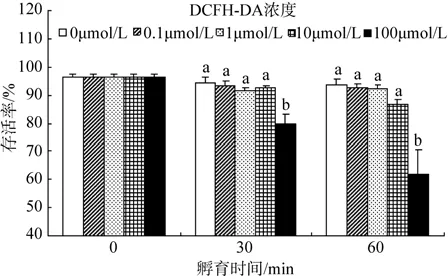
图4 不同DCFH-DA浓度下斑节对虾血细胞的存活率Fig.4 Cell viability of Penaeus monodon haemocytes incubated with different concentration of DCFH-DA
根据以往其他动物细胞的研究,本研究选取了0.1~100 μmol/L中的4个梯度浓度进行检测分析。从细胞荧光量的变化情况看,0.1和1 μmol/L组一直显著低于10 μmol/L组,表明0.1和1 μmol/L染料不足,不能与细胞内的活性氧充分反应;100 μmol/L组虽然一直显著高于0.1和1 μmol/L组,在前15 min也显著高于10 μmol/L组,但30 min后开始显著低于10 μmol/L组,出现这种染料浓度高反而细胞荧光量低的情况,可能是染料浓度过高而对细胞产生了毒性。因此10 μmol/L的染料浓度较适宜。
形态和活性的检测结果也证实100 μmol/L的染料对细胞产生了毒性影响,它导致了细胞的固缩和死亡率的上升。死亡细胞的 DCF荧光量下降,可能有以下的原因:细胞膜破裂而导致活性氧流失到胞外;细胞膜破裂而导致 DCFH和 DCF流失到胞外;细胞因受毒性伤害而酯酶活力下降,DCFH-DA在进入细胞后不能完全被酯酶分解;细胞毒性致死的过程中可能有活性氧参与反应而被消耗。
形态和活性的检测结果显示,染料浓度为 10 μmol/L,孵育 60 min时才使细胞活性有所下降,但不显著,因此表明10 μmol/L DCFH-DA在60 min内对虾血细胞是安全的。但是,虾血细胞在离体后极容易受到刺激而产生各种变化,如脱颗粒、黏连和死亡等[2],因此,对于虾血细胞的 FCM 检测,更应尽量缩短染料的孵育时间。研究结果显示,10 μmol/L组在前30 min细胞的荧光量上升很快,后30 min上升缓慢,表明 30 min的孵育时间已使胞内绝大部分ROS与染料反应,因此综合考虑认为孵育时间在 30 min为宜。
除染料浓度和孵育时间影响细胞的荧光量外,细胞密度也是需要注意的问题。如果细胞密度过大,在相同染料浓度下,每个细胞所分得的荧光探针必然减少,可能达不到饱和状态;另外,如果在染色前各组间没有较统一的细胞密度,这将可能导致染色过程中存在较大的误差。流式细胞仪检测常用的细胞密度为 1×106个/mL,本研究中在染色前已先把细胞密度调整约为 1×106个/mL,因此所测得的适宜染料浓度和孵育时间是这一细胞密度下的适宜值。
此外,本研究中使用的染料溶剂为 DMSO。DMSO是荧光染料的常用溶剂,染料溶解于 DMSO中在-20℃的条件下能较好地保存一段时间。以往的研究已表明微量的DMSO对细胞没有显著的毒性影响[14],因此DMSO可作为安全的溶剂进行使用。
通过本研究确立了利用FCM检测虾血细胞ROS的适宜染料浓度和孵育时间,为FCM在虾类研究中的应用推广打下了一定的基础。FCM可以通过分析细胞的前向角散射光和侧向角散射光特征来区分不同的细胞亚群,因此应用FCM还可以分析不同细胞亚群的 ROS产生量,对于研究不同细胞的功能提供了很好的技术平台,这是其他 ROS检测方法无法做到的。FCM现已应用于多种虾类的血细胞分类[15-16]和倍性分析[17-19]中,可以相信,随着 FCM 技术的不断推广和发展,它在甲壳动物以及其他水生动物研究中的应用也将越来越广泛和深入。
[1]冼健安,王安利,孙敬锋.流式细胞术在水产动物研究中的应用[J].水产科学,2009,28(5):290-294.
[2]Johansson M W,Keyser P,Sritunyalucksana K,et al.Crustacean haemocytes and haematopoiesis[J].Aquaculture,2000,191:45-52.
[3]Le Moullac G,Haffner P.Environmental factors affecting immune responses in Crustacea[J].Aquacluture,2000,191:121-131.
[4]Donaghy L,Kim B K,Hong H K,et al.Flow cytometry studies on the populations and immune parameters of the hemocytes of the Suminoe oyster,Crassostrea ariakensis[J].Fish Shellfish Immunol,2009,27(2):296-301.
[5]Goedken M,De Guise S.Flow cytometry as a tool to quantify oyster defence mechanisms[J].Fish Shellfish Immunol,2004,16(4):539-552.
[6]Lambert C,Soudant P,Jegaden M,et al.In vitro modulation of reactive oxygen and nitrogen intermediate(ROI/RNI) production inCrassostrea gigashemocytes[J].Aquaculture,2007,270:413-421.
[7]Donaghy L,Hong H K,Lambert C,et al.First characterisation of the populations and immune-related activities of hemocytes from two edible gastropod species,the disk abalone,Haliotis discus discusand the spiny top shell,Turbo cornutus[J].Fish Shellfish Immunol,2010,28(1):87-97.
[8]Bass D A,Parce J W,Dechatelet L R,et al.Flow cytometric studies of oxidative product formation by neutrophils:a graded response to membrane stimulation[J].J Immunol,1983,130(4):1 910-1 917.
[9]Rothe G,Valet G.Flow cytometric analysis of respiratory burst activity in phagocytes with hydroethidine and 2′,7′-dichlorofluorescin[J].J Leukoc Biol,1990,47(5):440-448.
[10]王大勇,毕秀丽,周园,等.合成鱼腥草素对巨噬细胞呼吸爆发、细胞内游离钙离子浓度及 T细胞分泌白细胞介素-2的影响[J].沈阳药科大学学报,2003,20(3):210-214.
[11]刘扬,金光辉,刘树铮.流式细胞术在紫外线照射后细胞内活性氧检测中的应用[J].吉林大学学报(医学版),2004,30(6):975-977.
[12]Labreuche Y,Lambert C,Soudant P,et al.Cellular and molecular hemocyte responses of the Pacific oyster,Crassostrea gigas,following bacterial infection withVibrio aestuarianusstrain 01/32[J].Microbes Infect,2006,8(12-13):2 715-2 724.
[13]肖安风,周祥山,周利,等.流式细胞术检测毕赤酵母发酵过程中胞内活性氧水平[J].生物工程学报,2006,22(2):273-277.
[14]Aton E,Renault T,Gagnaire B,et al.A flow cytometric approach to study intracellular-free Ca2+inCrassostrea gigashaemocytes[J].Fish Shellfish Immunol,2006,20(4):493-502.
[15]孙敬锋,冼健安,张铁军,等.流式细胞术比较研究三种对虾血细胞的分群[J].淡水渔业,2008,38(3):18-22.
[16]冼健安,王安利.流式细胞术与显微观察对罗氏沼虾血细胞的比较研究[J].水生态学杂志,2009,2(5):90-94.
[17]刘昕,张俊彬,黄良民.流式细胞仪在海洋生物学研究中的应用[J].海洋科学,2007,31(1):92-96.
[18]周岭华,邓田,张晓军,等.利用流式细胞计进行虾类倍性检测的研究[J].海洋科学,1999,2:42-45.
[19]汪财生,尹尚军,钱国英,等.日本沼虾染色体倍性检测技术的研究[J].海洋科学,2006,30(7):5-8.

