脑星形细胞瘤磁敏感效应级别与1H-MR波谱相对定量的相关性探讨
林 祺,张 强,陈东平,许凯华,陈金银
在临床上对脑星形细胞瘤的准确分级具有重要的预后和治疗意义。高分辨率磁敏感加权像(susceptibility-weighted imaging,SWI)能显示肿瘤微血管等病理变化,已被应用于脑星形细胞瘤分级诊断[1-3]。多体素氢质子MRS (multi-voxel1H MRS,1HMRS)为颅内良恶性肿瘤的诊断提供了定量分析方法。笔者通过探讨脑星形细胞瘤高分辨率SWI瘤内磁敏感信号(intratumoral susceptibility signals,ITSS)级别与多体素1H-MRS相对定量的相关性,旨在评估其对脑星形细胞瘤分级诊断的临床价值。
1 材料与方法
1.1 临床资料
搜集经手术病理证实33例脑星形细胞瘤相关资料。患者年龄9~81岁,男21例,女12例,按2007年WHO中枢神经系统肿瘤分类法,I~II级15例,III~IV级18例。
1.2 检查方法
采用飞利浦Achieva 3.0 T X-series磁共振双梯度成像系统,均采用16通道头线圈辅助成像。每例患者均行T2WI、T1WI、FLAIR、DWI和T1WI增强等扫描。

图1 胶质母细胞瘤 (WHO-IV) 1A:ITSS-III级;1B:Cho/Cr9.47,Cho/NAA5.58;1C:病理显示多发新生微血管,内皮增生(HE ×100) 图2 星形细胞瘤 (WHO-II) 2A:ITSS-I级;2B:Cho/Cr 2.16,Cho/NAA 3.16;图2C:病理显示散在成熟血管,腔内堆积红细胞 (HE ×100)Fig.1 Glioblastoma (WHO-IV).1A:ITSS-III grade,1B:Cho/Cr 9.47,Cho/NAA 5.58,1C:Pathology revealed multiple microvessel,Endothelial hyperplasia (HE ×100).Fig.2 Astrocytoma (WHO-II).2A:ITSS-I grade,2B:Cho/Cr2.16,Cho/NAA3.16,2C:Pathology revealed scattered in the mature blood vessels,Intraluminal accumulation of red cell(HE ×100).
高分辨率SWI及重建:TR 16 ms,TE 22 ms,层厚1 mm,FOV 230 mm×230 mm,在头足、左右和前后方向加流动补偿技术,宽带182.3 Hz,所获SWI图像进行最小信号强度投影(MinIP)后处理,层厚8 mm,间距1 mm。
多体素1H-MRS扫描:采用点解析波谱序列(2D-PRESS法):TR 2000 ms,TE 144 ms,FOV 230 mm×190 mm,层厚10 mm,激励次数1次,每个体素大小为10 mm×10 mm×10 mm。自动预扫描完成匀场及水抑制。
1.3 图像分析
根据ITSS的表现来分4级[1]:ITSS定义为低信号强度,呈细线样或点状结构,伴有或不伴有聚集,位于高分辨率SWI肿瘤内。0级:无ITSS;I级:1~5个点状或细线状ITSS;II级:6~10个点状或细线状ITSS;III级:11个以上点状或细线状ITSS位于肿瘤内的连续区域。在工作站上根据病灶特征进行1H-MRS ROI的测定:首先ROI选择在确定ITSS级别的同一层面;ROI选择肿瘤实质区、边缘区以及对侧正常脑组织,同时要避开骨骼、脑室、血管、坏死、囊变、出血、气体和钙化等区域;最后将1H-MRS ROI的测定图送至PACS。
所有图像由2名主治医师独立进行逐个分析。第1:确定每例在SWI上ITSS最高级别层面;第2:分别记录每例ITSS最高级别层面实质区的胆碱(Cho)/肌酸(Cr),乙酰天冬氨酸(NAA)/Cr,Cho/NAA相对定量比值,脂质(Lip)、乳酸(Lac)、谷氨酸及谷氨酰胺复合物(Glx)和肌醇(mI)等代谢物(图1,2)。
1.4 统计方法
采用SPSS 17.0统计软件进行分析。ITSS级别与高、低级别星形细胞瘤病例数比较采用卡方检验。高、低级别星形细胞瘤Cho/Cr、Cho/NAA相对定量比值的比较采用独立样本t检验。ITSS级别与Cho/Cr、Cho/NAA相对定量比值进行Spearman等级相关分析。均以P<0.05判定为差异有统计学意义。
2 结果
2.1 ITSS级别与高、低级别星形细胞瘤病例数比较具体见表1。
2.2 高、低级别星形细胞瘤Cho/Cr,Cho/NAA相对定量比值
具体见表2。
2.3 ITSS级别与Cho/Cr、Cho/NAA相对定量比值的相关性
本组33例ITSS级别与Cho/Cr相对定量比值的Spearman相关系数r=0.763,P<0.01,二者之间存在正相关关系(图3);而ITSS级别与Cho/NAA相对定量比值的Spearman相关系数r=0.741,P<0.01,二者之间存在正相关关系(图4);因此ITSS级别越高Cho/Cr、Cho/NAA相对定量比值也越大。
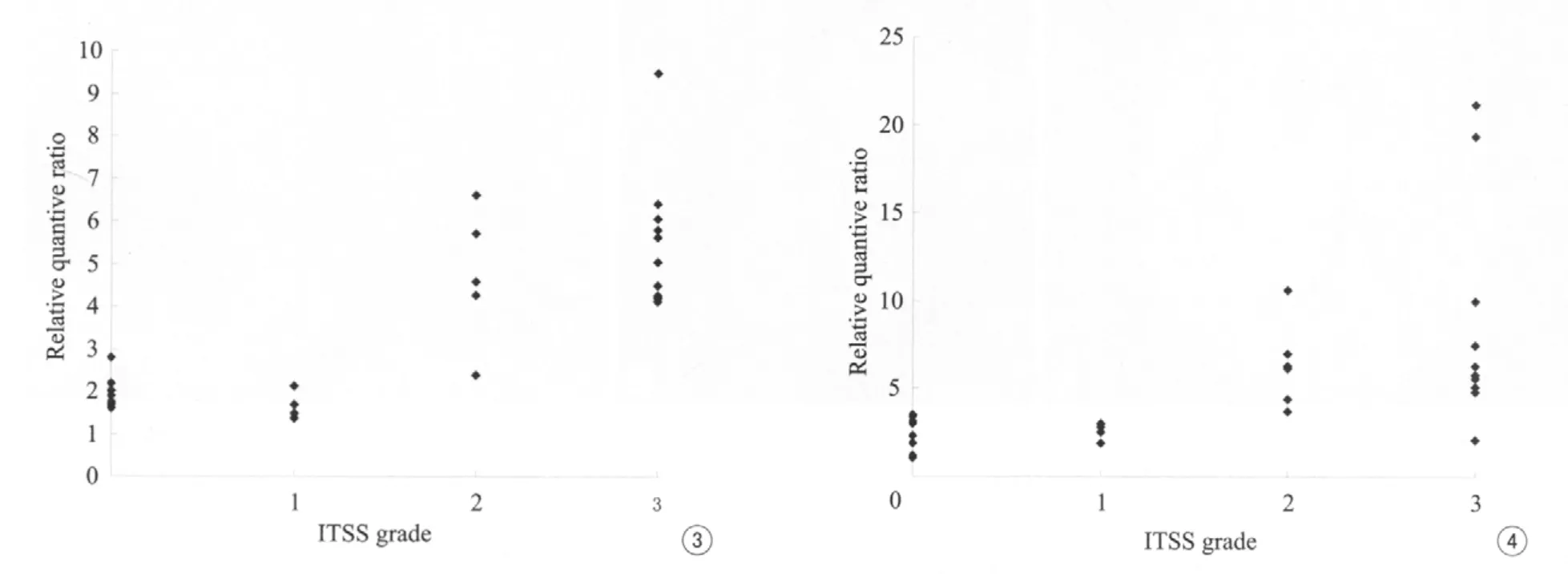
图3 ITSS级别与Cho/Cr相对定量比值散点图 图4 ITSS级别与Cho/NAA相对定量比值散点图Fig.3 ITSS grade and Cho/Cr relative quantitative ratio of scattergraph.Fig.4 ITSS grade and Cho/NAA relative quantitative ratio of scattergraph

表1 ITSS级别与高、低级别星形细胞瘤病例数Tab.1 ITSS grade with the high and low grade astrocytic tumours number of cases
Note:χ2=33.00,P<0.01,The high grade astrocytic tumours of ITSS classification was obviously higher than the low grade astrocytic tumours.
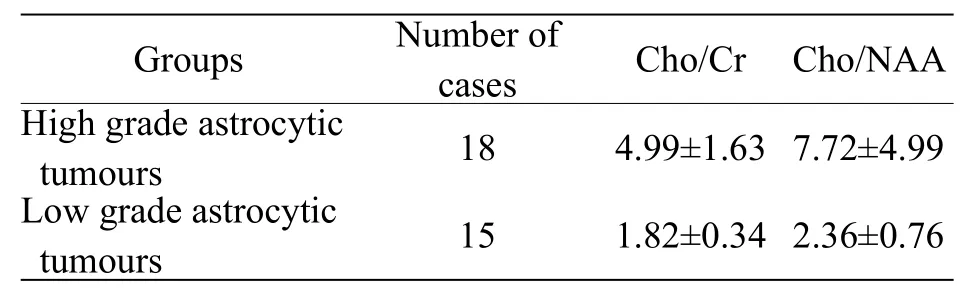
表2 高、低级别星形细胞瘤Cho/Cr、Cho/NAA相对定量比值Tab.2 The high and low grade astrocytic tumours of Cho/Cr,Cho/NAA relative quantitative ratio
3 讨论
3.1 高分辨率SWI评估星形细胞瘤微血管的基础及其分级价值
SWI本质是一种T2*梯度回波,在3个方向上加有完全流动补偿技术,能够保证静止和运动的质子同时重聚,毫米级三维薄层扫描能够获得高分辨率成像以减小伪影,观察细微的血管结构。图像后处理可以对SWI行MinIP,常在4层以上相邻层面投影,产生8 mm层厚的血管重组图,肿瘤内小血管于重组图上显示出明显的连续性,同时可溯源至其引流血管,对微出血做出鉴别[4]。SWI不仅能评估肿瘤的引流静脉和供血动脉,而且能显示亚体素的小静脉(100~200 μm)来推断肿瘤的血管生成程度,对指导肿瘤的术前分级具有积极作用[2-4]。高级别星形细胞瘤含大量的脱氧血红蛋白,可能与血管再生和肿瘤血供增加有关,它能够引起磁敏感效应,导致SWI信号下降,即显示ITSS。因为ITSS出现的频率、形态、大小、数量、空间分布形态(聚集成簇等)在不同级别肿瘤以及在同一肿瘤的不同区域存在不均一性,所以一般按肿瘤内ITSS的频率分为0~III级,以资量化分析。Park[1]等发现所有胶质母细胞瘤病灶ITSS级别最大,间变性星形细胞瘤ITSS级别是可变的,而低级别胶质瘤中见不到ITSS。ITSS级别和星形细胞瘤级别Spearman相关系数为0.88。ITSS级别对星形细胞瘤分级诊断的敏感度、特异度、阳性预测值及阴性预测值分别为85.2%、92.9%、95.8%和76.5%。本组病例SWI在显示肿瘤内异常微血管结构方面明显优于常规序列,对星形细胞瘤分级诊断有临床实用价值。18例 III~IV级星形细胞瘤ITSS均表现为II~III级,15例 I~II星形细胞瘤ITSS分别为0~I级((P<0.01)。
3.2 3.0T多体素1H-MRS评估星形细胞瘤的优势
笔者在本研究采用3.0 T多体素1H-MRS 2DPRESS法,信噪比显著提高,采集时间明显缩短,波谱分辨率更高,基线更加稳定,一次采集覆盖的范围较大,不易受脂肪的影响。多体素能同时观察星形细胞瘤实质区、边缘区和对侧正常区代谢物指标,尚可以采集到如具有短TE (30 ms)的代谢产物,包括mI、Glx等[5]。脑星形细胞瘤的Cho波升高代表肿瘤细胞增殖活跃,NAA减低为神经元损伤和丢失,Cr减低为能量代谢高所致。在同一个体脑内不同代谢条件下,代谢物总量恒定,而相对定量是计算各种代谢物波峰下面积的比值。本研究结果:高级别星形细胞瘤实质区Cho/NAA、Cho/Cr相对定量比值分别为7.72±4.99和4.99±1.63,低级别星形细胞瘤分别为2.36±0.76和1.82±0.34 (((P<0.01),两者差异有统计学意义,与相关报道结果相仿[6]。研究还发现在高级别肿瘤中10例出现增高的Lip峰和7例出现倒置的Lac峰,而在低级别肿瘤中3例出现倒置Lac峰,未见明显增高Lip峰。这些证实了Lip峰常见于高级别星形细胞瘤,是由于肿瘤更容易凝固性坏死、脂质析出;而Lac峰增高是葡萄糖无氧酵解的终产物,反映肿瘤生长过快。因此,Lip峰和Lac峰对肿瘤分级也有重要的价值。
3.3 ITSS级别与1H-MRS相对定量的相关性探讨
星形细胞瘤血管增生的程度、细胞或细胞核的异形性、核内有丝分裂的程度、是否存在坏死是决定肿瘤生物学侵袭性和组织学分级的主要标准,其中肿瘤微血管状态是决定恶性程度及预后最重要指标。刘影等[7]探讨脑星形细胞瘤内部微结构与表观扩散系数(ADC)值相关性,认为ADC值有助于脑星形细胞瘤术前分级评价。SWI是近几年发展起来新技术,可以更清楚地显示不同类型肿瘤和肿瘤内不同部分中血管结构复杂性和多样性,尤其是肿瘤微血管、钙化等病理变化,给诊断和研究脑肿瘤提供新方法。MRS是惟一无创研究活体代谢、生化变化和化合物定量分析的方法。Pinker等[8]利用PET与SWI进行相关性研究发现,病灶内磁敏感效应出现频率和PET对脑肿瘤分级有明显的统计学相关性。有研究报道,MRS的Cho/Cr定量比值增高与SWI肿瘤中代谢物浓度相关[2]。通过本组33例脑星形细胞瘤ITSS级别与Cho/Cr、Cho/NAA相对定量比值相关性分析,结果Spearman相关系数分别为0.763和0.741,P<0.01,呈正相关;因此ITSS级别越高Cho/Cr、Cho/NAA相对定量比值也越大。
[References]
[1]Park MJ,Kim HS,Jahng GH,et al.Semiquantitative assessment of intratumoural susceptibility signals using non-contrast-enhanced high-field highresolution susceptibility-weighted in patients with gliomas:comparison with MR perfusion imaging.AJNR Am J Neuroradiol,2009,30(7):1402-1408.
[2]Mittal S,Wu Z,Neelavalli J,et al.Susceptibility-weighted imaging:technical aspects and clinical applications.Part2.AJNR Am J Neuroradiol,2009,30(2):232-252.
[3]Shen JL,Zhang H,Liu QW,et al.Initial study susceptibility weighted imaging in brain masses.Chin J Magn Reson Imaging,2010,1(1):29-35.沈俊林,张辉,刘起旺,等.磁敏感加权成像对脑肿瘤诊断价值初探.磁共振成像,2010,1(1):29-35.
[4]Haacke EM,Mittal S,Wu Z,et al.Susceptibility-weighted imaging:technical aspects and clinical applications.part 1.AJNR Am J Neuroradiol,2009,30(1):19-30.
[5]Lin Q,Chen JY,Xu KH,et al.3.0 T Multi-Voxel1H-MR spectroscopy in application value of intracranial disease diagnosis.Chin J CT &MRI,2011,9(5):36-38.林祺,陈金银,许凯华,等.3.0T多体素1H-MRS在颅内病变诊断中的应用价值.中国CT和MRI杂志,2011,9(5):36-38.
[6]Yu BL.Differential diagnosis of CT and MR in central nervous system.Shanxi:Shanxi science tech publishing house,2005:9-11.鱼博浪.中枢神经系统CT和MR鉴别诊断.陕西:陕西科学技术出版社,2005:9-11.
[7]Liu Y,Zeng FY,Wang CX,et al.Correlation of microarchitecture and apparent diffusion coefficient value in astrocytoma.Chin J Magn Reson Imaging,2011,2(1):47-49.刘影,曾飞雁,王昌新,等.星形细胞肿瘤内部微结构与ADC值相关性研究.磁共振成像,2011,2(1):47-49.
[8]Pinker SA,Noebauer-Huhmann IM,Starrou I,et al.Highresolution contrast-enhanced,susceptibility-weighted MR imaging at 3T in patients with brain tumors:correlation with positron-emission tomography and histopathologic findings.AJNR Am J Neuroradiol,2007,28(7):1280-1286.

