内镜超声联合经肛门内镜微创手术治疗直肠肿瘤29例体会
戴小明, 黄秋林, 贺更生, 罗加兴, 余子建
(南华大学附属第一医院普通外科,湖南衡阳 421001)
内镜超声联合经肛门内镜微创手术治疗直肠肿瘤29例体会
戴小明, 黄秋林, 贺更生, 罗加兴, 余子建
(南华大学附属第一医院普通外科,湖南衡阳 421001)
目的:总结内镜超声联合经肛门内镜微创手术(transanal endoscopic microsurgery,TEM)治疗经验,探讨其在直肠肿瘤中的治疗效果.方法:回顾分析我院2009年7月-2011年9月29例内镜超声联合经肛门内镜微创手术治疗直肠肿瘤患者临床资料,其中为直肠腺瘤12例,早期直肠癌和腺瘤癌变10例,直肠炎性息肉及直肠间质瘤等粘膜下结节共7例.距肛缘为5~15 cm.术后平均随访5~17月.结果:29例全部成功完成TEM术式,其中2例术后病理证实为T2期直肠癌,1例进一步扩大手术行TME,另1例拒绝进一步手术而放弃.肠壁全层切除17例,粘膜下及部分肌层切除12例.所有标本切缘均为阴性.手术时间35~130 min,平均时间70 min;术中失血2~20 mL,平均失血7 mL.术后并发出血2例,泌尿系感染1例.术后住院日3~8 d,平均住院日5 d;术后随访5~17月,除1例外未发现肿瘤复发及转移.结论:内镜超声联合TEM治疗直肠肿瘤具有定位准确、手术创伤小、出血少、恢复快等优点,是直肠肿瘤局部切除理想的方法,但须严格掌握适应症.图3,参10.
内镜超声;经肛门内镜微创手术;直肠肿瘤;局部切除
相较于传统的直肠肿瘤根治性手术的大创伤、术后排尿、性功能障碍、低位肿瘤无法保肛的特点,局部切除具有克服了上述缺点,患者恢复快,住院时间短,节约医疗费用等多项优势[1,2].但传统的局部切除技术常存在操作困难,视野小,疗效仍不满意.德国学者 Buess等[3]于20世纪80年代开始研创的集内镜、腹腔镜和显微于一身TEM手术系统,解决了传统局部切除遇到的困难,是目前国际上直肠肿瘤局部切除较为理想的术式.我院于2009年7月~2011年9月开展了内镜超声联合经肛门内镜微创手术治疗直肠肿瘤,共计29例,疗效满意,现报告如下:
1 资料与方法
1.1 一般资料
该组29例,其中男18例,女11例;年龄35~84岁,平均67岁;患者术前均常规行结直肠镜及镜下活组织病理学检查、肛门指检及内镜超声检查,术前诊断为直肠腺瘤(包括腺管状腺瘤和绒毛管状腺瘤)12例,早期直肠癌和腺瘤癌变10例,直肠炎性息肉及直肠间质瘤等粘膜下结节共7例.距肛缘距离为5~15 cm.平均10.4 cm 病灶直径1~3.0 cm.纳入标准:距肛缘5~15 cm各种直肠良性腺瘤、早期直肠癌(Tis期和T1期癌)、早期直肠类癌、早期直肠间质瘤(瘤体直径≤3 cm)等.排除标准:对于术前病理学诊断为直肠癌和腺瘤癌变,行CT增强检查发现远处转移者或淋巴结怀疑转移者;肿瘤瘤体直径>3 cm者;有肛裂、肛瘘患者;不能耐受麻醉或手术者.
1.2 方 法
采用椎管内麻醉或气管插管全麻.手术操作方法:根据病灶在直肠内的位置,按将病灶放在术野正下方的原则选择适当的体位.扩肛后经肛门将插入直肠镜,找到病灶后将直肠镜固定于手术床.向直肠内注入CO2气体,保持肠腔内气压控制在约12~15 mmHg,术中内镜超声定位并了解肿瘤深度,病灶定位后先用针形电刀点灼出拟切除的边界线(见图1):如为良性病变其切缘可距病灶外约0.5 cm,如为恶性病变则在1 cm以外,如病灶的性质尚不明确则按恶性处理.切口深度依据肿瘤性质及位置深度决定(见图2).缺损的直肠创口经冲洗止血后用3~0的可吸收线作全层连续缝合(见图3).如病灶较大则以横向缝合方式进行,以地避免术后出现肠腔狭窄.手术切除的肿瘤标及时送病检,行快速冰冻及石蜡切片检查,并进行病理分期(T分期).全组29例患者均获术后随访,随访时间5~17个月;电话随访术后症状,定期门诊复查结直肠镜及肛门指检;对直肠癌或腺瘤癌变患者还需行胸片、腹部B超、盆腔CT和血清癌胚抗原水平检查.
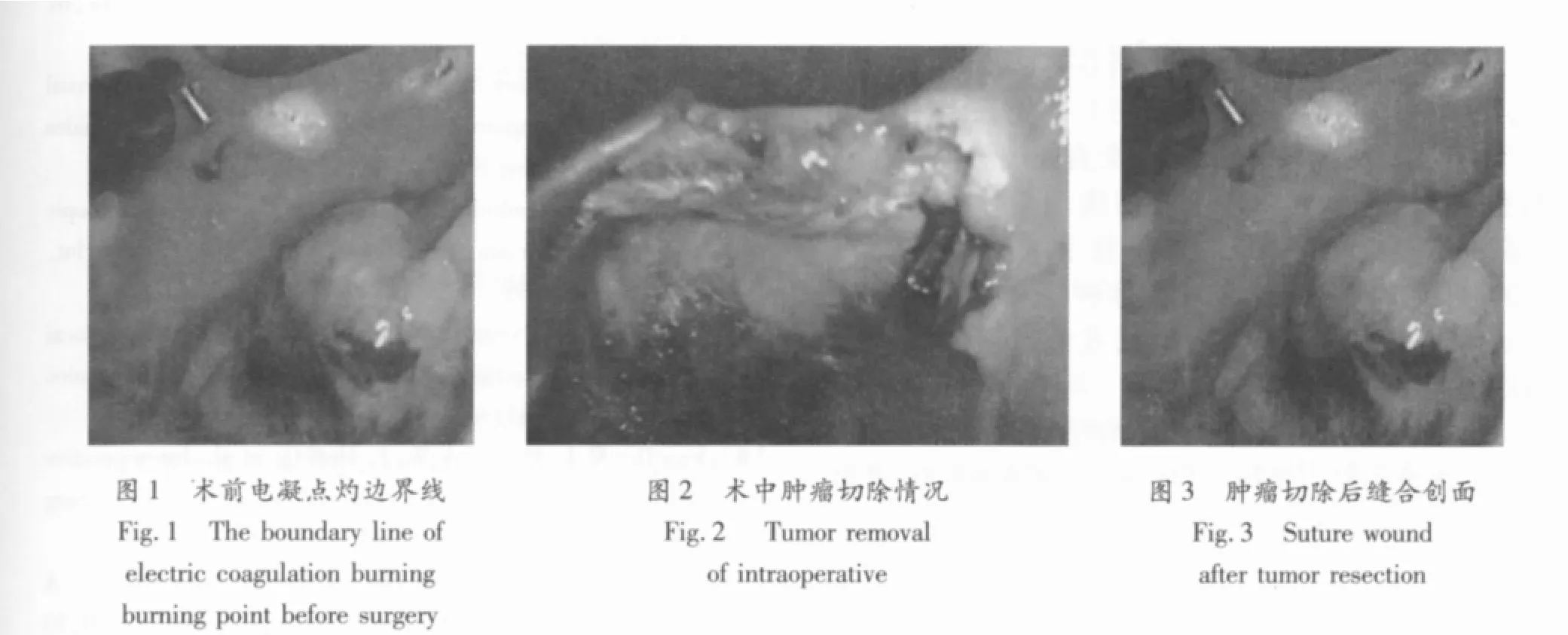
2 结果
29例患者全部成功完成TEM术式,其中2例术后病理证实为T2期直肠癌,1例进一步扩大手术行腹腔镜下TME,另1例为老年患者拒绝进一步手术治疗而选择放化疗.肠壁全层切除17例,粘膜下及部分肌层切除12例.所有标本切缘均为阴性.手术时间35~130 min,平均时间70 min;术中失血2~20 mL,平均失血7 mL.术后并发肛门出血2例,泌尿系感染1例,经药物治疗痊愈.术后住院日3~8 d,平均住院日5 d;术后随访5~17月,除1例术后病理证实为T2期直肠癌而未进一步手术的患者术后1年局部复发;其余未见复发及转移.
3 讨论
结直肿瘤在我国是常见病及多发病,其中尤以直肠肿瘤多见[4].由于腹腔镜下技术的发展,腹腔镜下结直肠肿瘤根治手术能在一定程度上减轻病人创伤,对于恶性肿瘤虽然在一定程度上降低了复发率,但仍然存在内环境影响大、腹腔内创伤大、生殖和泌尿功能受损等问题[5,6],尤其是对于良性肿瘤及早期恶性肿瘤.因此随着微创技术的发展,精准手术概念的引入,我们在考虑肿瘤根治、提高患者生存率的原则下,同时尽量减少创伤、改善患者的生活质量.传统的局部切除手术方式有经肛门[1]、经骶及经括约肌切除术[2]等,但由于难以达到较高的位置并取得满意的视野,所以其临床应用受到限制.
该组研究发现TEM解决了传统局部手术牵引器或直肠镜暴露差的问题,手术视野清楚,结合内镜超声定位,了解肿瘤分布层次或侵犯的深度,达到并完整切除目的;该组术后随访结果显示除1例术后病理证实为T2期直肠癌而未进一步手术的患者术后1年局部复发外,余患者均未见局部复发,同时,TEM不损伤括约肌功能,所有患者无大便失禁及排便习惯改变等,且由于可以选择椎管内麻醉对患者内环境干扰少、手术创伤小、术中微创操作失血少、术后疼痛轻,并发症少10%(3/29),尤其是对于老年患者及合并心肺功能不全患者,尤具有较好优势;因此患者术后恢复快和住院时间短;且体患者体表无手术瘢痕.
该组有2例术后病理证实为T2期直肠癌,1例进一步扩大手术行TME,术后随访1年未复发,另1例拒绝进一步手术而放弃根治切除,术后随访1年后局部复发.虽然由于该组病例早期直肠癌病例少尚不足以说明问题,但Mellgren A[7]等对于早期直肠癌局部切除的研究表明,T2期以上直肠癌,术后有较高的肿瘤局部复发率,.因此,笔者认为对于早期直肠癌患者,术前应完善结直肠镜下活组织检查、内镜超声检查或直肠 CT、MRI,甚至 PET-CT,尽量对直肠癌的组织学分级和TNM分期作出准确和客观的评估,以选择合适病例.该组病例发现术中内镜超声检查对直肠癌T分期具有很好的诊断价值,正确率达80%(8/10);但仍有2例在术前评估为T1期而术后病理诊断为T2期直肠癌患者,因此,如术后的快速冰冻切片及石蜡病理切片报告分期提高的患者应及时采取根治补救手术.该组术后较低的总局部复发率,正说明良性肿瘤及早期直肠癌才是TEM良好的适应症;因此,我们严格把握TEM适应症.
总之,内镜超声联合TEM治疗直肠肿瘤具有微创[8]、快速康复[9]、符合自然孔道内镜外科的理念的优势[10],其具有较好的应用前景,但须严格掌握适应症.
[1]刘宝华.经肛门内窥镜微创手术在直肠肿瘤切除术中的应用[J].消化外科,2006;5(5):373-376.
[2]邱辉忠.直肠癌经肛门括约肌手术的技巧[J].中华普外科手术学杂志(电子版),2009,3(2):475-479.
[3]Buess GF,Raestrup H .Transanal endoscopic microsurgery[J].Surg Oncol Clin N Am,2001,10(3):709-731.
[4]Ahmedin Jemal D V M,Freddie Bray,Melissa M,et al.Global Cancer Statistics[J].CA Cancer J Clin 2011,61(2):69-90.
[5]Sartori CA,Sartori A,Vigna S,et al.Urinary and sexual disorders after laparoscopic TME for rectal cancer in males[J].J Gastrointest Surg,2011,15(4):637-643.
[6]Bärlehner E,Benhidjeb T,Anders S,et al.Laparoscopic surgery for colon and rectal cancer[J].Surg Technol Int.2004,(13):93-99.
[7]Mellgren A,Sirivongs P,Rothenberger DA,et al.Is local excision adequate therapy for early rectal cancer Dis Colon Rectum.2000,43(8):1 064-1 671.
[8]Van Det M J,Meijerink W.J,Hoff C,et al.Interoperative efficiency in minimally invasive surgery suites[J].Surg Endosc,2009,23(10):2332-2337.
[9]Carter J,Szabo R,Sim W W,et al.Fast track surgery:A clinical audit[J].Aust N Z J Obstet Gynaecol,2010,50(2):159-163.
[10]Marks J H.TEM as a Platform for NOTES[J].J Gastrointest Surg.2011,15(8):1 313-1 315.
Experiences on Application of Endosonography Combined Transanal Endoscopic Microsurgery in 29 Patients with Rectal Neoplasms
DAI Xiao-ming,HUANG Qiu-lin,HE Geng-sheng,LUO Jia-xing,YU Zi-jian
(Department of General Surgery,the First Affiliated Hospital of University of South China,Hengyang 421001,China)
To summary the experience of endosonography combined TEM,and explore its effect on rectal neoplasms.Methods:Retrospective analyzed the medical records of 29 patients which 12 cases with colorectal adenomas,10cases of rectal adenocarcinomas or carcinomatous changes of adenomas,and 7 cases of inflammatory polyps,stromal tumor or other submucous nodes treated by endosonography combined TEM from july 2009 to September 2011.postoperative follow-up in 5 ~17 months.Results:29 cases performed successfully by TME.one case was converted to TME and another one declined further surgery and given up because of postoperative pathology T2stage for rectal cancer.Surgical procedures included the transmural excision 17cases and the submucosal excision with partialmuscular layer excision 12 cases.Surgical margins of all specmiens were negative.operative time was 35to 130min,an average of 70min,bleeding volume in operation was 2 to 20mL,an average of 7mL.Complications in the short-term after operation was hemorrhage 2cases and urinary infection 1 cases.The postoperative hospital stay was 3day to 8 day an average of 5 days.postoperative follow-up in 5-17 months.,no tumor recurrence or metastasis was observed.Conclusions:Endosonography combined TEM is a preferred procedure for local excision of rectal neoplasms,with accurate positioning,mininally operation injury,less bleeding,rapid recovery,and other advantages,but indications should be strictly controlled.3figs.,10refs.
endosonography;transanal endoscopic microsurgery;rectal neoplasms;local excision
R735.37
B
1671-6361(2012)02-0024-03
2012-05-02
戴小明(1974-),男,湖南衡南人,博士,研究方向:普外科.

