CIK细胞辅助治疗Ⅲ期胃癌
石亮荣,蒋敬庭,吴 骏,邓海峰,张红宇,陆明洋,李 敏,徐 斌,赵洁敏,吴昌平
(苏州大学附属第三医院、常州市第一人民医院肿瘤科,江苏常州213003)
CIK细胞辅助治疗Ⅲ期胃癌
石亮荣,蒋敬庭,吴 骏,邓海峰,张红宇,陆明洋,李 敏,徐 斌,赵洁敏,吴昌平
(苏州大学附属第三医院、常州市第一人民医院肿瘤科,江苏常州213003)
目的 分析细胞因子诱导的杀伤细胞(CIK)辅助治疗Ⅲ期胃癌的临床意义。方法 对88例Ⅲ期胃癌根治术后行6周期化疗患者资料进行回顾性分析,其中43例患者于辅助化疗结束后接受CIK细胞治疗至少3个周期为CIK治疗组,45例患者单纯化疗为对照组。对CIK细胞治疗前后T细胞亚群检测结果进行随访观察,对2组总生存期与无瘤生存期进行比较。结果 第1次CIK细胞治疗后2周时,CD3+细胞与CD4+/CD8+比值显著升高,2个月时又下降到接近治疗前水平,而CIK细胞连续治疗3周期后2个月CD3+细胞与CD4+/CD8+比值均维持在高水平。CIK治疗组与单纯化疗组的中位生存期分别为(42.0±2.6)个月与(36.0±2.9)个月,2组中位无瘤生存期分别为(34.0±2.7)个月与(25.0±2.8)个月,2组总生存期与无瘤生存期比较差异均有统计学意义(P均<0.05)。结论 采用CIK细胞辅助治疗Ⅲ期胃癌可以改善患者免疫功能,延缓肿瘤复发,延长患者生存期。
胃癌;细胞因子诱导的杀伤细胞;过继免疫治疗;辅助化疗
全世界大约2/3的胃癌发生在发展中国家,其中我国约占42%[1],局部晚期胃癌患者的预后较差,即使经过根治性切除术与术后辅助放疗或辅助放化疗,大多数仍会出现复发与转移,5 a生存率只有30%~40%[2-3]。合理应用辅助化疗与生物治疗等综合治疗是提高患者生存率的有效手段。细胞因子诱导的杀伤细胞(cytokine-induced killer cells,CIK)可在体外进行大量扩增,具有对肿瘤细胞的直接杀伤活性以及能调解宿主免疫功能等优势[4-5],已广泛应用于实体肿瘤的治疗。现对Ⅲ期胃癌患者辅助化疗结束后行辅助CIK细胞免疫治疗的疗效作回顾性对照研究。
1 资料与方法
1.1 一般资料 选择2001年1月至2005年12月在我院行胃癌根治术的患者,术后病理根据 UICC (1997)分期标准证实为Ⅲ期;未并发其他恶性肿瘤; Karnofsky评分≥70分;术前未经放疗与任何方案化疗;术后完成以氟尿嘧啶为基础的辅助化疗6周期。满足以上条件且化疗结束后行CIK细胞治疗3周期以上者共43例,为CIK治疗组。从以上时间段病历档案中电脑随机选出胃癌术后患者100例,按以上标准共筛选出单纯化疗病例45例,为单纯化疗对照组。2组影响预后的重要因素等具有可比性(P>0.05)。见表1。
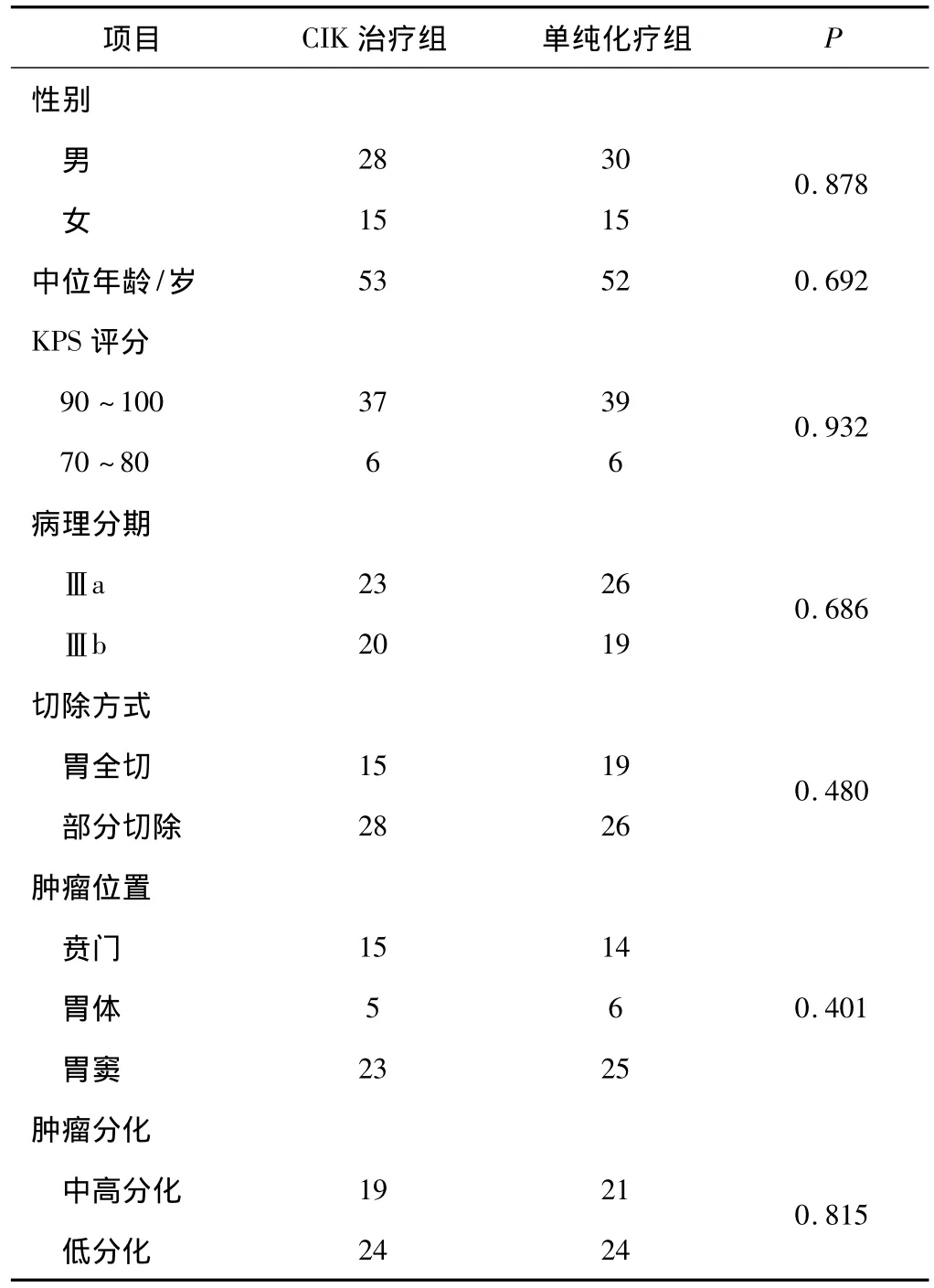
表1 入组病例一般资料 例
1.2 CIK细胞的制备与治疗 CIK细胞的制备、表型及细胞毒活性检测,参见文献[6]。CIK细胞治疗:化疗6周期结束1至2个月内,取CIK细胞(1×1010)制成悬液,静滴,1 h内滴完,隔天1次,共5次为1周期,2~3个月接受1周期治疗,共3~6周期。
1.3 T细胞亚群分析 空腹取5 mL静脉血抗凝,利用流式细胞仪进行T细胞亚群检测。
1.4 随访 所有入组患者全部随访,至2011年10月,随访15~80个月,中位随访40个月。
1.5 统计学处理 采用SPSS 13.0进行统计分析,计量资料以均数±标准误表示,比较采用两样本均数t检验;采用寿命表法计算3、5 a生存率,生存资料分析采用Kaplan-Meier法及Log rank检验。检验水准α= 0.05。
2 结果
2.1 CIK细胞治疗前后免疫指标的变化 CIK治疗组有完整T细胞亚群资料者35例,包括CIK治疗前、治疗后2周,以及治疗后2个月均行T细胞亚群检测。第1次CIK输注后2周时,CD3+比例及CD4+/CD8+明显升高,而治疗后2个月时检测结果接近于治疗前,经连续3周期CIK治疗后2个月,以上指标维持在较高的水平。见表2。
2.2 术后生存状况 CIK治疗组43例患者中36例死亡,3、5 a生存率分别为(67.4±7.1)%、(24.5± 6.9)%,中位生存期为(42.0±2.6)个月;单纯化疗组45例患者中44例死亡,3、5 a生存率分别为(46.7± 7.4)%、(13.3±5.1)%,中位生存期为(36.0±2.9)个月。2组比较差异有统计学意义(P=0.045)。见图1。
2.3 术后无瘤生存期 CIK治疗组42例患者出现肿瘤复发,3、5 a无瘤生存率分别为(41.9±7.5)%、(12.8±5.1)%,中位无瘤生存期为(34.0±2.7)个月;单纯化疗组45例患者均出现肿瘤复发,3、5 a无瘤生存率分别为(22.4±6.4)%、(4.4±3.1)%,中位无瘤生存期为(25.0±2.8)个月。2组比较差异有统计学意义(P=0.040)。见图2。
3 讨论
胃癌根治术后超过半数的患者会出现原位或者血源性复发[7]。多项研究表明,胃癌术后的辅助化疗或辅助放化疗可延长患者生存期[2,8],但长期生存结果仍不理想。理论上,化疗后残存肿瘤细胞的清除依赖于机体的免疫系统,然而多周期的化疗会在一定程度上造成免疫功能低下,这可能是经辅助化疗后复发率仍然比较高的重要原因之一。

表2 CIK细胞治疗前后外周血淋巴细胞表型流式分析结果

抗肿瘤过继免疫治疗是备受推崇的“绿色”疗法,应用比较广泛的免疫细胞有LAK、CD3-AK、TIL与CIK细胞。前三者的总体抗瘤活性较低,LAK与CD3-AK的增殖能力差,而TIL来源有限,临床应用受到限制。CIK成为了最具临床应用前景的免疫细胞之一。CIK是一种异质细胞群,其主要的效应细胞是 CD3+CD56+细胞[9]。CIK细胞具有很高的存活率和增殖能力,对靶细胞的识别结合是非TCR和非MHC限制性的[10],对靶细胞具有很强的直接杀伤活性。CIK细胞输注后在体内能进一步活化,可分泌多种细胞因子,调节机体的免疫功能,进一步提高免疫效应细胞的细胞毒作用[5]。另外,CIK细胞对自体与异体肿瘤细胞均有杀灭作用[11-12],而且能对多药耐药细胞及FasL阳性的细胞也有效[13-14],因此,理论上CIK细胞与化疗联合应用能起到增效作用。本肿瘤研究中心已经建立CIK细胞治疗平台,研究发现在体外经过大量细胞因子诱导培养后,CIK细胞其数量可扩增700倍以上,在第14、21天时细胞数量与活性均达到高峰[4,15],因此作者选择培养至第14天开始进行回输。
CIK细胞已经广泛应用于晚期胃癌、肝癌、肺癌等实体肿瘤的治疗,CIK细胞与化疗等其他治疗手段联合应用有助于提高患者生存质量、延长生存期[6,16-18]。本肿瘤研究中心报道了CIK细胞联合化疗可提高晚期胃癌患者2 a生存率[6],并发现增加CIK细胞治疗频率可进一步延长胃癌患者的生存期[19]。局部晚期胃癌复发率高,即使经过根治性切除术与术后的辅助化疗,5 a生存率仍较低,术后辅助免疫治疗可能是提高生存率的有效手段。术后辅助化疗后,体内对化疗敏感的残存肿瘤细胞大部分得到清除,但化疗会在一定程度上造成机体免疫功能的低下,因此化疗结束后是免疫治疗的较好时机。本研究结果表明,化疗结束后大部分患者CD3+比例及CD4+/CD8+比值明显低于正常值,CIK细胞治疗后2周时,CD3+细胞与CD4+比例显著上升,但单次治疗2个月后检测结果与治疗前无显著差异,而CIK细胞连续治疗3周期后,CD3+与CD4+/CD8+比值能长时间维持在较高水平,说明单次CIK细胞治疗产生的治疗效应是有限的,连续多周期的治疗产生累积效应才能长时间改善患者的免疫状态,所以本研究选择CIK细胞治疗3周期以上者为研究组。生存随访结果表明,CIK细胞治疗组3、5 a生存率分别为(67.4±7.1)%、(24.5± 6.9)%,中位生存期为(42.0±2.6)个月;单纯化疗组3、5 a生存率分别为(46.7±7.4)%、(13.3±5.1)%,中位生存期为(36.0±2.9)个月。2组生存率比较具有统计学意义(P=0.045)。
研究结果提示,对于Ⅲ期胃癌术后化疗后进行CIK细胞治疗可改善患者免疫功能,延长患者生存期。该结果尚需更大样本的前瞻性对照研究证实。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2] Macdonald JS,Smalley SR,Benedetti J,et al.Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction[J].N Engl J Med,2001,345(10):725-730.
[3] Msika S,Benhamiche AM,Jouve JL,et al.Prognostic factors after curative resection for gastric cancer.A population-based study[J].Eur J Cancer,2000,36(3):390-396.
[4] Schmidt-Wolf IG,Negrin RS,Kiem HP,et al.Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity[J].J Exp Med,1991,174 (1):139-149.
[5] Gritzapis AD,Dimitroulopoulos D,Paraskevas E,et al.Large-scale expansion of CD3(+)CD56(+)lymphocytes capable of lysing autologous tumor cells with cytokine-rich supernatants[J].Cancer Immunol Immunother,2002,51(8):440-448.
[6] Jiang J,Xu N,Wu C,et al.Treatment of advanced gastric cancer by chemotherapy combined with autologous cytokine-induced killer cells[J].Anticancer Res,2006,26(3B):2237-2242.
[7] Gunderson LL,Sosin H.Adenocarcinoma of the stomach:areas of failure in a re-operation series(second or symptomatic look)clinicopathologic correlation and implications for adjuvant therapy[J].Int J Radiat Oncol Biol Phys,1982,8(1):1-11.
[8] Kollmannsberger C,Budach W,Stahl M,et al.Adjuvant chemoradiation using 5-fluorouracil/folinic acid/cisplatin with or without paclitaxel and radiation in patients with completely resected high-risk gastric cancer:two cooperative phaseⅡstudies of the AIO/ARO/ ACO[J].Ann Oncol,2005,16(8):1326-1333.
[9] Schmidt-Wolf IG,Lefterova P,Mehta BA,et al.Phenotypic characterization and identification of effector cells involved in tumor cell recognition of cytokine-induced killer cells[J].Exp Hematol,1993,21(13):1673-1679.
[10]Hoffman DM,Gitlitz BJ,Belldegrun A,et al.Adoptive cellular therapy[J].Semin Oncol,2000,27(2):221-233.
[11]Scheffold C,Brandt K,Johnston V,et al.Potential of autologous immunologic effector cells for bone marrow purging in patients with chronic myeloid leukemia[J].Bone Marrow Transplant,1995,15 (1):33-39.
[12]Johnson BE,Bridges JD,Sobczeck M,et al.Patients with limitedstage small-cell lung cancer treated with concurrent twice-daily chest radiotherapy and etoposide/cisplatin followed by cyclophosphamide,doxorubicin,and vincristine[J].J Clin Oncol,1996,14 (3):806-813.
[13]Schmidt-Wolf IG,Lefterova P,Johnston V,et al.Sensitivity of multidrug-resistant tumor cell lines to immunologic effector cells[J].Cell Immunol,1996,169(1):85-90.
[14]Verneris MR,Kornacker M,Mail¨ander V et al.Resistance of ex vivo expanded CD3+CD56+T cells to Fas-mediated apoptosis[J].Cancer Immunol Immunother,2000,49(6):335-345.
[15]吴昌平,蒋敬庭,邓海峰,等.CIK细胞体外培养的免疫表型[J].江苏医药,2005,31(9):644-645.
[16]Stroncek D,Berlyne D,Fox B,et al.Developments in clinical cell therapy[J].Cytotherapy,2010,12(3):425-428.
[17]Wu C,Jiang J,Shi L,et al.Prospective study of chemotherapy in combination with cytokine-induced killer cells in patients suffering from advanced non-small cell lung cancer[J].Anticancer Res,2008,28(6B):3997-4002.
[18]Weng DS,Zhou J,Zhou QM,et al.Minimally invasive treatment combined with cytokine-induced killer cells therapy lower the short-term recurrence rates of hepatocellular carcinomas[J].J Immunother,2008,31(1):63-71.
[19]Jiang JT,Shen YP,Wu CP,et al.Increasing the frequency of CIK cells adoptive immunotherapy may decrease risk of death in gastric cancer patients[J].World J Gastroenterol,2010,16(48):6155-6162.
Adjuvant Immunotherapy with CIK Cells for StageⅢGastric Cancer
Shi Liangrong,Jiang Jingting,Wu Jun,Deng Haifeng,Zhang Hongyu,Lu Mingyang,Li Min,Xu Bin,Zhao Jiemin,Wu Changping
(Department of Oncology,the Third Affiliated Hospital of Suzhou University,Changzhou213003,China)
ObjectiveTo estimate the clinical significance of autologous cytokine-induced killer cells(CIK cells) in the adjuvant treatment of stageⅢgastric cancer.MethodsIn the retrospective study,a total of 88 patients with stageⅢgastric cancer who
6 cycles of chemotherapy after radical gastrectomy were enrolled in the study.Among of them,the 43 patients of the CIK group received 3 cycles of additional CIK cells transfusion after chemotherapy,the 45 patients of the control group received chemotherapy alone.The changes of T-cell subgroup before and after CIK transfusion was observed,and the disease-free survival time and the overall survival time were compared between the two groups.ResultsCD3+T cells and the ratio of CD4+/CD8+were significantly increased in 2 weeks after CIK transfusion,then recovered to the level closed to pre-transfusion in 2 months after CIK transfusion,and maintained on the high levels in 2 months after 3 cycles of CIK transfusion.The median overall survival time of the CIK group and the control group were(42.0±2.6)months and(36.0±2.9)months respectively(P=0.045).The median disease-free survival time of the two groups were(34.0±2.7)months and(25.0±2.8)months respectively(P=0.040).ConclusionAs the adjuvant treatment of stageⅢgastric cancer,CIK transfusion could improve the immunologic function of patients,and may prolong overall time and disease-free survival time.
gastric cancer;cytokine-induced killer cells;adoptive immunotherapy;adjuvant chemotherapy
R735.2;R730.54
A
1673-5412(2012)03-0240-04
国家自然科学基金(编号:81171653、30972703);江苏省自然科学基金(编号:BK2011246、BK2011247);江苏省卫生厅医学科技发展基金(编号:P200932、P200933);常州市卫生局项目(编号:WZ200824)
石亮荣(1977-),男,硕士,主治医师,主要从事肿瘤生物治疗。E-mail:shiliangr@126.com
吴昌平(1961-),男,教授,主要从事肿瘤免疫与生物治疗研究。E-mail:newwcp@163.com
2012-03-23)

