三磷酸腺苷二钠盐增强大鼠比目鱼肌肌梭传入放电活动
石磊樊小力曹若男廉西娟
1 西安交通大学体育部(陕西西安710049)2西安交通大学医学院生理学教研室 3西北大学外国语学院
运动减退、制动或失重可导致骨骼肌发生废用性萎缩[1,2]。肌梭传入放电减少是废用性肌萎缩发生的重要原因之一[3,4]。因此,能加强肌梭传入活动的药物或可对抗废用造成的肌肉萎缩。我室前期研究发现,一定浓度的三磷酸腺苷二钠盐(Na2ATP)注射液可兴奋肌梭,增加离体蟾蜍单一肌梭的传入放电[5]。但在整个机体的层面上,Na2ATP对肌梭是否也有兴奋作用?本研究采用分离神经细束在体记录比目鱼肌肌梭传入放电的方法,观察Na2ATP注射液对大鼠比目鱼肌肌梭传入放电的影响,进一步探讨Na2ATP预防和治疗废用性肌萎缩的可能机制。
1 材料与方法
1.1 实验动物与药品
实验动物:选用健康Sprague-Dawley品系雌性大鼠30只,体重220~240g,由西安交通大学医学院实验动物中心提供(陕动字第08-005号)。
药品:Na2ATP注射液,规格:20 mg·2ml-1,国药准字H32023506,上海通用药业股份有限公司生产。
1.2 主要实验仪器
鼠脑立体定位仪(VDT-1,西北光学仪器厂),双线记忆示波器(VC11,日本NIHON KONDEN公司),生物物理放大器(AVB-11A,日本NIHON KONDEN公司),张力换能器(TB611T,日本NIHON KONDEN公司),载波放大器 (AP-621G,日本 NIHON KONDEN公司),生物物理信号处理系统(Smup-PC-1,上海嘉龙教学仪器厂)。
1.2 在体实验动物手术
实验动物用乌拉坦(1.5 g/kg)腹腔注射麻醉后,行气管插管术和颈外静脉插管术。逆行分离比目鱼肌神经直至胫神经处,暴露坐骨神经干及其主要分支。将动物固定于脑立体定位仪上,制备下肢液体石蜡油槽。大鼠肛温保持在37~38℃之间。持续监测动物心电图,R-R间期维持在120~160 ms,若生理指标超出正常范围即终止实验。每次给药均由颈外静脉插管快速注入。实验过程中,对动物的处置符合2006年科学技术部发布的《关于善待实验动物的指导性意见》[6]。
1.3 肌梭传入放电的在体记录
分别注射三种浓度(1 mg·kg-1、2 mg·kg-1、3 mg· kg-1)的三磷酸腺苷二钠盐,观察大鼠比目鱼肌肌梭传入放电活动的变化。在比目鱼肌神经上分离神经细束,将细束置于单极铂金丝电极上,作为记录电极,将另一电极置于附近的肌组织中,作为参考电极,记录比目鱼肌肌梭的传入放电。对所分离的神经细束进行纤维类型鉴定时,上述的记录电极经电极转换装置可成为刺激电极,此时的记录电极则是置于比目鱼肌神经上的另一对电极,测定神经细束动作电位的传导速度,同时输入计算机进行分析处理,做序列密度直方图。
1.4 肌梭传入放电的鉴定
当比目鱼肌肌腱受到牵拉时,肌梭和腱器官这两种本体感受器的传入放电频率均可增加,根据肌肉收缩时,对肌梭的牵张刺激消失而对腱器官的牵张刺激增强的特点区分二者。具体方法如下:比目鱼肌远侧肌腱结扎线系于张力换能器探头上,在比目鱼肌神经上分离神经细束,记录到牵拉比目鱼肌远侧肌腱时传入放电频率增加的单位后,在近比目鱼肌端的神经干上施以单电震刺激(2~3倍基强度,50 Hz,0.5 ms),使比目鱼肌产生一次最大收缩,同时记录细束传入放电与肌肉收缩曲线。如果该束纤维传入放电因肌肉收缩而中断,即出现一个“空挡”,则认为此放电来自肌梭;如果肌肉收缩时放电不中断,甚至放电增加,则该束纤维的传入放电可视为来自腱器官。
肌梭的传入末梢可分为初级末梢和次极末梢,为进一步鉴定分离的神经细束是Ia类(来自初级末梢)还是Ⅱ类(来自次级末梢)传入纤维,我们对其动作电位的传导速度进行了测量。依据Hunt提出的标准对神经纤维进行分类,即动作电位传导速度大于72 m/s的传入纤维归于Ia类,传导速度在24~72 m/ s之间的传入纤维归于Ⅱ类。为了进一步鉴定分离的神经细束所引导的传入放电是来自肌梭的同一个单位的放电,我们采用传统的“逆流碰撞法”对其进行鉴别。本次实验只记录Ia类传入放电。
1.5 统计学分析
实验数据采用SPSS10.0软件中的单因素方差分析法(ANOVA)进行统计分析。实验结果以均数±标准差(±s)表示,取P<0.05作为显著性差异的界值。
2 结果
2.1 Na2ATP引起肌梭传入放电增加的量效关系
分别注射 1 mg·kg-1、2 mg·kg-1、3 mg·kg-1Na2ATP后,肌梭的传入放电峰值频率均明显增多,分别增至38.71 Hz、92.56 Hz、148.25Hz,见表1、图1。
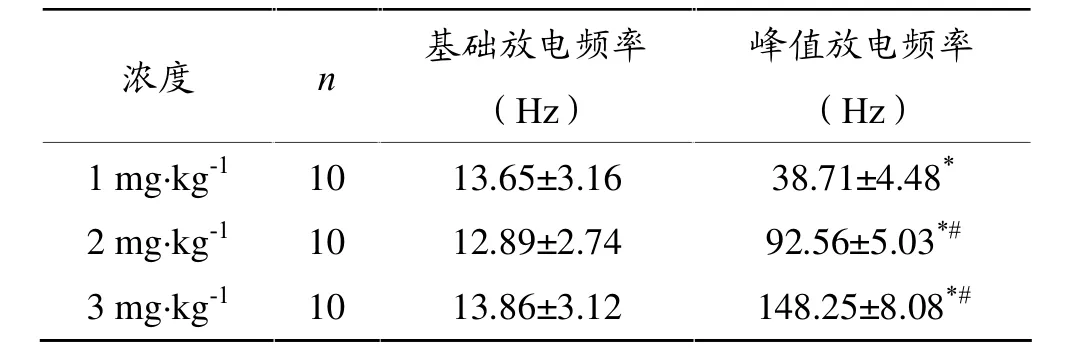
表1 注射不同浓度Na2ATP时肌梭传入放电频率的比较
2.2 Na2ATP引起肌梭传入放电增加的时效关系
表2显示,应用1 mg·kg-1、2 mg·kg-1、3 mg·kg-1Na2ATP注射后,肌梭传入放电明显增多,各剂量的潜伏期无明显差异(P>0.05);放电持续时间分别延长至20.47 min、30.65 min、51.36 min,到达峰值的时间分别为7.76 min、5.43 min、3.07 min。
表中所列各项时间指标均从注药完毕开始计算。恢复到80%时间和恢复到50%时间是指注药后放电频率最大增值 (即注药后放电频率峰值减去注药前基础放电频率之差)分别降低到80%和50%的时间,而不是用峰值计算。
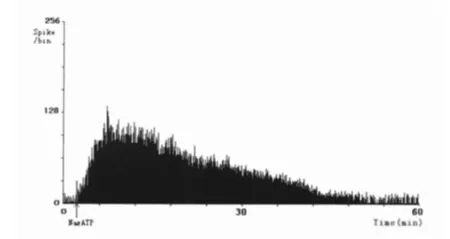
图1 注射2 mg·kg-1Na2ATP时肌梭传入放电图
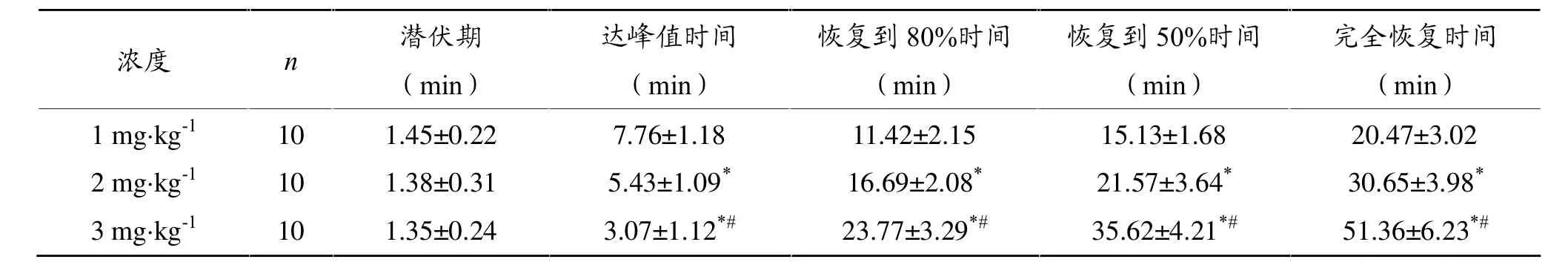
表2 不同浓度Na2ATP对肌梭传入放电的作用时程
3 讨论
梭内肌接受γ运动纤维的支配,核袋1纤维接受动力性γ(γ1)纤维的支配[7],核袋2纤维和核链纤维接受静力性γ(γ2)纤维的支配,大多数静力性γ纤维同时支配核袋纤维和核链纤维。牵张刺激使梭内肌无髓感觉终末发生机械形变,激活机械门控通道,引起Ca2+内流,降低膜电位,产生感受器电位。而在感觉终末获得髓鞘的第一个朗飞氏结处发生的局部电位即肌梭电位,也是由Ca2+内流形成的。肌梭电位达到一定程度可在轴突上引起动作电位,随着牵拉刺激的增强,肌梭电位平稳、分级地增大,动作电位频率也逐渐增高。肌梭电位幅度在动态牵拉终了时达到峰值,然后缓慢下降,在静态牵拉期内继续降低,最后稳定于某一水平。
肌梭的传入冲动是脊髓前角α运动神经元兴奋的基础,肌梭传入下降则α运动神经元放电减少。中枢神经系统可通过调节γ运动纤维的冲动频率而调节肌梭的状态,从而调节Ia类和Ⅱ类纤维的传入冲动[8]。梭运动神经元(γ神经元)分布于脊髓前角α神经元之间,约占前角细胞总数的30%。γ神经元常有自发放电,并受到高位中枢的下行易化或抑制性影响[9,10]。梭外肌收缩时对梭内肌纤维的牵拉刺激消失,但在生理情况下,由于有γ运动纤维的作用使梭内肌也兴奋,使肌梭不断地向中枢传入冲动。
本研究发现,不同浓度Na2ATP可引起肌梭传入放电增加,其增加趋势与药物剂量呈一定的依赖关系。药物的时效关系反映药效显现与消逝的过程。从结果看,注射不同浓度的Na2ATP,其潜伏期基本相同,各组之间无明显差异,由于药物均由颈外静脉血管快速注入,所以这里的潜伏期已非通常意义上的潜伏期,可以认为它主要反映了药物从颈外静脉随血流到比目鱼肌的时间。随着药物浓度升高,放电持续时间延长,到达峰值的时间也明显缩短。我们认为,Na2ATP注射液使大鼠比目鱼肌肌梭传入放电增多的可能机制有以下三点:①细胞外ATP可以引起细胞外Ca2+内流和细胞内钙库的释放[11],引起梭内肌纤维收缩,肌梭传入放电增多。另外,细胞外ATP可促进突触前膜自主释放乙酰胆碱 (Ach),而Ach与梭内肌神经-肌接头处终板膜上的受体结合,可以引起一个内向的Ca2+流[12],使Ⅰ型核袋纤维产生强力收缩,因而对肌梭有兴奋作用。上述ATP和Ach所引起的Ca2+内流和钙库的释放,可致使膜电位降低,产生感受器电位[13],而电位达到一定程度可在传入神经轴突上引起动作电位,从而使肌梭的传入放电增多;②作为能量补充剂,细胞外ATP可以提高肌梭的能量代谢水平,增加肌梭内肌浆网对Ca2+的摄取和释放活动[14],提高梭内肌纤维的收缩功能,从而使肌梭的传入放电增多;③一般认为,支配梭内肌的γ运动神经纤维和支配梭外肌的α运动神经一样,末梢释放的递质也是Ach。细胞外ATP可以引起突触前膜Ach的自主释放[15],而Ach可与γ运动神经元某些突触终板膜上的受体结合,使γ运动神经元的自发放电频率增加。因此,细胞外ATP可通过对支配梭内肌的γ运动神经纤维的刺激作用,使梭内肌细胞产生兴奋,提高了梭内肌纤维的敏感性,从而使肌梭的传入放电增多。
本研究首次发现,Na2ATP具有明显兴奋大鼠在体肌梭的作用,在整体层面上明显增加肌梭传入放电,为进一步研究Na2ATP对废用性肌萎缩的防护作用提供了理论依据和实验事实。关于用药剂量、服药时间与抗肌萎缩效果之间的关系以及影响机制,有待于进一步研究。
[1]Kawano F,Ishihara A,Stevens JL,et al.Tension and afferentinputassociated responses ofneuromuscular system of rats to hindlimb unloading and/or tenotomy.Am J Physiol Regul Integr Comp Physiol,2004,287(1):76-86.
[2]Caron AZ,Drouin G,Desrosiers J,et al.A novel hindlimb immobilization procedure forstudying skeletalmuscle atrophy and recovery in mouse.Appl Physiol,2009,106(6):2049-2059.
[3]Kawano F,Takeno Y,Nakai N,et al.Essential role of satellite cells in the growth of rat soleus muscle fibers.Am J Physiol Cell Physiol,2008,295(3):458-467.
[4] AdamsGR,Haddad F,BodellPW,etal.Combined isometric,concentric,and eccentric resistance exercise prevents unloading-induced muscle atrophy in rats.J Appl Physiol,2007,103(5):1644-1654.
[5]石磊,樊小力,吴苏娣,等.三磷酸腺苷二钠盐增强蟾蜍离体单一肌梭传入放电频率.中国运动医学杂志,2006,25(2):181-191.
[6]国科发财字〔2006〕398号.关于发布《关于善待实验动物的指导性意见》的通知.畜牧兽医科技信息,2007,4:35-36.
[7]Sugiura T,Ito N,Goto K,et al.Estrogen administration attenuates immobilization-induced skeletal muscle atrophy in male rats.J Physiol Sci Dec,2006,56(6):393-399.
[8]Mattiello-Sverzut AC,Carvalho LC,Cornachione A,et al. Morphological effects of electrical stimulation and intermittent muscle stretch after immobilization in soleus muscle.Histol Histopathol,2006,21(9):957-964.
[9]Jones KE,Wessberg J,Vallbo AB.Directional tuning of human forearm muscle afferents during voluntary wrist movements.J Physiol,2001,536(6):635-647.
[10]石磊,廉西娟,王保成,等.冬虫夏草增强蟾蜍离体单一肌梭传入放电频率.体育科学,2006,26(2):55-63.
[11]Donnelly-Roberts D,McGaraughty S,Shieh CC,et al. Painfulpurinergic receptors.PharmacolExp Ther,2008,324(2):409-415.
[12]Egan TM,Khakh BS.Contribution of calcium ions to P2X channel responses.Neurosci,2004,24(13):3413-3420.
[13] Abbracchio MP,Boeynaems JM,Barnard EA,etal. Characterization of the UDP-glucose receptor(renamed here the P2Y14 receptor)adds diversity to the P2Y receptor family.Trends Pharmacol Sci,2003,24(2):52-55.
[14]徐昌水,梁尚栋.骨骼系统P2受体的功能与炎症性骨疾病.中国药理学通报,2009,25(4):429-432.
[15]王同光,王拴科,洪光祥,等.细胞外ATP作对外周神经再生作用的实验研究.中华显微外科杂志,2001,16(5):198-200.
——从一道浙江选考生物学试题谈起

